유세포분석을 통한 노화 종양 세포의 식별 및 농축을 위한 원적색 형광 노화 관련 β-갈락토시다아제 프로브
Summary
세포 배양 또는 쥐 종양 모델에서 화학 요법 약물에 의해 유도 된 노화 암 세포의 형광, 유세포 측정 정량화를위한 프로토콜이 제시된다. 선택적 절차에는 공동 면역염색, 대규모 배치 또는 시점 분석을 용이하게 하기 위한 샘플 고정, 유세포 분석 분류에 의한 생존 가능한 노화 세포의 농축이 포함됩니다.
Abstract
세포 노화는 노화 세포에서 일반적으로 수년에 걸쳐 발생하는 생물학적 손상에 의해 유발되는 증식 정지 상태이지만 다양한 암 치료에 의해 유발 된 손상에 대한 반응으로 종양 세포에서도 빠르게 나타날 수 있습니다. 종양 세포 노화는 노화 세포가 사멸에 내성을 갖게되고 종양 완화를 차단하면서 종양 악성 종양 및 치료 내성을 악화시키기 때문에 일반적으로 바람직하지 않은 것으로 간주됩니다. 따라서 노화 종양 세포의 식별은 암 연구 커뮤니티의 지속적인 관심사입니다. 다양한 노화 분석이 존재하며, 많은 것이 잘 알려진 노화 마커인 노화 관련 베타-갈락토시다아제(SA-β-Gal)의 활성을 기반으로 합니다.
일반적으로 SA-β-Gal 분석은 고정 된 세포에 발색 기질 (X-Gal)을 사용하여 수행되며 광학 현미경으로 “파란색”노화 세포를 느리고 주관적으로 열거합니다. C12-FDG(녹색) 및 DDAO-갈락토사이드(DDAOG; far-red)를 포함한 세포 투과성 형광 SA-β-Gal 기질을 사용한 개선된 분석은 살아있는 세포의 분석을 가능하게 하고 유세포분석기를 포함한 고처리량 형광 분석 플랫폼의 사용을 가능하게 했습니다. C12-FDG는 SA-β-Gal에 대해 잘 문서화 된 프로브이지만 녹색 형광 방출은 리포 푸신 응집체의 축적으로 인해 노화 중에 발생하는 고유 세포자가 형광 (AF)과 겹칩니다. 원적색 SA-β-Gal 프로브 DDAOG를 활용하여 녹색 세포 자가형광을 노화를 확인하기 위한 보조 파라미터로 사용하여 분석에 신뢰성을 더할 수 있습니다. 나머지 형광 채널은 세포 생존율 염색 또는 선택적인 형광 면역표지에 사용될 수 있다.
유세포 분석을 사용하여 노화 종양 세포의 식별을 위한 이중 매개변수 분석으로 DDAOG 및 리포푸신 자가형광을 사용하는 것을 입증합니다. 생존 가능한 노화 세포의 백분율의 정량이 수행됩니다. 원한다면, 관심있는 세포 표면 항원을 평가하기 위해 선택적인 면역표지 단계가 포함될 수 있다. 확인된 노화 세포는 또한 유세포 분석기로 분류되고 다운스트림 분석을 위해 수집될 수 있습니다. 수집된 노화 세포는 즉시 용해되거나(예를 들어, 면역검정 또는 ‘오믹스 분석을 위해) 추가로 배양될 수 있다.
Introduction
노화 세포는 정상적인 생물학적 노화 동안 일반적으로 수년에 걸쳐 유기체에 축적되지만 방사선 및 화학 요법을 포함한 다양한 암 치료에 의해 유발 된 손상에 대한 반응으로 종양 세포에서도 빠르게 발전 할 수 있습니다. 더 이상 증식하지는 않지만 치료 유도 노화(TIS) 종양 세포는 치료 내성에 기여하고 재발을 유발할 수 있습니다1,2,3. TIS 세포에 의해 분비되는 인자는 면역 회피 또는 전이를 촉진하여 종양 악성 종양을 악화시킬 수 있습니다 4,5. TIS 세포는 복잡한 상황별 표현형, 변경된 대사 프로필 및 고유한면역 반응을 발달시킵니다6,7,8. 따라서 다양한 암 치료 접근법에 의해 유도 된 TIS 종양 세포의 확인 및 특성화는 암 연구 커뮤니티의 지속적인 관심 주제입니다.
TIS 종양 세포를 검출하기 위해, 종래의 노화 분석은 주로 노화 마커 효소 인 리소좀 베타-갈 락토시다 제 GLB19의 증가 된 활성을 검출하는 것에 기초하여 널리 사용된다. 중성에 가까운(산성이 아닌) 리소좀 pH에서 검출하면 노화 관련 베타-갈락토시다아제(SA-β-Gal)를 특이적으로 검출할 수 있습니다10. 수십 년 동안 사용되어 온 표준 SA-β-Gal 분석은 청색 발색 베타 갈락토시다제 기질인 X-Gal(5-브로모-4-클로로-3-인돌릴-β-D-갈락토피라노사이드)을 사용하여 광학 현미경으로 고정 세포에서 SA-β-Gal을 검출합니다11. X-Gal 분석을 통해 일반적으로 사용 가능한 시약 및 실험실 장비를 사용하여 TIS를 정성적으로 시각적으로 확인할 수 있습니다. 기본 투과광 현미경은 청색 발색의 존재를 평가하는 데 필요한 유일한 기기입니다. 그러나 X-Gal 염색 절차는 감도가 부족할 수 있으며 때로는 색상이 발생하는 데 24시간 이상이 필요합니다. 염색 후에는 광학 현미경으로 청색 발색의 강도 수준을 나타내는 세포를 계수하는 것을 기반으로 개별 노화 세포의 낮은 처리량, 주관적인 점수가 이어집니다. X-Gal은 세포 불투과성이므로 이 분석에는 다운스트림 분석을 위해 회수할 수 없는 용매 고정 세포가 필요합니다. 동물이나 환자의 제한된 샘플로 작업 할 때 이는 큰 단점이 될 수 있습니다.
C12-FDG(5-도데카노일아미노플루오레세인 디-β-D-갈락토피라노사이드, 녹색) 및 DDAOG(9H-(1,3-디클로로-9,9-디메틸아크리딘-2-온-7-일)β-D-갈락토피라노사이드, 원적색)를 포함한 세포 투과, 형광 효소 기질을 사용하는 개선된 SA-β-Gal 분석은 이전에 문헌12,13,14,15에 나타났습니다. DDAOG의 화학적 프로브 구조 및 광학적 특성은 보충 그림 S1에 나와 있습니다. 이러한 세포 투과성 프로브를 사용하면 고정되지 않은 살아있는 세포를 분석할 수 있으며, 발색성 프로브가 아닌 형광 프로브는 고함량 스크리닝 기기 및 유세포분석기를 포함한 신속한 고처리량 형광 분석 플랫폼의 사용을 용이하게 합니다. 분류 유세포분석기는 다운스트림 분석(예: 웨스턴 블로팅, ELISA 또는 ‘omics)을 위해 세포 배양 또는 종양으로부터 살아있는 노화 세포의 농축 개체군을 회수할 수 있습니다. 형광 분석은 또한 정량적 신호를 제공하여 주어진 샘플 내에서 노화 세포의 백분율을 보다 정확하게 결정할 수 있습니다. 생존성 프로브 및 형광단 표지 항체를 포함한 추가 형광 프로브를 쉽게 추가하여 SA-β-Gal 이상의 표적을 다중화 분석할 수 있습니다.
DDAOG와 유사하게 C12-FDG는 SA-β-Gal의 형광 프로브이지만 녹색 형광 방출은 세포16에 리포푸신 응집체가 축적되어 노화 중에 발생하는 고유 세포 AF와 겹칩니다. 원적색 DDAOG 프로브를 활용하여 녹색 셀룰러 AF를 노화를 확인하기 위한 보조 매개변수로 사용할 수 있습니다17. 이는 SA-β-Gal 외에 두 번째 마커를 사용하여 분석 신뢰성을 향상시키는데, 이는 종종 노화18에 대한 단일 마커로서 신뢰할 수 없을 수 있습니다. 노화 세포에서 내인성 AF의 검출은 표지가 없는 접근 방식이므로 DDAOG 기반 분석의 특이성을 확장하는 빠르고 간단한 방법입니다.
이 프로토콜에서 우리는 시험관 내 배양에서 생존 가능한 TIS 종양 세포를 식별하거나 마우스에서 확립된 약물 처리 종양에서 분리하기 위한 신속한 이중 매개변수 유세포분석 분석으로 DDAOG 및 AF를 사용하는 것을 보여줍니다(그림 1). 이 프로토콜은 광범위한 표준 상용 유세포분석 분석기 및 분류기와 호환되는 형광단을 사용합니다(표 1). 표준 유세포분석 분석을 이용한 생존가능한 노화 세포의 백분율의 정량이 가능하다. 원한다면, 선택적인 면역표지 단계를 수행하여 관심있는 세포 표면 항원을 노화와 동시에 평가할 수 있다. 확인된 노화 세포는 표준 형광 활성화 세포 분류(FACS) 방법론을 사용하여 농축할 수도 있습니다.
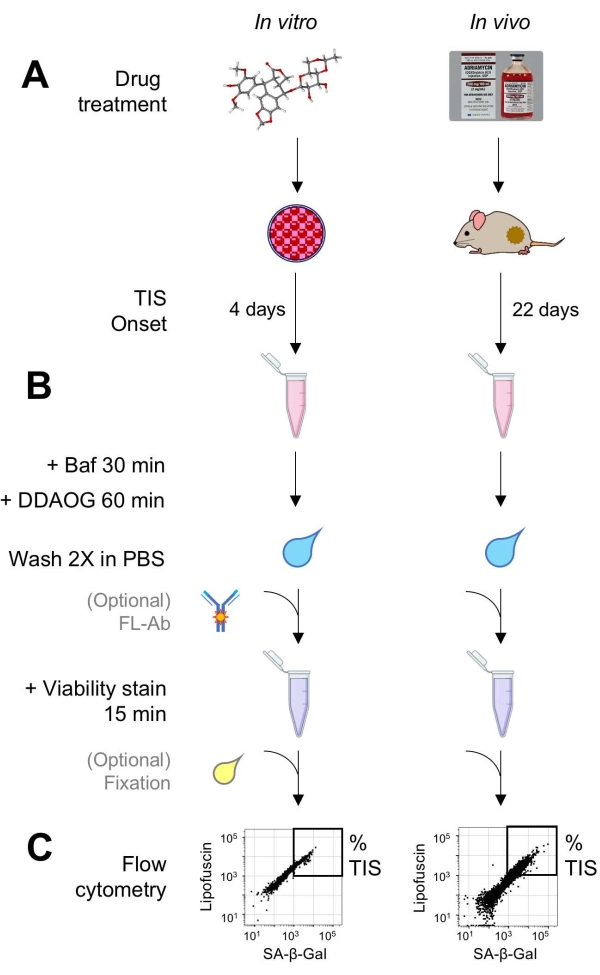
그림 1: 실험적 워크플로. DDAOG 분석의 요점을 요약한 개략도. (a) TIS 유도 약물을 포유동물 배양 세포에 첨가하거나 종양 보유 마우스에 투여한다. 그런 다음 TIS의 발병에 시간이 허용됩니다 : 세포의 경우, 치료 후 4 일; 마우스의 경우 총 22 일, 5 일마다 3 회 치료와 7 일 회복. 세포가 수확되거나 종양이 현탁액으로 해리됩니다. (B) 샘플을 Baf로 처리하여 30 분 동안 SA-β-Gal 검출을 위해 리소좀 pH를 조정합니다. 그런 다음 DDAOG 프로브를 60 분 동안 추가하여 SA-β-Gal을 검출합니다. 샘플을 PBS에서 2x 세척하고, 생존성 염색을 간단히 첨가한다(15분). 임의로, 샘플은 개방 형광 채널에서 형광 항체로 염색될 수 있고/있거나 추후 분석을 위해 고정될 수 있다. (C) 샘플은 표준 유세포 분석기를 사용하여 분석됩니다. 생존 가능한 세포는 빨간색 DDAOG (SA-β-Gal을 나타냄) 대 녹색자가 형광 (리포 푸신)을 보여주는 점도표로 시각화됩니다. TIS 세포의 백분율을 결정하기 위한 게이트는 처리되지 않은 대조군 샘플에 기초하여 확립된다(도시되지 않음). 분류 세포분석기(FACS)를 사용하는 경우 TIS 세포를 수집하여 추가 시험관 내 분석을 위해 배양에 다시 넣거나 분자 생물학 분석을 위해 용해 및 처리할 수 있습니다. 약어 : DDAO = 9H- (1,3- 디클로로 -9,9- 디메틸 아 크리 딘 -2- 온); DDAOG = DDAO-갈락토사이드; TIS = 치료 유도 노화; FL-Ab = 형광단-접합 항체; Baf = 바필로마이신 A1; SA-β-Gal = 노화-관련 베타-갈락토시다제; PBS = 인산염-완충 식염수; FACS = 형광 활성화 세포 분류. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 형광단 | 감지 | 전 / 엠 (nm) | 사이토 미터 레이저 (nm) | 세포계 검출기/대역통과 필터(nm) |
| 다오그 | 사β갈 | 645/6601 | 640 | 670 / 30 |
| AF | 리포푸신 | < 600 | 488 | 525 / 50 |
| 이력서450 | 생존 능력 | 408/450 | 405 | 450 / 50 |
| 체육 | 항체/표면 마커 | 565/578 | 561 | 582 / 15 |
표 1: 형광단 및 세포분석기 광학 사양. 이 프로토콜에 사용되는 세포분석기 사양은 총 4개의 레이저와 15개의 방출 검출기가 있는 기기에 대해 나열됩니다. 645/660 nm에서 검출된 DDAOG는 SA-β-Gal1에 의해 절단된 프로브의 형태이다. 절단되지 않은 DDAOG는 460/610nm에서 낮은 수준의 형광을 나타낼 수 있지만 프로토콜의 세척 단계에 의해 제거됩니다. 약어 : DDAO = 9H- (1,3- 디클로로 -9,9- 디메틸 아 크리 딘 -2- 온); DDAOG = DDAO-갈락토사이드; AF =자가 형광; PE = 피코 에리트 린; SA-β-Gal = 노화 관련 베타-갈락토시다아제.
Protocol
Representative Results
Discussion
지난 10여 년 동안 유세포분석은 종양 면역학의 새로운 인기, 저비용 유세포분석기의 개발 및 학술 기관의 공유 기기 시설 개선으로 인해 암 연구에서 보다 일반적인 분석 플랫폼이 되었습니다. 대부분의 최신 기기에는 보라색, 청록색 및 적색에서 원적색 광학 어레이가 장착되어 있기 때문에 다색 분석이 이제 표준입니다. 따라서, 이 DDAOG 프로토콜은 광범위한 유세포분석기와 호환될 가능성이 높…
Disclosures
The authors have nothing to disclose.
Acknowledgements
유세포분석 기기에 대한 지원을 해주신 시카고 대학교의 세포분석 및 항체 핵심 시설에 감사드립니다. 시카고 대학의 동물 연구 센터는 동물 주택을 제공했습니다.
Materials
| Bafilomycin A1 | Research Products International | B40500 | |
| Bleomycin sulfate | Cayman | 13877 | |
| Bovine serum albumin (BSA) | US Biological | A1380 | |
| Calcein Violet 450 AM viability dye | ThermoFisher Scientific | 65-0854-39 | eBioscience |
| DPP4 antibody, PE conjugate | Biolegend | 137803 | Clone H194-112 |
| Cell line: A549 human lung adenocarcinoma | American Type Culture Collection | CCL-185 | |
| Cell line: B16-F10 mouse melanoma | American Type Culture Collection | CRL-6475 | |
| Cell scraper | Corning | 3008 | |
| Cell strainers, 100 µm | Falcon | 352360 | |
| DDAO-Galactoside | Life Technologies | D6488 | |
| DMEM medium 1x | Life Technologies | 11960-069 | |
| DMSO | Sigma | D2438 | |
| DNAse I | Sigma | DN25 | |
| Doxorubicin, hydrochloride injection (USP) | Pfizer | NDC 0069-3032-20 | |
| Doxorubicin, PEGylated liposomal (USP) | Sun Pharmaceutical | NDC 47335-049-40 | |
| EDTA 0.5 M | Life Technologies | 15575-038 | |
| Etoposide | Cayman | 12092 | |
| FBS | Omega | FB-11 | |
| Fc receptor blocking reagent | Biolegend | 101320 | Anti-mouse CD16/32 |
| Flow cytometer (cell analyzer) | Becton Dickinson (BD) | Various | LSRFortessa |
| Flow cytometer (cell sorter) | Becton Dickinson (BD) | Various | FACSAria |
| GlutaMax 100x | Life Technologies | 35050061 | |
| HEPES 1 M | Lonza | BW17737 | |
| Liberase TL | Sigma | 5401020001 | Roche |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Penicillin/Streptomycin 100x | Life Technologies | 15140122 | |
| Phosphate buffered saline (PBS) 1x | Corning | MT21031CV | Dulbecco's PBS (without calcium and magnesium) |
| Rainbow calibration particles, ultra kit | SpheroTech | UCRP-38-2K | 3.5-3.9 µm, 2E6/mL |
| RPMI-1640 medium 1x | Life Technologies | 11875-119 | |
| Sodium chloride 0.9% (USP) | Baxter Healthcare Corporation | 2B1324 | |
| Software for cytometer data acquisition, "FACSDiva" | Becton Dickinson (BD) | n/a | Contact BD for license |
| Software for cytometer data analysis, "FlowJo" | TreeStar | n/a | Contact TreeStar for license |
| Trypsin-EDTA 0.25% | Life Technologies | 25200-114 |
References
- Saleh, T., Tyutyunyk-Massey, L., Gewirtz, D. A. Tumor cell escape from therapy-induced senescence as a model of disease recurrence after dormancy. 암 연구학. 79 (6), 1044-1046 (2019).
- Wang, B., Kohli, J., Demaria, M. Senescent cells in cancer therapy: friends or foes. Trends in Cancer. 6 (10), 838-857 (2020).
- Prasanna, P. G., et al. Therapy-induced senescence: Opportunities to improve anticancer therapy. Journal of the National Cancer Institute. 113 (10), 1285-1298 (2021).
- Velarde, M. C., Demaria, M., Campisi, J. Senescent cells and their secretory phenotype as targets for cancer therapy. Interdisciplinary Topics in Gerontology and Geriatrics. 38, 17-27 (2013).
- Ou, H. L., et al. Cellular senescence in cancer: from mechanisms to detection. Molecular Oncology. 15 (10), 2634-2671 (2021).
- Hernandez-Segura, A., Nehme, J., Demaria, M. Hallmarks of cellular senescence. Trends in Cell Biology. 28 (6), 436-453 (2018).
- Bojko, A., Czarnecka-Herok, J., Charzynska, A., Dabrowski, M., Sikora, E. Diversity of the senescence phenotype of cancer cells treated with chemotherapeutic agents. Cells. 8 (12), 1501 (2019).
- Mikuła-Pietrasik, J., Niklas, A., Uruski, P., Tykarski, A., Książek, K. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cellular and Molecular Life Sciences. 77 (2), 213-229 (2020).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging cell. 5 (2), 187-195 (2006).
- Itahana, K., Itahana, Y., Dimri, G. P. Colorimetric detection of senescence-associated β galactosidase. Methods in Molecular Biology. 965, 143-156 (2013).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences of the United States of America. 92 (20), 9363-9367 (1995).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Noppe, G., et al. Rapid flow cytometric method for measuring senescence associated beta-galactosidase activity in human fibroblasts. Cytometry A. 75 (11), 910-916 (2009).
- Tung, C. -. H., et al. In vivo imaging of β-galactosidase activity using far red fluorescent switch. 암 연구학. 64 (5), 1579-1583 (2004).
- Gong, H., et al. beta-Galactosidase activity assay using far-red-shifted fluorescent substrate DDAOG. Analytical Biochemistry. 386 (1), 59-64 (2009).
- Terman, A., Brunk, U. T. Lipofuscin: Mechanisms of formation and increase with age. APMIS. 106 (2), 265-276 (1998).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging. 5 (1), 37-50 (2013).
- Wang, B., Demaria, M. The quest to define and target cellular senescence in cancer. 암 연구학. 81 (24), 6087-6089 (2021).
- Appelbe, O. K., Zhang, Q., Pelizzari, C. A., Weichselbaum, R. R., Kron, S. J. Image-guided radiotherapy targets macromolecules through altering the tumor microenvironment. Molecular Pharmaceutics. 13 (10), 3457-3467 (2016).
- Maciorowski, Z., Chattopadhyay, P. K., Jain, P. Basic multicolor flow cytometry. Current Protocols in Immunology. 117, 1-38 (2017).
- Fan, Y., Cheng, J., Zeng, H., Shao, L. Senescent cell depletion through targeting BCL-family proteins and mitochondria. Frontiers in Physiology. 11, 593630 (2020).
- Kim, K. M., et al. Identification of senescent cell surface targetable protein DPP4. Genes and Development. 31 (15), 1529-1534 (2017).
- Flor, A. C., Kron, S. J. Lipid-derived reactive aldehydes link oxidative stress to cell senescence. Cell Death Discovery. 7 (9), 2366 (2016).
- Jochems, F., et al. The Cancer SENESCopedia: A delineation of cancer cell senescence. Cell reports. 36 (4), 109441 (2021).
- Fallah, M., et al. Doxorubicin and liposomal doxorubicin induce senescence by enhancing nuclear factor kappa B and mitochondrial membrane potential. Life Sciences. 232, 116677 (2019).
- Kasper, M., Barth, K. Bleomycin and its role in inducing apoptosis and senescence in lung cells – modulating effects of caveolin-1. Current Cancer Drug Targets. 9 (3), 341-353 (2009).
- Muthuramalingam, K., Cho, M., Kim, Y. Cellular senescence and EMT crosstalk in bleomycin-induced pathogenesis of pulmonary fibrosis-an in vitro analysis. Cell Biology International. 44 (2), 477-487 (2020).
- Flor, A. C., Wolfgeher, D., Wu, D., Kron, S. J. A signature of enhanced lipid metabolism, lipid peroxidation and aldehyde stress in therapy-induced senescence. Cell Death Discovery. 3, 17075 (2017).
- Burd, C. E., et al. Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model. Cell. 152 (1-2), 340-351 (2013).
- Liu, J. Y., et al. Cells exhibiting strong p16 (INK4a) promoter activation in vivo display features of senescence. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2603-2611 (2019).
- Wang, L., Lankhorst, L., Bernards, R. Exploiting senescence for the treatment of cancer. Nature Reviews Cancer. 22 (6), 340-355 (2022).
- Baek, K. -. H., Ryeom, S. Detection of oncogene-induced senescence in vivo. Methods in Molecular Biology. 1534, 185-198 (2017).
- González-Gualda, E., Baker, A. G., Fruk, L., Muñoz-Espín, D. A guide to assessing cellular senescence in vitro and in vivo. The FEBS Journal. 288 (1), 56-80 (2021).

