Far-Red Fluorescerende Senescence-Associated β-Galactosidase Probe for identifisering og anrikning av Senescent tumorceller ved flowcytometri
Summary
En protokoll for fluorescerende, flowcytometrisk kvantifisering av senescent kreftceller indusert av kjemoterapi narkotika i cellekultur eller i murine tumor modeller presenteres. Valgfrie prosedyrer inkluderer co-immunostaining, prøvefiksering for å lette stor batch- eller tidspunktanalyse, og anrikning av levedyktige senescentceller ved flowcytometrisk sortering.
Abstract
Cellulær senescens er en tilstand av proliferativ arrestasjon indusert av biologisk skade som normalt påløper over år i aldrende celler, men kan også dukke opp raskt i tumorceller som et svar på skade forårsaket av ulike kreftbehandlinger. Tumorcellesenescens anses generelt som uønsket, da senescentceller blir resistente mot død og blokkerer tumorremisjon mens de forverrer tumormalignitet og behandlingsresistens. Derfor er identifisering av senescent tumorceller av pågående interesse for kreftforskningsmiljøet. Ulike senescence analyser eksisterer, mange basert på aktiviteten til den velkjente senescence markøren, senescence-assosiert beta-galactosidase (SA-β-Gal).
Vanligvis utføres SA-β-Gal-analysen ved bruk av et kromogent substrat (X-Gal) på faste celler, med langsom og subjektiv oppregning av “blå” senescentceller ved lysmikroskopi. Forbedrede analyser ved bruk av cellepermeante, fluorescerende SA-β-Gal-substrater, inkludert C12-FDG (grønn) og DDAO-Galactoside (DDAOG; langt rød), har gjort det mulig å analysere levende celler og tillatt bruk av fluorescerende analyseplattformer med høy gjennomstrømning, inkludert flowcytometre. C12-FDG er en veldokumentert sonde for SA-β-Gal, men dens grønne fluorescerende utslipp overlapper med egen cellulær autofluorescens (AF) som oppstår under senescens på grunn av akkumulering av lipofuscinaggregater. Ved å bruke den langt røde SA-β-Gal-sonden DDAOG, kan grønn cellulær autofluorescens brukes som en sekundær parameter for å bekrefte senescence, noe som gir pålitelighet til analysen. De resterende fluorescenskanalene kan brukes til celle levedyktighet farging eller valgfri fluorescerende immunmerking.
Ved hjelp av flowcytometri demonstrerer vi bruken av DDAOG og lipofuscin autofluorescens som en dual-parameter analyse for identifisering av senescent tumorceller. Kvantifisering av prosentandelen av levedyktige senescentceller utføres. Om ønskelig kan et valgfritt immunmerkingstrinn inkluderes for å evaluere celleoverflateantigener av interesse. Identifiserte senescentceller kan også flyte cytometrisk sortert og samlet for nedstrøms analyse. Oppsamlede senescentceller kan umiddelbart lyses (f.eks. for immunoassays eller ‘omics analyse) eller videre dyrket.
Introduction
Senescent celler akkumuleres normalt i organismer over år under normal biologisk aldring, men kan også utvikle seg raskt i tumorceller som et svar på skade forårsaket av ulike kreftbehandlinger, inkludert stråling og kjemoterapi. Selv om det ikke lenger sprer seg, kan terapiinduserte senescent (TIS) tumorceller bidra til behandlingsresistens og drive tilbakefall 1,2,3. Faktorer utskilt av TIS-celler kan forverre tumor malignitet ved å fremme immununnvikelse eller metastase 4,5. TIS-celler utvikler komplekse, kontekstspesifikke fenotyper, endrede metabolske profiler og unike immunresponser 6,7,8. Derfor er identifisering og karakterisering av TIS-tumorceller indusert av ulike kreftbehandlingsmetoder et tema av kontinuerlig interesse for kreftforskningsmiljøet.
For å oppdage TIS-tumorceller er konvensjonelle senescensanalyser mye brukt, hovedsakelig basert på å oppdage økt aktivitet av senescensmarkørenzymet, den lysosomale beta-galaktosidase GLB19. Deteksjon ved en nesten nøytral (snarere enn sur) lysosomal pH muliggjør spesifikk påvisning av senescensassosiert beta-galaktosidase (SA-β-Gal)10. En standard SA-β-Gal-analyse som har blitt brukt i flere tiår, bruker X-Gal (5-bromo-4-chloro-3-indolyl-β-D-galactopyranoside), et blått kromogent beta-galaktosidasesubstrat, for å oppdage SA-β-Gal i faste celler ved lysmikroskopi11. X-Gal-analysen tillater kvalitativ visuell bekreftelse av TIS ved bruk av allment tilgjengelige reagenser og laboratorieutstyr. Et grunnleggende overført lysmikroskop er den eneste instrumenteringen som kreves for å evaluere tilstedeværelsen av det blå kromogenet. Imidlertid kan X-Gal-fargeprosedyren mangle følsomhet, noen ganger krever mer enn 24 timer for at farge skal utvikle seg. Farging etterfølges av lav gjennomstrømning, subjektiv scoring av individuelle senescentceller basert på å telle cellene som viser et visst intensitetsnivå av det blå kromogenet under et lysmikroskop. Siden X-Gal er celle-ugjennomtrengelig, krever denne analysen løsemiddelfikserte celler, som ikke kan gjenopprettes for nedstrømsanalyse. Ved arbeid med begrensede prøver fra dyr eller pasienter kan dette være en stor ulempe.
Forbedrede SA-β-Gal-analyser ved bruk av cellepermeante, fluorescerende enzymsubstrater, inkludert C 12-FDG (5-dodecanoylaminofluorescein Di-β-D-Galactopyranoside, grønn) og DDAOG (9H-(1,3-diklor-9,9-dimetylacridin-2-en-7-yl) β-D-Galactopyranoside, langt rød) har tidligere dukket opp i litteraturen12,13,14,15. Den kjemiske sondestrukturen og optiske egenskapene til DDAOG er vist i tilleggsfigur S1. Disse celle-permeant sonder tillater analyse av levende (snarere enn faste) celler, og fluorescerende snarere enn kromogene prober lette bruken av raske high-throughput fluorescerende analyseplattformer, inkludert høyinnhold screening instrumenter og flow cytometre. Sortering av flowcytometre muliggjør gjenoppretting av berikede populasjoner av levende senescentceller fra cellekulturer eller svulster for nedstrøms analyse (f.eks. Western blotting, ELISA eller ‘omics). Fluorescensanalyse gir også et kvantitativt signal, noe som muliggjør mer nøyaktig bestemmelse av prosentandelen av senescentceller i en gitt prøve. Ytterligere fluorescerende prober, inkludert levedyktighetssonder og fluoroformerkede antistoffer, kan lett legges til for multiplekset analyse av mål utover SA-β-Gal.
I likhet med DDAOG er C12-FDG en fluorescerende sonde for SA-β-Gal, men dens grønne fluorescerende utslipp overlapper med inneboende cellulær AF, som oppstår under aldring på grunn av akkumulering av lipofuscinaggregater i celler16. Ved å bruke den langt røde DDAOG-sonden, kan grønn cellulær AF brukes som en sekundær parameter for å bekrefte senescence17. Dette forbedrer analysepåliteligheten ved å bruke en annen markør i tillegg til SA-β-Gal, som ofte kan være upålitelig som en enkelt markør for senescence18. Siden deteksjon av endogen AF i senescentceller er en etikettfri tilnærming, er det en rask og enkel måte å utvide spesifisiteten til vår DDAOG-baserte analyse.
I denne protokollen demonstrerer vi bruken av DDAOG og AF som en rask, dual-parameter flowcytometrianalyse for identifisering av levedyktige TIS-tumorceller fra in vitro-kulturer eller isolert fra legemiddelbehandlede svulster etablert hos mus (figur 1). Protokollen bruker fluoroforer som er kompatible med et bredt spekter av standard kommersielle flowcytometrianalysatorer og sorteringsmaskiner (tabell 1). Kvantifisering av prosentandelen av levedyktige senescentceller ved bruk av standard flowcytometrianalyse er aktivert. Om ønskelig kan et valgfritt immunmerkingstrinn utføres for å evaluere celleoverflateantigener av interesse samtidig med senescens. Identifiserte senescentceller kan også berikes ved hjelp av standard fluorescensaktivert cellesortering (FACS) metodikk.
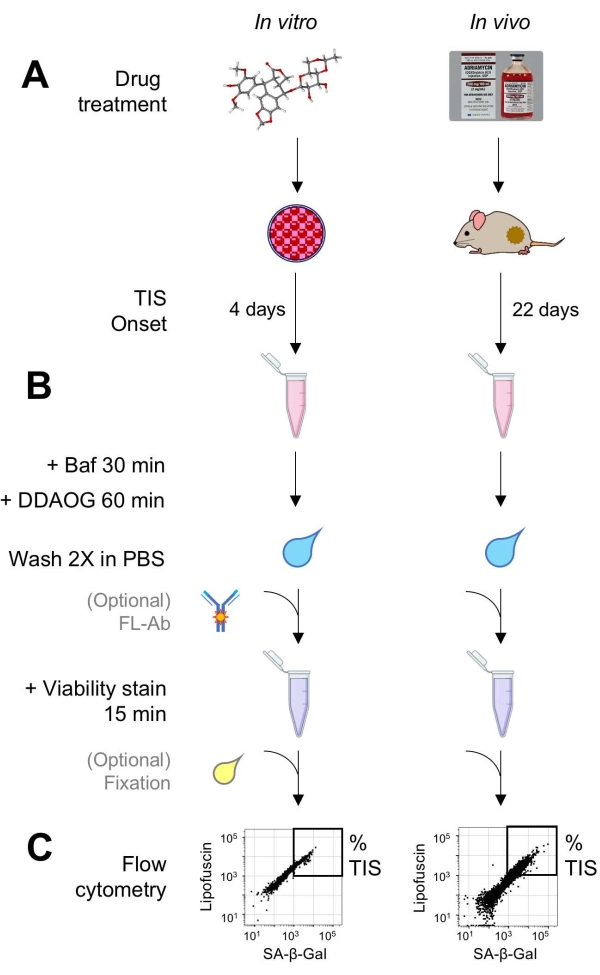
Figur 1: Eksperimentell arbeidsflyt. En skjematisk oppsummering av nøkkelpunkter i DDAOG-analysen. (A) Et TIS-induserende legemiddel tilsettes pattedyrdyrkede celler eller administreres til tumorbærende mus. Tid er da tillatt for utbruddet av TIS: for celler, 4 dager etter behandling; For mus, 22 dager totalt, med tre behandlinger hver 5. dag pluss 7 dager utvinning. Celler høstes eller svulster dissosieres til suspensjon. (B) Prøver behandles med Baf for å justere lysosomal pH for påvisning av SA-β-Gal i 30 minutter; deretter legges DDAOG-sonden til i 60 minutter for å oppdage SA-β-Gal. Prøver vaskes 2x i PBS, og en levedyktighetsflekk tilsettes kort (15 min). Eventuelt kan prøver farges med fluorescerende antistoffer i åpne fluorescenskanaler og / eller fikses for senere analyse. (C) Prøver analyseres ved hjelp av et standard flowcytometer. Levedyktige celler visualiseres i punktplott som viser rød DDAOG (indikerer SA-β-Gal) versus grønn autofluorescens (lipofuscin). En port for å bestemme prosentandelen av TIS-celler er etablert basert på ubehandlede kontrollprøver (ikke vist). Hvis et sorteringscytometer (FACS) brukes, kan TIS-celler samles og plasseres tilbake i kultur for videre in vitro-analyser eller lyses og behandles for molekylærbiologiske analyser. Forkortelser: DDAO = 9H- (1,3-diklor-9,9-dimetylacridin-2-en); DDAOG = DDAO-Galactoside; TIS = terapi-indusert senescence; FL-Ab = fluorofor-konjugert antistoff; Baf = Bafilomycin A1; SA-β-Gal = senescence-assosiert beta-galaktosidase; PBS = fosfatbufret saltvann; FACS = fluorescensaktivert cellesortering. Vennligst klikk her for å se en større versjon av denne figuren.
| Fluorophore | Oppdager | Eks/Em (nm) | Cytometer laser (nm) | Cytometer detektor / båndpassfilter (nm) |
| DDAOG | SA-β-Gal | 645/6601 | 640 | 670 / 30 |
| AF | Lipofuscin | < 600 | 488 | 525 / 50 |
| CV450 | Levedyktighet | 408/450 | 405 | 450 / 50 |
| PE | Antistoff/overflatemarkør | 565/578 | 561 | 582 / 15 |
Tabell 1: Fluoroforer og cytometer optiske spesifikasjoner. Cytometerspesifikasjoner som brukes i denne protokollen er oppført for et instrument med totalt 4 lasere og 15 utslippsdetektorer. DDAOG oppdaget ved 645/660 nm er formen av sonden spaltet av SA-β-Gal1. Uncleaved DDAOG kan vise lavt nivå fluorescens ved 460/610 nm, men fjernes ved vask trinn i protokollen. Forkortelser: DDAO = 9H- (1,3-diklor-9,9-dimetylacridin-2-en); DDAOG = DDAO-Galactoside; AF = autofluorescens; PE = phycoerythrin; SA-β-Gal = senescence-assosiert beta-galaktosidase.
Protocol
Representative Results
Discussion
I løpet av det siste tiåret eller så har flowcytometri blitt en mer vanlig analyseplattform i kreftforskning på grunn av den fremvoksende populariteten til tumorimmunologi, utvikling av billigere flowcytometre og forbedring av delte instrumenteringsfasiliteter ved akademiske institusjoner. Flerfargede analyser er nå standard, da de fleste nyere instrumenter er utstyrt med fiolette, blågrønne og røde til langt røde optiske arrays. Dermed vil denne DDAOG-protokollen sannsynligvis være kompatibel med et bredt spek…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi takker kjernefasiliteten for cytometri og antistoffer ved University of Chicago for støtte til instrumentering av flowcytometri. Animal Research Center ved University of Chicago ga dyreboliger.
Materials
| Bafilomycin A1 | Research Products International | B40500 | |
| Bleomycin sulfate | Cayman | 13877 | |
| Bovine serum albumin (BSA) | US Biological | A1380 | |
| Calcein Violet 450 AM viability dye | ThermoFisher Scientific | 65-0854-39 | eBioscience |
| DPP4 antibody, PE conjugate | Biolegend | 137803 | Clone H194-112 |
| Cell line: A549 human lung adenocarcinoma | American Type Culture Collection | CCL-185 | |
| Cell line: B16-F10 mouse melanoma | American Type Culture Collection | CRL-6475 | |
| Cell scraper | Corning | 3008 | |
| Cell strainers, 100 µm | Falcon | 352360 | |
| DDAO-Galactoside | Life Technologies | D6488 | |
| DMEM medium 1x | Life Technologies | 11960-069 | |
| DMSO | Sigma | D2438 | |
| DNAse I | Sigma | DN25 | |
| Doxorubicin, hydrochloride injection (USP) | Pfizer | NDC 0069-3032-20 | |
| Doxorubicin, PEGylated liposomal (USP) | Sun Pharmaceutical | NDC 47335-049-40 | |
| EDTA 0.5 M | Life Technologies | 15575-038 | |
| Etoposide | Cayman | 12092 | |
| FBS | Omega | FB-11 | |
| Fc receptor blocking reagent | Biolegend | 101320 | Anti-mouse CD16/32 |
| Flow cytometer (cell analyzer) | Becton Dickinson (BD) | Various | LSRFortessa |
| Flow cytometer (cell sorter) | Becton Dickinson (BD) | Various | FACSAria |
| GlutaMax 100x | Life Technologies | 35050061 | |
| HEPES 1 M | Lonza | BW17737 | |
| Liberase TL | Sigma | 5401020001 | Roche |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Penicillin/Streptomycin 100x | Life Technologies | 15140122 | |
| Phosphate buffered saline (PBS) 1x | Corning | MT21031CV | Dulbecco's PBS (without calcium and magnesium) |
| Rainbow calibration particles, ultra kit | SpheroTech | UCRP-38-2K | 3.5-3.9 µm, 2E6/mL |
| RPMI-1640 medium 1x | Life Technologies | 11875-119 | |
| Sodium chloride 0.9% (USP) | Baxter Healthcare Corporation | 2B1324 | |
| Software for cytometer data acquisition, "FACSDiva" | Becton Dickinson (BD) | n/a | Contact BD for license |
| Software for cytometer data analysis, "FlowJo" | TreeStar | n/a | Contact TreeStar for license |
| Trypsin-EDTA 0.25% | Life Technologies | 25200-114 |
References
- Saleh, T., Tyutyunyk-Massey, L., Gewirtz, D. A. Tumor cell escape from therapy-induced senescence as a model of disease recurrence after dormancy. 암 연구학. 79 (6), 1044-1046 (2019).
- Wang, B., Kohli, J., Demaria, M. Senescent cells in cancer therapy: friends or foes. Trends in Cancer. 6 (10), 838-857 (2020).
- Prasanna, P. G., et al. Therapy-induced senescence: Opportunities to improve anticancer therapy. Journal of the National Cancer Institute. 113 (10), 1285-1298 (2021).
- Velarde, M. C., Demaria, M., Campisi, J. Senescent cells and their secretory phenotype as targets for cancer therapy. Interdisciplinary Topics in Gerontology and Geriatrics. 38, 17-27 (2013).
- Ou, H. L., et al. Cellular senescence in cancer: from mechanisms to detection. Molecular Oncology. 15 (10), 2634-2671 (2021).
- Hernandez-Segura, A., Nehme, J., Demaria, M. Hallmarks of cellular senescence. Trends in Cell Biology. 28 (6), 436-453 (2018).
- Bojko, A., Czarnecka-Herok, J., Charzynska, A., Dabrowski, M., Sikora, E. Diversity of the senescence phenotype of cancer cells treated with chemotherapeutic agents. Cells. 8 (12), 1501 (2019).
- Mikuła-Pietrasik, J., Niklas, A., Uruski, P., Tykarski, A., Książek, K. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cellular and Molecular Life Sciences. 77 (2), 213-229 (2020).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging cell. 5 (2), 187-195 (2006).
- Itahana, K., Itahana, Y., Dimri, G. P. Colorimetric detection of senescence-associated β galactosidase. Methods in Molecular Biology. 965, 143-156 (2013).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences of the United States of America. 92 (20), 9363-9367 (1995).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Noppe, G., et al. Rapid flow cytometric method for measuring senescence associated beta-galactosidase activity in human fibroblasts. Cytometry A. 75 (11), 910-916 (2009).
- Tung, C. -. H., et al. In vivo imaging of β-galactosidase activity using far red fluorescent switch. 암 연구학. 64 (5), 1579-1583 (2004).
- Gong, H., et al. beta-Galactosidase activity assay using far-red-shifted fluorescent substrate DDAOG. Analytical Biochemistry. 386 (1), 59-64 (2009).
- Terman, A., Brunk, U. T. Lipofuscin: Mechanisms of formation and increase with age. APMIS. 106 (2), 265-276 (1998).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging. 5 (1), 37-50 (2013).
- Wang, B., Demaria, M. The quest to define and target cellular senescence in cancer. 암 연구학. 81 (24), 6087-6089 (2021).
- Appelbe, O. K., Zhang, Q., Pelizzari, C. A., Weichselbaum, R. R., Kron, S. J. Image-guided radiotherapy targets macromolecules through altering the tumor microenvironment. Molecular Pharmaceutics. 13 (10), 3457-3467 (2016).
- Maciorowski, Z., Chattopadhyay, P. K., Jain, P. Basic multicolor flow cytometry. Current Protocols in Immunology. 117, 1-38 (2017).
- Fan, Y., Cheng, J., Zeng, H., Shao, L. Senescent cell depletion through targeting BCL-family proteins and mitochondria. Frontiers in Physiology. 11, 593630 (2020).
- Kim, K. M., et al. Identification of senescent cell surface targetable protein DPP4. Genes and Development. 31 (15), 1529-1534 (2017).
- Flor, A. C., Kron, S. J. Lipid-derived reactive aldehydes link oxidative stress to cell senescence. Cell Death Discovery. 7 (9), 2366 (2016).
- Jochems, F., et al. The Cancer SENESCopedia: A delineation of cancer cell senescence. Cell reports. 36 (4), 109441 (2021).
- Fallah, M., et al. Doxorubicin and liposomal doxorubicin induce senescence by enhancing nuclear factor kappa B and mitochondrial membrane potential. Life Sciences. 232, 116677 (2019).
- Kasper, M., Barth, K. Bleomycin and its role in inducing apoptosis and senescence in lung cells – modulating effects of caveolin-1. Current Cancer Drug Targets. 9 (3), 341-353 (2009).
- Muthuramalingam, K., Cho, M., Kim, Y. Cellular senescence and EMT crosstalk in bleomycin-induced pathogenesis of pulmonary fibrosis-an in vitro analysis. Cell Biology International. 44 (2), 477-487 (2020).
- Flor, A. C., Wolfgeher, D., Wu, D., Kron, S. J. A signature of enhanced lipid metabolism, lipid peroxidation and aldehyde stress in therapy-induced senescence. Cell Death Discovery. 3, 17075 (2017).
- Burd, C. E., et al. Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model. Cell. 152 (1-2), 340-351 (2013).
- Liu, J. Y., et al. Cells exhibiting strong p16 (INK4a) promoter activation in vivo display features of senescence. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2603-2611 (2019).
- Wang, L., Lankhorst, L., Bernards, R. Exploiting senescence for the treatment of cancer. Nature Reviews Cancer. 22 (6), 340-355 (2022).
- Baek, K. -. H., Ryeom, S. Detection of oncogene-induced senescence in vivo. Methods in Molecular Biology. 1534, 185-198 (2017).
- González-Gualda, E., Baker, A. G., Fruk, L., Muñoz-Espín, D. A guide to assessing cellular senescence in vitro and in vivo. The FEBS Journal. 288 (1), 56-80 (2021).

