Sonda de β-Galactosidase Associada à Senescência Fluorescente Vermelha Distante para Identificação e Enriquecimento de Células Tumorais Senescentes por Citometria de Fluxo
Summary
Um protocolo para quantificação citométrica de fluxo fluorescente de células cancerígenas senescentes induzidas por drogas quimioterápicas em cultura de células ou em modelos de tumores murinos é apresentado. Os procedimentos opcionais incluem co-imunocoloração, fixação de amostras para facilitar a análise de grandes lotes ou pontos de tempo e o enriquecimento de células senescentes viáveis por classificação citométrica de fluxo.
Abstract
A senescência celular é um estado de parada proliferativa induzido por danos biológicos que normalmente se acumula ao longo de anos em células envelhecidas, mas também pode surgir rapidamente em células tumorais como resposta a danos induzidos por vários tratamentos contra o câncer. A senescência das células tumorais é geralmente considerada indesejável, pois as células senescentes tornam-se resistentes à morte e bloqueiam a remissão do tumor, exacerbando a malignidade do tumor e a resistência ao tratamento. Portanto, a identificação de células tumorais senescentes é de interesse contínuo para a comunidade de pesquisa do câncer. Existem vários ensaios de senescência, muitos baseados na atividade do conhecido marcador de senescência, a beta-galactosidase associada à senescência (SA-β-Gal).
Normalmente, o ensaio SA-β-Gal é realizado usando um substrato cromogênico (X-Gal) em células fixas, com a enumeração lenta e subjetiva de células senescentes “azuis” por microscopia de luz. Ensaios aprimorados usando substratos SA-β-Gal fluorescentes e permeantes a células, incluindo C12-FDG (verde) e DDAO-Galactoside (DDAOG; vermelho-distante), permitiram a análise de células vivas e permitiram o uso de plataformas de análise fluorescente de alto rendimento, incluindo citômetros de fluxo. C12-FDG é uma sonda bem documentada para SA-β-Gal, mas sua emissão fluorescente verde se sobrepõe à autofluorescência celular intrínseca (FA) que surge durante a senescência devido ao acúmulo de agregados de lipofuscina. Ao utilizar a sonda SA-β-Gal DDAOG de vermelho distante, a autofluorescência celular verde pode ser usada como um parâmetro secundário para confirmar a senescência, adicionando confiabilidade ao ensaio. Os canais de fluorescência restantes podem ser usados para coloração de viabilidade celular ou imunomarcação fluorescente opcional.
Usando citometria de fluxo, demonstramos o uso de DDAOG e autofluorescência de lipofuscina como um ensaio de duplo parâmetro para a identificação de células tumorais senescentes. A quantificação da porcentagem de células senescentes viáveis é realizada. Se desejado, uma etapa opcional de imunomarcação pode ser incluída para avaliar antígenos de superfície celular de interesse. As células senescentes identificadas também podem ser classificadas citometricamente e coletadas para análise a jusante. As células senescentes coletadas podem ser imediatamente lisadas (por exemplo, para imunoensaios ou análise ômica) ou cultivadas posteriormente.
Introduction
As células senescentes normalmente se acumulam em organismos ao longo de anos durante o envelhecimento biológico normal, mas também podem se desenvolver rapidamente em células tumorais como resposta a danos induzidos por vários tratamentos contra o câncer, incluindo radiação e quimioterapia. Embora não proliferem mais, as células tumorais senescentes induzidas pela terapia (TIS) podem contribuir para a resistência ao tratamento e impulsionar a recorrência 1,2,3. Fatores secretados pelas células TIS podem exacerbar a malignidade tumoral, promovendo evasão imune ou metástase 4,5. As células TIS desenvolvem fenótipos complexos e específicos do contexto, perfis metabólicos alterados e respostas imunes únicas 6,7,8. Portanto, a identificação e caracterização de células tumorais TIS induzidas por várias abordagens de tratamento do câncer é um tópico de interesse contínuo para a comunidade de pesquisa do câncer.
Para detectar células tumorais TIS, ensaios de senescência convencionais são amplamente utilizados, principalmente baseados na detecção de aumento da atividade da enzima marcadora de senescência, a beta-galactosidase lisossômica GLB19. A detecção em um pH lisossômico quase neutro (em vez de ácido) permite a detecção específica de beta-galactosidase associada à senescência (SA-β-Gal)10. Um ensaio padrão SA-β-Gal que tem sido usado por várias décadas usa X-Gal (5-bromo-4-cloro-3-indolyl-β-D-galactopyranoside), um substrato cromogênico azul beta-galactosidase, para detectar SA-β-Gal em células fixas por microscopia de luz11. O ensaio X-Gal permite a confirmação visual qualitativa do TIS utilizando reagentes comumente disponíveis e equipamentos de laboratório. Um microscópio básico de luz transmitida é a única instrumentação necessária para avaliar a presença do cromogênio azul. No entanto, o procedimento de coloração X-Gal pode não ter sensibilidade, às vezes exigindo mais de 24 horas para que a cor se desenvolva. A coloração é seguida por uma pontuação subjetiva de baixo rendimento de células senescentes individuais com base na contagem das células que exibem algum nível de intensidade do cromogênio azul sob um microscópio de luz. Como o X-Gal é impermeável a células, este ensaio requer células fixas com solvente, que não podem ser recuperadas para análise a jusante. Ao trabalhar com amostras limitadas de animais ou pacientes, isso pode ser uma grande desvantagem.
Ensaios melhorados de SA-β-Gal utilizando substratos enzimáticos fluorescentes e permeantes a células, incluindo C 12-FDG (5-dodecanoilaminofluoresceína Di-β-D-Galactopyranoside, verde) e DDAOG (9H-(1,3-dicloro-9,9-dimetilacridina-2-ona-7-il) β-D-Galactopyranoside, far-red) já apareceram na literatura12,13,14,15. A estrutura da sonda química e as características ópticas do DDAOG são mostradas na Figura Suplementar S1. Essas sondas perfeitas por células permitem a análise de células vivas (em vez de fixas), e as sondas fluorescentes, em vez de cromogênicas, facilitam o uso de plataformas de análise fluorescente rápidas de alto rendimento, incluindo instrumentos de triagem de alto conteúdo e citômetros de fluxo. Os citômetros de fluxo de triagem permitem a recuperação de populações enriquecidas de células senescentes vivas de culturas celulares ou tumores para análise a jusante (por exemplo, western blotting, ELISA ou ‘omics’). A análise de fluorescência também fornece um sinal quantitativo, permitindo uma determinação mais precisa da porcentagem de células senescentes dentro de uma determinada amostra. Sondas fluorescentes adicionais, incluindo sondas de viabilidade e anticorpos marcados com fluoróforos, podem ser prontamente adicionadas para análise multiplexada de alvos além de SA-β-Gal.
Semelhante ao DDAOG, o C12-FDG é uma sonda fluorescente para SA-β-Gal, mas sua emissão fluorescente verde se sobrepõe à FA celular intrínseca, que surge durante a senescência devido ao acúmulo de agregados de lipofuscina nas células16. Utilizando a sonda DDAOG vermelho-distante, a FA celular verde pode ser utilizada como parâmetro secundário para confirmar a senescência17. Isso melhora a confiabilidade do ensaio com o uso de um segundo marcador, além do SA-β-Gal, que muitas vezes pode não ser confiável como um único marcador de senescência18. Como a detecção de FA endógena em células senescentes é uma abordagem livre de rótulos, é uma maneira rápida e simples de expandir a especificidade do nosso ensaio baseado em DDAOG.
Neste protocolo, demonstramos o uso de DDAOG e FA como um ensaio rápido de citometria de fluxo de dois parâmetros para a identificação de células tumorais TIS viáveis de culturas in vitro ou isoladas de tumores tratados com drogas estabelecidos em camundongos (Figura 1). O protocolo utiliza fluoróforos compatíveis com uma ampla gama de analisadores e classificadores de citometria de fluxo comercial padrão (Tabela 1). A quantificação da porcentagem de células senescentes viáveis usando a análise de citometria de fluxo padrão é habilitada. Se desejado, uma etapa opcional de imunomarcação pode ser realizada para avaliar antígenos de superfície celular de interesse concomitantemente com a senescência. As células senescentes identificadas também podem ser enriquecidas usando a metodologia padrão de classificação celular ativada por fluorescência (FACS).
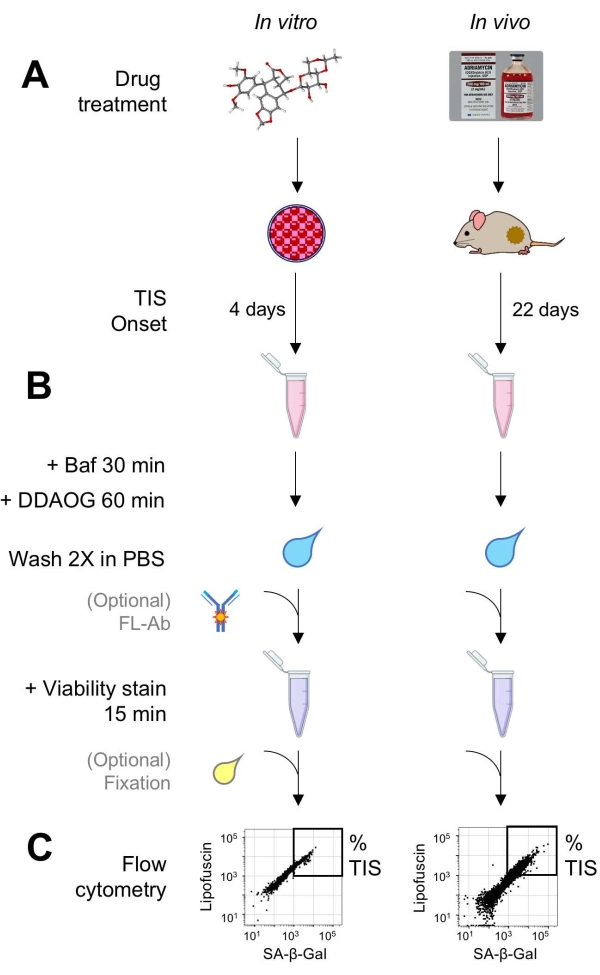
Figura 1: Fluxo de trabalho experimental. Um esquema que resume os pontos-chave do ensaio DDAOG. (A) Uma droga indutora de TIS é adicionada a células cultivadas de mamíferos ou administrada a camundongos portadores de tumores. O tempo é então permitido para o início do TIS: para as células, 4 dias após o tratamento; para camundongos, 22 dias no total, com três tratamentos a cada 5 dias mais 7 dias de recuperação. As células são colhidas ou os tumores são dissociados em suspensão. (B) As amostras são tratadas com Baf para ajustar o pH lisossômico para detecção de SA-β-Gal por 30 min; em seguida, a sonda DDAOG é adicionada por 60 min para detectar SA-β-Gal. As amostras são lavadas 2x em PBS, e uma mancha de viabilidade é brevemente adicionada (15 min). Opcionalmente, as amostras podem ser coradas com anticorpos fluorescentes em canais de fluorescência abertos e/ou fixadas para análise posterior. (C) As amostras são analisadas usando um citômetro de fluxo padrão. Células viáveis são visualizadas em gráficos de pontos mostrando DDAOG vermelho (indicando SA-β-Gal) versus autofluorescência verde (lipofuscina). Uma porta para determinar a porcentagem de células TIS é estabelecida com base em amostras de controle não tratadas (não mostradas). Se um citômetro de classificação (FACS) for usado, as células TIS podem ser coletadas e colocadas de volta em cultura para ensaios in vitro adicionais ou lisadas e processadas para ensaios de biologia molecular. Abreviaturas: DDAO = 9H-(1,3-dicloro-9,9-dimetilacridina-2-ona); DDAOG = DDAO-Galactoside; TIS = senescência induzida pela terapia; FL-Ab = anticorpo conjugado com fluoróforo; Baf = Bafilomicina A1; SA-β-Gal = beta-galactosidase associada à senescência; PBS = solução salina tamponada com fosfato; FACS = classificação celular ativada por fluorescência. Por favor, clique aqui para ver uma versão maior desta figura.
| Fluoróforo | Detecta | Ex/Em (nm) | Citômetro a laser (nm) | Detector de citômetro / filtro passa-banda (nm) |
| DDAOG | SA-β-Gal | 645/6601 | 640 | 670 / 30 |
| AF | Lipofuscina | < 600 | 488 | 525 / 50 |
| CV450 | Viabilidade | 408/450 | 405 | 450 / 50 |
| PE | Anticorpo/marcador de superfície | 565/578 | 561 | 582 / 15 |
Tabela 1: Fluoróforos e especificações ópticas do citômetro. As especificações do citômetro utilizadas neste protocolo são listadas para um instrumento com um total de 4 lasers e 15 detectores de emissão. DDAOG detectado a 645/660 nm é a forma da sonda clivada por SA-β-Gal1. O Uncleaved DDAOG pode apresentar fluorescência de baixo nível a 460/610 nm, mas é removido por etapas de lavagem no protocolo. Abreviaturas: DDAO = 9H-(1,3-dicloro-9,9-dimetilacridina-2-ona); DDAOG = DDAO-Galactoside; FA = autofluorescência; EP = ficoeritrina; SA-β-Gal = beta-galactosidase associada à senescência.
Protocol
Representative Results
Discussion
Na última década, a citometria de fluxo tornou-se uma plataforma de ensaio mais comum na pesquisa do câncer devido à popularidade emergente da imunologia tumoral, ao desenvolvimento de citômetros de fluxo de baixo custo e à melhoria das instalações de instrumentação compartilhadas em instituições acadêmicas. Ensaios multicoloridos são agora padrão, já que a maioria dos instrumentos mais recentes são equipados com matrizes ópticas violeta, azul-verde e vermelho a vermelho-distante. Assim, é provável qu…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos ao Cytometry and Antibody Core Facility da Universidade de Chicago pelo apoio na instrumentação da citometria de fluxo. O Centro de Pesquisa Animal da Universidade de Chicago forneceu alojamento para animais.
Materials
| Bafilomycin A1 | Research Products International | B40500 | |
| Bleomycin sulfate | Cayman | 13877 | |
| Bovine serum albumin (BSA) | US Biological | A1380 | |
| Calcein Violet 450 AM viability dye | ThermoFisher Scientific | 65-0854-39 | eBioscience |
| DPP4 antibody, PE conjugate | Biolegend | 137803 | Clone H194-112 |
| Cell line: A549 human lung adenocarcinoma | American Type Culture Collection | CCL-185 | |
| Cell line: B16-F10 mouse melanoma | American Type Culture Collection | CRL-6475 | |
| Cell scraper | Corning | 3008 | |
| Cell strainers, 100 µm | Falcon | 352360 | |
| DDAO-Galactoside | Life Technologies | D6488 | |
| DMEM medium 1x | Life Technologies | 11960-069 | |
| DMSO | Sigma | D2438 | |
| DNAse I | Sigma | DN25 | |
| Doxorubicin, hydrochloride injection (USP) | Pfizer | NDC 0069-3032-20 | |
| Doxorubicin, PEGylated liposomal (USP) | Sun Pharmaceutical | NDC 47335-049-40 | |
| EDTA 0.5 M | Life Technologies | 15575-038 | |
| Etoposide | Cayman | 12092 | |
| FBS | Omega | FB-11 | |
| Fc receptor blocking reagent | Biolegend | 101320 | Anti-mouse CD16/32 |
| Flow cytometer (cell analyzer) | Becton Dickinson (BD) | Various | LSRFortessa |
| Flow cytometer (cell sorter) | Becton Dickinson (BD) | Various | FACSAria |
| GlutaMax 100x | Life Technologies | 35050061 | |
| HEPES 1 M | Lonza | BW17737 | |
| Liberase TL | Sigma | 5401020001 | Roche |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Penicillin/Streptomycin 100x | Life Technologies | 15140122 | |
| Phosphate buffered saline (PBS) 1x | Corning | MT21031CV | Dulbecco's PBS (without calcium and magnesium) |
| Rainbow calibration particles, ultra kit | SpheroTech | UCRP-38-2K | 3.5-3.9 µm, 2E6/mL |
| RPMI-1640 medium 1x | Life Technologies | 11875-119 | |
| Sodium chloride 0.9% (USP) | Baxter Healthcare Corporation | 2B1324 | |
| Software for cytometer data acquisition, "FACSDiva" | Becton Dickinson (BD) | n/a | Contact BD for license |
| Software for cytometer data analysis, "FlowJo" | TreeStar | n/a | Contact TreeStar for license |
| Trypsin-EDTA 0.25% | Life Technologies | 25200-114 |
References
- Saleh, T., Tyutyunyk-Massey, L., Gewirtz, D. A. Tumor cell escape from therapy-induced senescence as a model of disease recurrence after dormancy. 암 연구학. 79 (6), 1044-1046 (2019).
- Wang, B., Kohli, J., Demaria, M. Senescent cells in cancer therapy: friends or foes. Trends in Cancer. 6 (10), 838-857 (2020).
- Prasanna, P. G., et al. Therapy-induced senescence: Opportunities to improve anticancer therapy. Journal of the National Cancer Institute. 113 (10), 1285-1298 (2021).
- Velarde, M. C., Demaria, M., Campisi, J. Senescent cells and their secretory phenotype as targets for cancer therapy. Interdisciplinary Topics in Gerontology and Geriatrics. 38, 17-27 (2013).
- Ou, H. L., et al. Cellular senescence in cancer: from mechanisms to detection. Molecular Oncology. 15 (10), 2634-2671 (2021).
- Hernandez-Segura, A., Nehme, J., Demaria, M. Hallmarks of cellular senescence. Trends in Cell Biology. 28 (6), 436-453 (2018).
- Bojko, A., Czarnecka-Herok, J., Charzynska, A., Dabrowski, M., Sikora, E. Diversity of the senescence phenotype of cancer cells treated with chemotherapeutic agents. Cells. 8 (12), 1501 (2019).
- Mikuła-Pietrasik, J., Niklas, A., Uruski, P., Tykarski, A., Książek, K. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cellular and Molecular Life Sciences. 77 (2), 213-229 (2020).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging cell. 5 (2), 187-195 (2006).
- Itahana, K., Itahana, Y., Dimri, G. P. Colorimetric detection of senescence-associated β galactosidase. Methods in Molecular Biology. 965, 143-156 (2013).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences of the United States of America. 92 (20), 9363-9367 (1995).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Noppe, G., et al. Rapid flow cytometric method for measuring senescence associated beta-galactosidase activity in human fibroblasts. Cytometry A. 75 (11), 910-916 (2009).
- Tung, C. -. H., et al. In vivo imaging of β-galactosidase activity using far red fluorescent switch. 암 연구학. 64 (5), 1579-1583 (2004).
- Gong, H., et al. beta-Galactosidase activity assay using far-red-shifted fluorescent substrate DDAOG. Analytical Biochemistry. 386 (1), 59-64 (2009).
- Terman, A., Brunk, U. T. Lipofuscin: Mechanisms of formation and increase with age. APMIS. 106 (2), 265-276 (1998).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging. 5 (1), 37-50 (2013).
- Wang, B., Demaria, M. The quest to define and target cellular senescence in cancer. 암 연구학. 81 (24), 6087-6089 (2021).
- Appelbe, O. K., Zhang, Q., Pelizzari, C. A., Weichselbaum, R. R., Kron, S. J. Image-guided radiotherapy targets macromolecules through altering the tumor microenvironment. Molecular Pharmaceutics. 13 (10), 3457-3467 (2016).
- Maciorowski, Z., Chattopadhyay, P. K., Jain, P. Basic multicolor flow cytometry. Current Protocols in Immunology. 117, 1-38 (2017).
- Fan, Y., Cheng, J., Zeng, H., Shao, L. Senescent cell depletion through targeting BCL-family proteins and mitochondria. Frontiers in Physiology. 11, 593630 (2020).
- Kim, K. M., et al. Identification of senescent cell surface targetable protein DPP4. Genes and Development. 31 (15), 1529-1534 (2017).
- Flor, A. C., Kron, S. J. Lipid-derived reactive aldehydes link oxidative stress to cell senescence. Cell Death Discovery. 7 (9), 2366 (2016).
- Jochems, F., et al. The Cancer SENESCopedia: A delineation of cancer cell senescence. Cell reports. 36 (4), 109441 (2021).
- Fallah, M., et al. Doxorubicin and liposomal doxorubicin induce senescence by enhancing nuclear factor kappa B and mitochondrial membrane potential. Life Sciences. 232, 116677 (2019).
- Kasper, M., Barth, K. Bleomycin and its role in inducing apoptosis and senescence in lung cells – modulating effects of caveolin-1. Current Cancer Drug Targets. 9 (3), 341-353 (2009).
- Muthuramalingam, K., Cho, M., Kim, Y. Cellular senescence and EMT crosstalk in bleomycin-induced pathogenesis of pulmonary fibrosis-an in vitro analysis. Cell Biology International. 44 (2), 477-487 (2020).
- Flor, A. C., Wolfgeher, D., Wu, D., Kron, S. J. A signature of enhanced lipid metabolism, lipid peroxidation and aldehyde stress in therapy-induced senescence. Cell Death Discovery. 3, 17075 (2017).
- Burd, C. E., et al. Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model. Cell. 152 (1-2), 340-351 (2013).
- Liu, J. Y., et al. Cells exhibiting strong p16 (INK4a) promoter activation in vivo display features of senescence. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2603-2611 (2019).
- Wang, L., Lankhorst, L., Bernards, R. Exploiting senescence for the treatment of cancer. Nature Reviews Cancer. 22 (6), 340-355 (2022).
- Baek, K. -. H., Ryeom, S. Detection of oncogene-induced senescence in vivo. Methods in Molecular Biology. 1534, 185-198 (2017).
- González-Gualda, E., Baker, A. G., Fruk, L., Muñoz-Espín, D. A guide to assessing cellular senescence in vitro and in vivo. The FEBS Journal. 288 (1), 56-80 (2021).

