Verrode fluorescentie-geassocieerde β-galactosidase-sonde voor identificatie en verrijking van senescente tumorcellen door flowcytometrie
Summary
Een protocol voor fluorescerende, flowcytometrische kwantificering van senescente kankercellen geïnduceerd door chemotherapiegeneesmiddelen in celkweek of in muizentumormodellen wordt gepresenteerd. Optionele procedures omvatten co-immunostaining, monsterfixatie om grote batch- of tijdpuntanalyse te vergemakkelijken en de verrijking van levensvatbare senescente cellen door flowcytometrische sortering.
Abstract
Cellulaire senescentie is een toestand van proliferatieve arrestatie veroorzaakt door biologische schade die normaal gesproken in de loop van de jaren oploopt in ouder wordende cellen, maar ook snel kan ontstaan in tumorcellen als reactie op schade veroorzaakt door verschillende kankerbehandelingen. Tumorcelsenescentie wordt over het algemeen als ongewenst beschouwd, omdat senescente cellen resistent worden tegen de dood en tumorremissie blokkeren terwijl tumormaligniteit en behandelingsresistentie worden verergerd. Daarom is de identificatie van senescente tumorcellen van voortdurend belang voor de kankeronderzoeksgemeenschap. Er bestaan verschillende senescentietests, waarvan vele gebaseerd zijn op de activiteit van de bekende senescentiemarker, senescentie-geassocieerde bèta-galactosidase (SA-β-Gal).
Typisch wordt de SA-β-Gal-test uitgevoerd met behulp van een chromogeen substraat (X-Gal) op vaste cellen, met de langzame en subjectieve opsomming van “blauwe” senescente cellen door lichtmicroscopie. Verbeterde testen met behulp van celpermeant, fluorescerende SA-β-Gal substraten, waaronder C12-FDG (groen) en DDAO-Galactoside (DDAOG; verrood), hebben de analyse van levende cellen mogelijk gemaakt en het gebruik van high-throughput fluorescerende analyseplatforms mogelijk gemaakt, inclusief flowcytometers. C12-FDG is een goed gedocumenteerde sonde voor SA-β-Gal, maar de groene fluorescerende emissie overlapt met intrinsieke cellulaire autofluorescentie (AF) die ontstaat tijdens senescentie als gevolg van de accumulatie van lipofuscineaggregaten. Door gebruik te maken van de verrode SA-β-Gal probe DDAOG, kan groene cellulaire autofluorescentie worden gebruikt als een secundaire parameter om senescentie te bevestigen, waardoor betrouwbaarheid aan de test wordt toegevoegd. De resterende fluorescentiekanalen kunnen worden gebruikt voor kleuring van de levensvatbaarheid van cellen of optionele fluorescerende immunolabeling.
Met behulp van flowcytometrie demonstreren we het gebruik van DDAOG en lipofuscine autofluorescentie als een dual-parameter assay voor de identificatie van senescente tumorcellen. Kwantificering van het percentage levensvatbare senescente cellen wordt uitgevoerd. Indien gewenst kan een optionele immunolabelingstap worden opgenomen om antigenen van het celoppervlak van belang te evalueren. Geïdentificeerde senescente cellen kunnen ook flowcytometrisch worden gesorteerd en verzameld voor downstream-analyse. Verzamelde senescente cellen kunnen onmiddellijk worden gelyseerd (bijvoorbeeld voor immunoassays of ‘omics-analyse’ ) of verder worden gekweekt.
Introduction
Senescente cellen hopen zich normaal gesproken op in organismen gedurende de jaren tijdens normale biologische veroudering, maar kunnen zich ook snel ontwikkelen in tumorcellen als reactie op schade veroorzaakt door verschillende kankerbehandelingen, waaronder bestraling en chemotherapie. Hoewel ze niet langer prolifereren, kunnen door therapie geïnduceerde senescente (TIS) tumorcellen bijdragen aan de behandelingsresistentie en recidief veroorzaken 1,2,3. Factoren die door TIS-cellen worden uitgescheiden, kunnen de tumormaligniteit verergeren door immuunontwijking of metastasete bevorderen 4,5. TIS-cellen ontwikkelen complexe, contextspecifieke fenotypen, veranderde metabole profielen en unieke immuunresponsen 6,7,8. Daarom is de identificatie en karakterisering van TIS-tumorcellen geïnduceerd door verschillende kankerbehandelingsbenaderingen een onderwerp van voortdurende interesse voor de kankeronderzoeksgemeenschap.
Om TIS-tumorcellen te detecteren, worden conventionele senescentietests op grote schaal gebruikt, voornamelijk gebaseerd op het detecteren van verhoogde activiteit van het senescentiemarkerenzym, het lysosomale bèta-galactosidase GLB19. Detectie bij een bijna neutrale (in plaats van zure) lysosomale pH maakt specifieke detectie van senescentie-geassocieerde bèta-galactosidase (SA-β-Gal)10 mogelijk. Een standaard SA-β-Gal-test die al tientallen jaren wordt gebruikt, gebruikt X-Gal (5-broom-4-chloor-3-indolyl-β-D-galactopyranoside), een blauw chromogeen bèta-galactosidase-substraat, om SA-β-Gal in vaste cellen te detecteren door lichtmicroscopie11. De X-Gal-test maakt de kwalitatieve visuele bevestiging van TIS mogelijk met behulp van algemeen beschikbare reagentia en laboratoriumapparatuur. Een basistransmissielichtmicroscoop is de enige instrumentatie die nodig is om de aanwezigheid van het blauwe chromogeen te evalueren. De X-Gal-kleuringsprocedure kan echter niet gevoelig zijn en soms meer dan 24 uur nodig hebben om de kleur te ontwikkelen. Kleuring wordt gevolgd door een subjectieve score met lage doorvoer van individuele senescente cellen op basis van het tellen van de cellen die een bepaald intensiteitsniveau van het blauwe chromogeen vertonen onder een lichtmicroscoop. Omdat X-Gal celdoordringbaar is, vereist deze test oplosmiddelvaste cellen, die niet kunnen worden teruggewonnen voor downstream-analyse. Bij het werken met beperkte monsters van dieren of patiënten kan dit een groot nadeel zijn.
Verbeterde SA-β-Gal-assays met behulp van celpermeant, fluorescerend enzymsubstraten, waaronder C12-FDG (5-dodecanoylaminofluoresceïne Di-β-D-Galactopyranoside, groen) en DDAOG (9H-(1,3-dichloor-9,9-dimethylacridin-2-one-7-yl) β-D-Galactopyranoside, verrood) zijn eerder in de literatuur verschenen 12,13,14,15. De chemische sondestructuur en optische eigenschappen van DDAOG zijn weergegeven in aanvullende figuur S1. Deze celpermeant sondes maken de analyse van levende (in plaats van vaste) cellen mogelijk, en fluorescerende in plaats van chromogene sondes vergemakkelijken het gebruik van snelle fluorescentieanalyseplatforms met hoge doorvoer, waaronder screeningsinstrumenten met hoge inhoud en flowcytometers. Sorteerstroomcytometers maken het herstel mogelijk van verrijkte populaties van levende senescente cellen uit celculturen of tumoren voor downstream-analyse (bijv. Western blotting, ELISA of ‘omics’). Fluorescentieanalyse biedt ook een kwantitatief signaal, waardoor het percentage senescente cellen in een bepaald monster nauwkeuriger kan worden bepaald. Extra fluorescerende sondes, waaronder levensvatbaarheidsondes en fluorofoor-gelabelde antilichamen, kunnen gemakkelijk worden toegevoegd voor multiplexanalyse van doelen buiten SA-β-Gal.
Net als DDAOG is C12-FDG een fluorescerende sonde voor SA-β-Gal, maar de groene fluorescerende emissie overlapt met intrinsieke cellulaire AF, die ontstaat tijdens senescentie als gevolg van de accumulatie van lipofuscine-aggregaten in cellen16. Door gebruik te maken van de verrode DDAOG-sonde kan groene cellulaire AF worden gebruikt als secundaire parameter om senescentie te bevestigen17. Dit verbetert de betrouwbaarheid van de test door een tweede marker te gebruiken naast SA-β-Gal, die vaak onbetrouwbaar kan zijn als een enkele marker voor senescentie18. Omdat de detectie van endogene AF in senescente cellen een labelvrije benadering is, is het een snelle en eenvoudige manier om de specificiteit van onze op DDAOG gebaseerde test uit te breiden.
In dit protocol demonstreren we het gebruik van DDAOG en AF als een snelle, dual-parameter flowcytometrietest voor de identificatie van levensvatbare TIS-tumorcellen uit in vitro culturen of geïsoleerd uit met geneesmiddelen behandelde tumoren die bij muizen zijn vastgesteld (figuur 1). Het protocol maakt gebruik van fluoroforen die compatibel zijn met een breed scala aan standaard commerciële flowcytometrie-analysers en sorteerders (tabel 1). Kwantificering van het percentage levensvatbare senescente cellen met behulp van standaard flowcytometrieanalyse is mogelijk. Indien gewenst kan een optionele immunolabelingstap worden uitgevoerd om antigenen van het celoppervlak gelijktijdig met senescentie te evalueren. Geïdentificeerde senescente cellen kunnen ook worden verrijkt met behulp van de standaard fluorescentie-geactiveerde celsortering (FACS) methodologie.
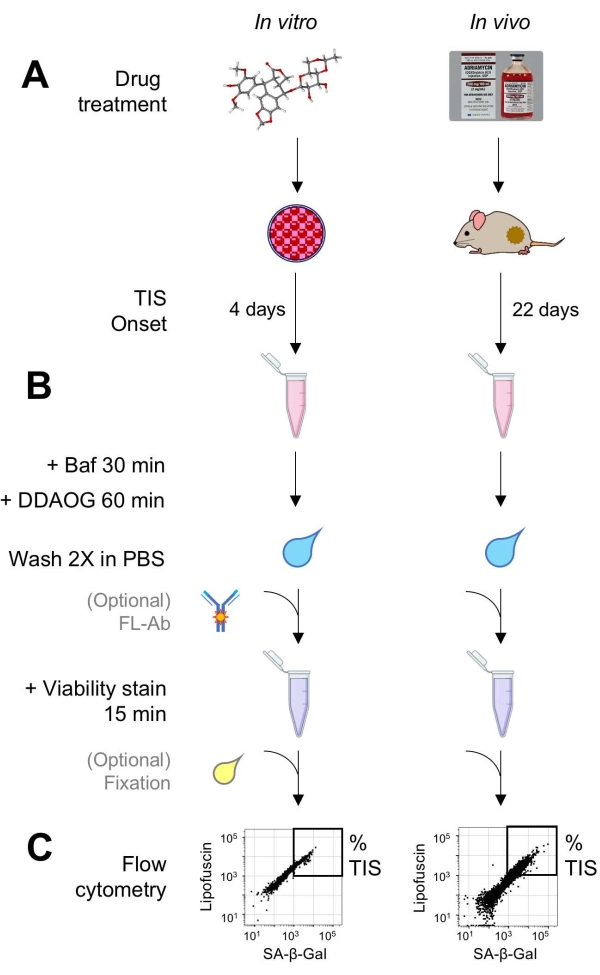
Figuur 1: Experimentele workflow. Een schematische samenvatting van de belangrijkste punten van de DDAOG-test. (A) Een TIS-inducerend geneesmiddel wordt toegevoegd aan gekweekte cellen van zoogdieren of toegediend aan tumordragende muizen. Er wordt dan tijd toegestaan voor het begin van TIS: voor cellen, 4 dagen na de behandeling; voor muizen, 22 dagen in totaal, met drie behandelingen om de 5 dagen plus 7 dagen herstel. Cellen worden geoogst of tumoren worden gedissocieerd in suspensie. (B) Monsters worden behandeld met Baf om de lysosomale pH aan te passen voor detectie van SA-β-Gal gedurende 30 minuten; vervolgens wordt de DDAOG-sonde gedurende 60 minuten toegevoegd om SA-β-Gal te detecteren. Monsters worden 2x gewassen in PBS en een levensvatbaarheidsvlek wordt kort toegevoegd (15 min). Optioneel kunnen monsters worden gekleurd met fluorescerende antilichamen in open fluorescentiekanalen en / of worden gefixeerd voor latere analyse. (C) Monsters worden geanalyseerd met behulp van een standaard flowcytometer. Levensvatbare cellen worden gevisualiseerd in dot plots met rode DDAOG (wat wijst op SA-β-Gal) versus groene autofluorescentie (lipofuscine). Een poort om het percentage TIS-cellen te bepalen wordt vastgesteld op basis van onbehandelde controlemonsters (niet weergegeven). Als een sorteercytometer (FACS) wordt gebruikt, kunnen TIS-cellen worden verzameld en teruggeplaatst in cultuur voor verdere in vitro assays of worden gelyseerd en verwerkt voor moleculaire biologie-assays. Afkortingen: DDAO = 9H-(1,3-dichloro-9,9-dimethylacridin-2-one); DDAOG = DDAO-Galactoside; TIS = therapie-geïnduceerde senescentie; FL-Ab = fluorofoor-geconjugeerd antilichaam; Baf = Bafilomycine A1; SA-β-Gal = senescentie-geassocieerde bèta-galactosidase; PBS = fosfaatgebufferde zoutoplossing; FACS = fluorescentie-geactiveerde celsortering. Klik hier om een grotere versie van deze figuur te bekijken.
| Fluorofoor | Detecteert | Ex /Em (nm) | Cytometerlaser (nm) | Cytometer detector / bandpass filter (nm) |
| DDAOG | SA-β-Gal | 645/6601 | 640 | 670 / 30 |
| Af | Lipofuscine | < 600 | 488 | 525 / 50 |
| Cv450 | Levensvatbaarheid | 408/450 | 405 | 450 / 50 |
| PE | Antilichaam/oppervlaktemarker | 565/578 | 561 | 582 / 15 |
Tabel 1: Fluoroforen en cytometer optische specificaties. Cytometerspecificaties die in dit protocol worden gebruikt, worden vermeld voor een instrument met in totaal 4 lasers en 15 emissiedetectoren. DDAOG gedetecteerd bij 645/660 nm is de vorm van de sonde gesplitst door SA-β-Gal1. Uncleaved DDAOG kan een lage fluorescentie vertonen bij 460/610 nm, maar wordt verwijderd door wasstappen in het protocol. Afkortingen: DDAO = 9H-(1,3-dichloro-9,9-dimethylacridin-2-one); DDAOG = DDAO-Galactoside; AF = autofluorescentie; PE = phycoerythrin; SA-β-Gal = senescentie-geassocieerde bèta-galactosidase.
Protocol
Representative Results
Discussion
In de afgelopen tien jaar is flowcytometrie een gebruikelijker testplatform geworden in kankeronderzoek vanwege de opkomende populariteit van tumorimmunologie, de ontwikkeling van goedkopere flowcytometers en de verbetering van gedeelde instrumentatiefaciliteiten bij academische instellingen. Multicolor assays zijn nu standaard, omdat de meeste nieuwere instrumenten zijn uitgerust met violette, blauwgroene en rode tot verrode optische arrays. Dit DDAOG-protocol is dus waarschijnlijk compatibel met een breed scala aan flo…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We bedanken de Cytometry and Antibody Core Facility van de Universiteit van Chicago voor de ondersteuning bij flowcytometrie-instrumentatie. Het Animal Research Center van de Universiteit van Chicago zorgde voor dierenhuisvesting.
Materials
| Bafilomycin A1 | Research Products International | B40500 | |
| Bleomycin sulfate | Cayman | 13877 | |
| Bovine serum albumin (BSA) | US Biological | A1380 | |
| Calcein Violet 450 AM viability dye | ThermoFisher Scientific | 65-0854-39 | eBioscience |
| DPP4 antibody, PE conjugate | Biolegend | 137803 | Clone H194-112 |
| Cell line: A549 human lung adenocarcinoma | American Type Culture Collection | CCL-185 | |
| Cell line: B16-F10 mouse melanoma | American Type Culture Collection | CRL-6475 | |
| Cell scraper | Corning | 3008 | |
| Cell strainers, 100 µm | Falcon | 352360 | |
| DDAO-Galactoside | Life Technologies | D6488 | |
| DMEM medium 1x | Life Technologies | 11960-069 | |
| DMSO | Sigma | D2438 | |
| DNAse I | Sigma | DN25 | |
| Doxorubicin, hydrochloride injection (USP) | Pfizer | NDC 0069-3032-20 | |
| Doxorubicin, PEGylated liposomal (USP) | Sun Pharmaceutical | NDC 47335-049-40 | |
| EDTA 0.5 M | Life Technologies | 15575-038 | |
| Etoposide | Cayman | 12092 | |
| FBS | Omega | FB-11 | |
| Fc receptor blocking reagent | Biolegend | 101320 | Anti-mouse CD16/32 |
| Flow cytometer (cell analyzer) | Becton Dickinson (BD) | Various | LSRFortessa |
| Flow cytometer (cell sorter) | Becton Dickinson (BD) | Various | FACSAria |
| GlutaMax 100x | Life Technologies | 35050061 | |
| HEPES 1 M | Lonza | BW17737 | |
| Liberase TL | Sigma | 5401020001 | Roche |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Penicillin/Streptomycin 100x | Life Technologies | 15140122 | |
| Phosphate buffered saline (PBS) 1x | Corning | MT21031CV | Dulbecco's PBS (without calcium and magnesium) |
| Rainbow calibration particles, ultra kit | SpheroTech | UCRP-38-2K | 3.5-3.9 µm, 2E6/mL |
| RPMI-1640 medium 1x | Life Technologies | 11875-119 | |
| Sodium chloride 0.9% (USP) | Baxter Healthcare Corporation | 2B1324 | |
| Software for cytometer data acquisition, "FACSDiva" | Becton Dickinson (BD) | n/a | Contact BD for license |
| Software for cytometer data analysis, "FlowJo" | TreeStar | n/a | Contact TreeStar for license |
| Trypsin-EDTA 0.25% | Life Technologies | 25200-114 |
References
- Saleh, T., Tyutyunyk-Massey, L., Gewirtz, D. A. Tumor cell escape from therapy-induced senescence as a model of disease recurrence after dormancy. 암 연구학. 79 (6), 1044-1046 (2019).
- Wang, B., Kohli, J., Demaria, M. Senescent cells in cancer therapy: friends or foes. Trends in Cancer. 6 (10), 838-857 (2020).
- Prasanna, P. G., et al. Therapy-induced senescence: Opportunities to improve anticancer therapy. Journal of the National Cancer Institute. 113 (10), 1285-1298 (2021).
- Velarde, M. C., Demaria, M., Campisi, J. Senescent cells and their secretory phenotype as targets for cancer therapy. Interdisciplinary Topics in Gerontology and Geriatrics. 38, 17-27 (2013).
- Ou, H. L., et al. Cellular senescence in cancer: from mechanisms to detection. Molecular Oncology. 15 (10), 2634-2671 (2021).
- Hernandez-Segura, A., Nehme, J., Demaria, M. Hallmarks of cellular senescence. Trends in Cell Biology. 28 (6), 436-453 (2018).
- Bojko, A., Czarnecka-Herok, J., Charzynska, A., Dabrowski, M., Sikora, E. Diversity of the senescence phenotype of cancer cells treated with chemotherapeutic agents. Cells. 8 (12), 1501 (2019).
- Mikuła-Pietrasik, J., Niklas, A., Uruski, P., Tykarski, A., Książek, K. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cellular and Molecular Life Sciences. 77 (2), 213-229 (2020).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging cell. 5 (2), 187-195 (2006).
- Itahana, K., Itahana, Y., Dimri, G. P. Colorimetric detection of senescence-associated β galactosidase. Methods in Molecular Biology. 965, 143-156 (2013).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences of the United States of America. 92 (20), 9363-9367 (1995).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Noppe, G., et al. Rapid flow cytometric method for measuring senescence associated beta-galactosidase activity in human fibroblasts. Cytometry A. 75 (11), 910-916 (2009).
- Tung, C. -. H., et al. In vivo imaging of β-galactosidase activity using far red fluorescent switch. 암 연구학. 64 (5), 1579-1583 (2004).
- Gong, H., et al. beta-Galactosidase activity assay using far-red-shifted fluorescent substrate DDAOG. Analytical Biochemistry. 386 (1), 59-64 (2009).
- Terman, A., Brunk, U. T. Lipofuscin: Mechanisms of formation and increase with age. APMIS. 106 (2), 265-276 (1998).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging. 5 (1), 37-50 (2013).
- Wang, B., Demaria, M. The quest to define and target cellular senescence in cancer. 암 연구학. 81 (24), 6087-6089 (2021).
- Appelbe, O. K., Zhang, Q., Pelizzari, C. A., Weichselbaum, R. R., Kron, S. J. Image-guided radiotherapy targets macromolecules through altering the tumor microenvironment. Molecular Pharmaceutics. 13 (10), 3457-3467 (2016).
- Maciorowski, Z., Chattopadhyay, P. K., Jain, P. Basic multicolor flow cytometry. Current Protocols in Immunology. 117, 1-38 (2017).
- Fan, Y., Cheng, J., Zeng, H., Shao, L. Senescent cell depletion through targeting BCL-family proteins and mitochondria. Frontiers in Physiology. 11, 593630 (2020).
- Kim, K. M., et al. Identification of senescent cell surface targetable protein DPP4. Genes and Development. 31 (15), 1529-1534 (2017).
- Flor, A. C., Kron, S. J. Lipid-derived reactive aldehydes link oxidative stress to cell senescence. Cell Death Discovery. 7 (9), 2366 (2016).
- Jochems, F., et al. The Cancer SENESCopedia: A delineation of cancer cell senescence. Cell reports. 36 (4), 109441 (2021).
- Fallah, M., et al. Doxorubicin and liposomal doxorubicin induce senescence by enhancing nuclear factor kappa B and mitochondrial membrane potential. Life Sciences. 232, 116677 (2019).
- Kasper, M., Barth, K. Bleomycin and its role in inducing apoptosis and senescence in lung cells – modulating effects of caveolin-1. Current Cancer Drug Targets. 9 (3), 341-353 (2009).
- Muthuramalingam, K., Cho, M., Kim, Y. Cellular senescence and EMT crosstalk in bleomycin-induced pathogenesis of pulmonary fibrosis-an in vitro analysis. Cell Biology International. 44 (2), 477-487 (2020).
- Flor, A. C., Wolfgeher, D., Wu, D., Kron, S. J. A signature of enhanced lipid metabolism, lipid peroxidation and aldehyde stress in therapy-induced senescence. Cell Death Discovery. 3, 17075 (2017).
- Burd, C. E., et al. Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model. Cell. 152 (1-2), 340-351 (2013).
- Liu, J. Y., et al. Cells exhibiting strong p16 (INK4a) promoter activation in vivo display features of senescence. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2603-2611 (2019).
- Wang, L., Lankhorst, L., Bernards, R. Exploiting senescence for the treatment of cancer. Nature Reviews Cancer. 22 (6), 340-355 (2022).
- Baek, K. -. H., Ryeom, S. Detection of oncogene-induced senescence in vivo. Methods in Molecular Biology. 1534, 185-198 (2017).
- González-Gualda, E., Baker, A. G., Fruk, L., Muñoz-Espín, D. A guide to assessing cellular senescence in vitro and in vivo. The FEBS Journal. 288 (1), 56-80 (2021).

