संयुक्त रोगों और परीक्षण दवाओं के मॉडलिंग के लिए घुटने के जोड़-ऑन-ए-चिप का निर्माण
Summary
हम मानव मेसेनकाइमल स्टेम कोशिकाओं से चार प्रकार के ऊतकों को उत्पन्न करने के लिए विस्तृत तरीके प्रदान करते हैं, जिनका उपयोग मानव घुटने के जोड़ में उपास्थि, हड्डी, वसा पैड और सिनोवियम को पुन: उत्पन्न करने के लिए किया जाता है। इन चार ऊतकों को एक अनुकूलित बायोरिएक्टर में एकीकृत किया जाता है और माइक्रोफ्लुइडिक्स के माध्यम से जोड़ा जाता है, इस प्रकार घुटने के संयुक्त-ऑन-ए-चिप उत्पन्न होते हैं।
Abstract
ऑस्टियोआर्थराइटिस (ओए) जैसे दुर्बल जोड़ों की बीमारियों का उच्च प्रसार एक उच्च सामाजिक आर्थिक बोझ पैदा करता है। वर्तमान में, उपलब्ध दवाएं जो संयुक्त विकारों को लक्षित करती हैं, ज्यादातर उपशामक हैं। प्रभावी रोग-संशोधित ओए दवाओं (डीएमओएडी) की अपूरित आवश्यकता मुख्य रूप से रोग तंत्र का अध्ययन करने और संभावित डीएमओएडी के परीक्षण के लिए उपयुक्त मॉडल की अनुपस्थिति के कारण हुई है। यहां, हम मानव मेसेनकाइमल स्टेम कोशिकाओं (एमएससी) से प्राप्त वसा, रेशेदार और ओस्टियोकॉन्ड्रल ऊतक घटकों से युक्त एक लघु श्लेष संयुक्त-नकल माइक्रोफिजियोलॉजिकल सिस्टम (मिनीजॉइंट) की स्थापना का वर्णन करते हैं। त्रि-आयामी (3 डी) सूक्ष्म ऊतकों को प्राप्त करने के लिए, एमएससी को भेदभाव से पहले या बाद में फोटोक्रॉसलिंक करने योग्य मेथैक्रिलेटेड जिलेटिन में समझाया गया था। सेल से भरे ऊतक संरचनाओं को तब 3 डी-मुद्रित बायोरिएक्टर में एकीकृत किया गया था, जिससे मिनीजॉइंट का निर्माण हुआ। संबंधित ऊतक फेनोटाइप को बनाए रखने के लिए ओस्टोजेनिक, फाइब्रोजेनिक और एडिपोजेनिक मीडिया के अलग-अलग प्रवाह पेश किए गए थे। ऊतक क्रॉसस्टॉक को सक्षम करने के लिए उपास्थि, श्लेष और वसा ऊतकों के माध्यम से एक सामान्य रूप से साझा धारा को प्रवाहित किया गया था। यह प्रवाह पैटर्न यांत्रिक अध्ययन के लिए एक या अधिक ऊतक घटकों में गड़बड़ी के प्रेरण की अनुमति देता है। इसके अलावा, संभावित डीएमओएडी का परीक्षण सभी मध्यम धाराओं के माध्यम से “प्रणालीगत प्रशासन” या “इंट्राआर्टिकुलर प्रशासन” के माध्यम से किया जा सकता है, जिसमें दवाओं को केवल साझा “श्लेष द्रव” -अनुकरण प्रवाह में जोड़ा जाता है। इस प्रकार, मिनीजॉइंट रोग तंत्र का कुशलतापूर्वक अध्ययन करने और व्यक्तिगत चिकित्सा में दवाओं का परीक्षण करने के लिए एक बहुमुखी इन विट्रो प्लेटफॉर्म के रूप में काम कर सकता है।
Introduction
ऑस्टियोआर्थराइटिस (ओए) जैसे संयुक्त रोग अत्यधिक प्रचलित और दुर्बल करने वाले हैंऔर दुनिया भर में विकलांगता का एक प्रमुख कारण का प्रतिनिधित्व करते हैं। यह अनुमान लगाया गया है कि अकेले अमेरिका में, ओए 27 मिलियन रोगियों को प्रभावित करता है और 60 वर्ष औरउससे अधिक आयु के 12.1% वयस्कों में होता है। दुर्भाग्य से, वर्तमान में संयुक्त रोगों का प्रबंधन करने के लिए उपयोग की जाने वाली अधिकांश दवाएं उपशामक हैं, और कोई प्रभावी रोग-संशोधित ओए दवाएं (डीएमओएडी) उपलब्ध नहीं हैं। यह अपूर्ण चिकित्सा आवश्यकता मुख्य रूप से रोग तंत्र का अध्ययन करने और संभावित डीएमओएडी विकसित करने के लिए एक प्रभावी मॉडल की अनुपस्थिति से उपजी है। पारंपरिक दो-आयामी (2 डी) सेल संस्कृति संयुक्त ऊतकों की 3 डी प्रकृति को प्रतिबिंबित नहीं करती है, और ऊतक खोजों की संस्कृति अक्सर महत्वपूर्ण कोशिका मृत्यु से बाधित होती है और आमतौर पर गतिशील ऊतक अंतर्संबंधको दोहराने में विफल रहती है। इसके अलावा, आनुवंशिक और शारीरिक अंतर पशु मॉडल4 की शारीरिक प्रासंगिकता को काफी कम करते हैं।
ऑर्गन्स-ऑन-चिप्स (ओओसी), या माइक्रोफिजियोलॉजिकल सिस्टम, इंजीनियरिंग, जीव विज्ञान और चिकित्सा के इंटरफ़ेस पर एक आशाजनक शोध क्षेत्र हैं। ये इन विट्रो प्लेटफ़ॉर्म न्यूनतम कार्यात्मक इकाइयाँ हैं जो विवो समकक्षोंमें उनके परिभाषित स्वस्थ या पैथोलॉजिकल विशेषताओं को दोहराती हैं। इसके अलावा, ये लघु प्रणालियां विविध कोशिकाओं और मैट्रिक्स की मेजबानी कर सकती हैं और विभिन्न ऊतकों के बीच बायोफिज़िकल और जैव रासायनिक बातचीत का अनुकरण कर सकती हैं। इसलिए, एक माइक्रोफिजियोलॉजिकल सिस्टम जो मूल श्लेष संयुक्त को ईमानदारी से पुन: उत्पन्न कर सकता है, संयुक्त रोगों के मॉडलिंग और संभावित डीएमओएडी विकसित करने के लिए एक प्रभावी मंच प्रदान करने का वादा करता है।
मानव मेसेनकाइमल स्टेम कोशिकाओं (एमएससी) को पूरे शरीर में कई ऊतकों से अलग किया जा सकता है और ओस्टोजेनिक, चोंड्रोजेनिक और एडिपोजेनिकवंशावली में विभेदित किया जा सकता है। एमएससी का उपयोग हड्डी, उपास्थि और वसा ऊतक6 सहित विभिन्न ऊतकों को इंजीनियर करने के लिए सफलतापूर्वक किया गया है, इस प्रकार इसका अर्थ है कि वे घुटने के जोड़ के ऊतक घटकों को इंजीनियरिंग के लिए एक आशाजनक सेल स्रोत का प्रतिनिधित्व करते हैं। हमने हाल ही में एक लघु संयुक्त-नकल माइक्रोफिजियोलॉजिकल सिस्टम विकसित किया है, जिसका नाम मिनीजॉइंट है, जिसमें एमएससी-व्युत्पन्न हड्डी, उपास्थि, रेशेदार और वसा ऊतकशामिल हैं। विशेष रूप से, उपन्यास डिजाइन माइक्रोफ्लुइडिक प्रवाह या पारगम्यता द्वारा ऊतक क्रॉसस्टॉक को सक्षम बनाता है (चित्रा 1)। यहां, हम चिप घटकों के निर्माण, ऊतक घटकों की इंजीनियरिंग, चिप में इंजीनियर ऊतकों की संस्कृति और डाउनस्ट्रीम विश्लेषण के लिए ऊतकों के संग्रह के लिए प्रोटोकॉल प्रस्तुत करते हैं।
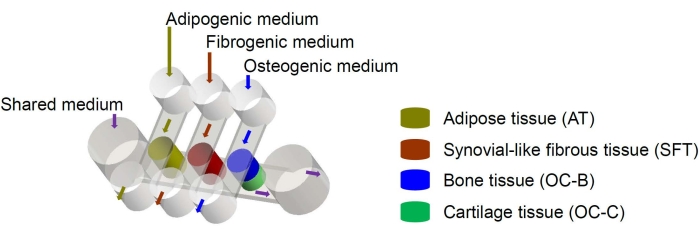
चित्रा 1: विभिन्न ऊतक घटकों और मध्यम प्रवाह की व्यवस्था दिखाने वाले मिनीजॉइंट चिप का योजनाबद्ध। ओसी = ओस्टियोकॉन्ड्रल ऊतक। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
Protocol
Representative Results
Discussion
इस लेख में, हम घुटने के संयुक्त-ऑन-चिप सिस्टम बनाने के लिए एक प्रोटोकॉल प्रस्तुत करते हैं, जिसमें हड्डी, उपास्थि, वसा ऊतक और सिनोवियम जैसे ऊतक एमएससी से बनते हैं और एक अनुकूलित बायोरिएक्टर के भीतर सह-सुस?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
यह शोध मुख्य रूप से राष्ट्रीय स्वास्थ्य संस्थान (UG3/ UH3TR002136, UG3 / UH3TR003090) से वित्त पोषण द्वारा समर्थित था। पॉल मैनर (वाशिंगटन विश्वविद्यालय) को मानव ऊतक के नमूने प्रदान करने के लिए और डॉ जियान टैन को एमएससी को अलग करने और सेल पूल बनाने में उनकी मदद के लिए धन्यवाद देते हैं।
Materials
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
References
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. 생물학. 9 (8), 194 (2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909 (2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575 (2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411 (2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400 (2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059 (2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).

