Создание коленного сустава-на-чипе для моделирования заболеваний суставов и тестирования лекарств
Summary
Мы предлагаем подробные методы создания четырех типов тканей из мезенхимальных стволовых клеток человека, которые используются для рекапитуляции хряща, кости, жирового пакета и синовиальной оболочки коленного сустава человека. Эти четыре ткани интегрированы в индивидуальный биореактор и соединены с помощью микрофлюидики, создавая таким образом коленный сустав на чипе.
Abstract
Высокая распространенность изнурительных заболеваний суставов, таких как остеоартрит (ОА), представляет собой высокое социально-экономическое бремя. В настоящее время доступные препараты, нацеленные на заболевания суставов, в основном паллиативны. Неудовлетворенная потребность в эффективных препаратах ОА, модифицирующих болезнь (ДМОАД), была вызвана главным образом отсутствием соответствующих моделей для изучения механизмов заболевания и тестирования потенциальных ДМОАД. Здесь описано создание миниатюрной микрофизиологической системы, имитирующей синовиальный сустав (miniJoint), включающей компоненты жировой, фиброзной и остеохондральной ткани, полученные из мезенхимальных стволовых клеток (МСК) человека. Для получения трехмерных (3D) микротканей МСК инкапсулировали в фотосшиваемый метакрилированный желатин до или после дифференцировки. Затем тканевые конструкции, нагруженные клетками, были интегрированы в биореактор, напечатанный на 3D-принтере, образуя мини-соединение. Были введены отдельные потоки остеогенной, фиброгенной и адипогенной сред для поддержания соответствующих тканевых фенотипов. Общий поток перфузировался через хрящевую, синовиальную и жировую ткани, чтобы обеспечить перекрестные помехи тканей. Эта картина потока позволяет индукция возмущений в одном или нескольких тканевых компонентах для механистических исследований. Кроме того, потенциальные ДМОАД могут быть протестированы либо путем «системного введения» через все потоки среды, либо путем «внутрисуставного введения» путем добавления лекарств только к общему потоку, имитирующему «синовиальную жидкость». Таким образом, miniJoint может служить универсальной платформой in vitro для эффективного изучения механизмов заболевания и тестирования лекарств в персонализированной медицине.
Introduction
Заболевания суставов, такие как остеоартрит (ОА), широко распространены и изнурительны и представляют собой ведущую причину инвалидности во всем мире1. По оценкам, только в США ОА поражает 27 миллионов пациентов и встречается у 12,1% взрослых в возрасте 60 лет и старше2 лет. К сожалению, большинство препаратов, используемых в настоящее время для лечения заболеваний суставов, являются паллиативными, и нет эффективных препаратов, модифицирующих болезнь ОА (DMOAD)3. Эта неудовлетворенная медицинская потребность в первую очередь связана с отсутствием эффективной модели для изучения механизмов заболевания и разработки потенциальных DMOAD. Традиционная двумерная (2D) культура клеток не отражает 3D-природу тканей суставов, а культивированию тканевых эксплантатов часто препятствует значительная гибель клеток и обычно не удается воспроизвести динамические тканевые взаимосвязи4. Кроме того, генетические и анатомические различия значительно снижают физиологическую значимость животных моделей4.
Органы-на-чипах (OoC), или микрофизиологические системы, являются перспективной областью исследований на стыке инженерии, биологии и медицины. Эти платформы in vitro представляют собой минимальные функциональные единицы, которые воспроизводят определенные здоровые или патологические особенности их аналогов in vivo 5. Кроме того, эти миниатюрные системы могут содержать различные клетки и матрицы и имитировать биофизические и биохимические взаимодействия между различными тканями. Таким образом, микрофизиологическая система, которая может точно повторять нативный синовиальный сустав, обещает предложить эффективную платформу для моделирования заболеваний суставов и разработки потенциальных DMOAD.
Мезенхимальные стволовые клетки человека (МСК) могут быть выделены из многих тканей по всему телу и дифференцированы на остеогенные, хондрогенные и адипогенные линии6. МСК успешно используются для создания различных тканей, включая костную, хрящевую и жировую ткань6, что означает, что они представляют собой многообещающий источник клеток для инженерии тканевых компонентов коленного сустава. Недавно мы разработали миниатюрную микрофизиологическую систему, имитирующую суставы, под названием miniJoint, которая включает в себя костную, хрящевую, фиброзную и жировую ткани, полученные из МСК7. В частности, новая конструкция обеспечивает перекрестные помехи тканей за счет микрофлюидного потока или проникновения (рис. 1). Здесь мы представляем протоколы изготовления компонентов чипа, проектирования компонентов ткани, культивирования инженерных тканей в чипе и сбора тканей для последующего анализа.
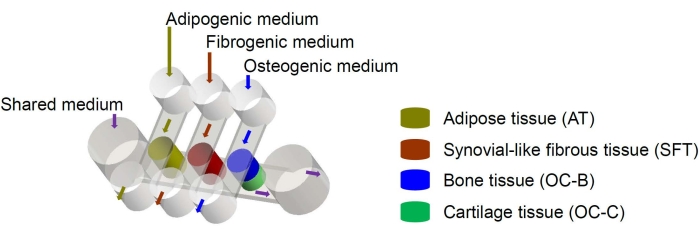
Рисунок 1: Схема чипа miniJoint, показывающая расположение различных компонентов ткани и потоков среды. ОК = остеохондральная ткань. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
В этой статье мы представляем протокол создания системы коленного сустава на чипе, в которой кости, хрящи, жировая ткань и синовиально-подобные ткани формируются из МСК и совместно культивируются в индивидуальном биореакторе. Эта многокомпонентная система на основе клеток человека с ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Это исследование было в основном поддержано финансированием Национальных институтов здравоохранения (UG3 / UH3TR002136, UG3 / UH3TR003090). Кроме того, мы благодарим доктора Пола Маннера (Вашингтонский университет) за предоставление образцов тканей человека и доктора Цзянь Тана за помощь в изоляции МСК и создании пула клеток.
Materials
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
References
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. 생물학. 9 (8), 194 (2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909 (2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575 (2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411 (2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400 (2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059 (2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).

