Skapande av en knäled-på-ett-chip för modellering av ledsjukdomar och testning av läkemedel
Summary
Vi tillhandahåller detaljerade metoder för att generera fyra typer av vävnader från humana mesenkymala stamceller, som används för att rekapitulera brosk, ben, fettkudde och synovium i den mänskliga knäleden. Dessa fyra vävnader är integrerade i en anpassad bioreaktor och anslutna via mikrofluidik, vilket genererar en knäled-på-ett-chip.
Abstract
Den höga förekomsten av försvagande ledsjukdomar som artros (OA) utgör en hög socioekonomisk börda. För närvarande är de tillgängliga läkemedlen som riktar sig mot ledsjukdomar mestadels palliativa. Det ouppfyllda behovet av effektiva sjukdomsmodifierande OA-läkemedel (DMOAD) har främst orsakats av avsaknaden av lämpliga modeller för att studera sjukdomsmekanismerna och testa potentiella DMOAD. Här beskriver vi etableringen av ett miniatyr synovialt ledliknande mikrofysiologiskt system (miniJoint) bestående av fett-, fibrösa och osteokondrala vävnadskomponenter härledda från humana mesenkymala stamceller (MSC). För att erhålla de tredimensionella (3D) mikrovävnaderna inkapslades MSC i fototvärbindningsbart metakrylerat gelatin före eller efter differentiering. De cellbelastade vävnadskonstruktionerna integrerades sedan i en 3D-printad bioreaktor och bildade miniJoint. Separata flöden av osteogena, fibrogena och adipogenic media infördes för att upprätthålla respektive vävnadsfenotyper. En gemensamt delad ström perfuserades genom brosk-, synovial- och fettvävnaderna för att möjliggöra vävnadsöverhörning. Detta flödesmönster möjliggör induktion av störningar i en eller flera av vävnadskomponenterna för mekanistiska studier. Dessutom kan potentiella DMOAD testas via antingen “systemisk administrering” genom alla medieströmmar eller “intraartikulär administrering” genom att lägga till läkemedlen till endast det delade “synovialvätska” -simulerande flödet. Således kan miniJoint fungera som en mångsidig in vitro-plattform för att effektivt studera sjukdomsmekanismer och testa läkemedel i personlig medicin.
Introduction
Gemensamma sjukdomar som artros (OA) är mycket vanliga och försvagande och utgör en ledande orsak till funktionshinder över hela världen1. Det uppskattas att enbart i USA påverkar OA 27 miljoner patienter och förekommer hos 12,1% av vuxna i åldern 60 år och äldre2. Tyvärr är de flesta läkemedel som för närvarande används för att hantera ledsjukdomar palliativa, och inga effektiva sjukdomsmodifierande OA-läkemedel (DMOAD) finns tillgängliga3. Detta ouppfyllda medicinska behov härrör främst från avsaknaden av en effektiv modell för att studera sjukdomsmekanismerna och utveckla potentiella DMOAD. Den konventionella tvådimensionella (2D) cellkulturen återspeglar inte 3D-naturen hos ledvävnader, och kulturen av vävnadsexplantat hindras ofta av signifikant celldöd och misslyckas vanligtvis med att replikera de dynamiska vävnadskopplingarna4. Dessutom minskar genetiska och anatomiska skillnader signifikant den fysiologiska relevansen av djurmodeller4.
Organ-on-chips (OoCs), eller mikrofysiologiska system, är ett lovande forskningsområde i gränssnittet mellan teknik, biologi och medicin. Dessa in vitro-plattformar är minimala funktionella enheter som replikerar definierade friska eller patologiska egenskaper hos sina in vivo-motsvarigheter 5. Dessutom kan dessa miniatyriserade system vara värd för olika celler och matriser och simulera de biofysiska och biokemiska interaktionerna mellan olika vävnader. Därför lovar ett mikrofysiologiskt system som troget kan rekapitulera den ursprungliga synovialleden att erbjuda en effektiv plattform för modellering av ledsjukdomar och utveckla potentiella DMOAD.
Mänskliga mesenkymala stamceller (MSC) kan isoleras från många vävnader i hela kroppen och differentieras till osteogena, kondrogeniska och adipogena linjer6. MSC har framgångsrikt använts för att konstruera olika vävnader, inklusive ben, brosk och fettvävnad6, vilket innebär att de representerar en lovande cellkälla för att konstruera vävnadskomponenterna i knäleden. Vi utvecklade nyligen ett miniatyr gemensamt efterliknande mikrofysiologiskt system, kallat miniJoint, som består av MSC-härledda ben-, brosk-, fibrösa och fettvävnader7. I synnerhet möjliggör den nya designen vävnadsöverhörning genom mikrofluidiskt flöde eller genomträngning (figur 1). Här presenterar vi protokollen för tillverkning av chipkomponenterna, konstruktion av vävnadskomponenterna, odling av de konstruerade vävnaderna i chipet och insamling av vävnader för nedströmsanalyser.
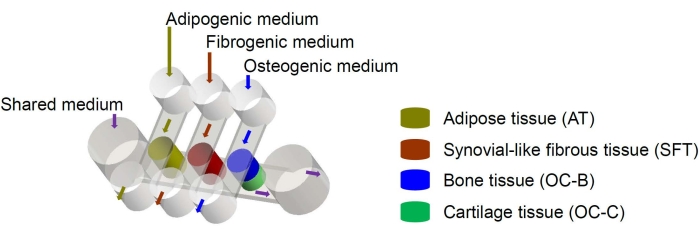
Figur 1: Schematisk bild av miniJoint-chipet som visar arrangemanget av de olika vävnadskomponenterna och medieflödena. OC = osteokondral vävnad. Klicka här för att se en större version av denna figur.
Protocol
Representative Results
Discussion
I den här artikeln presenterar vi ett protokoll för att skapa ett knäled-på-ett-chip-system, där ben, brosk, fettvävnad och synoviumliknande vävnader bildas från MSC och samodlas i en anpassad bioreaktor. Detta flerkomponents, humana cell-härledda system med plug-and-play-funktioner representerar ett nytt verktyg för att studera patogenesen av ledsjukdomar och utveckla läkemedel.
Med tanke på att olika vävnader gynnar specifika odlingsmedier är det viktigt att tillhandahålla re…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Denna forskning stöddes främst av finansiering från National Institutes of Health (UG3 / UH3TR002136, UG3 / UH3TR003090). Dessutom tackar vi Dr. Paul Manner (University of Washington) för att ha tillhandahållit de mänskliga vävnadsproverna och Dr. Jian Tan för deras hjälp med att isolera MSC: erna och skapa cellpoolen.
Materials
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
References
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. 생물학. 9 (8), 194 (2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909 (2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575 (2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411 (2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400 (2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059 (2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).

