Vurdering av termisk skade fra robotboret kraniotomi for kranialvinduskirurgi hos mus
Summary
Kraniale vinduer har blitt en allestedsnærværende implementert kirurgisk teknikk for å tillate intravital avbildning i transgene mus. Denne protokollen beskriver bruken av en kirurgisk robot som utfører halvautomatisk beinboring av kraniale vinduer og kan bidra til å redusere variasjonen mellom kirurg og kirurg og delvis redusere termisk blod-hjernebarriereskade.
Abstract
Kranial vinduskirurgi muliggjør avbildning av hjernevev i levende mus ved bruk av multifoton eller andre intravitale bildebehandlingsteknikker. Men når du utfører kraniotomi for hånd, er det ofte termisk skade på hjernevev, som er iboende variabel kirurgi til kirurgi og kan være avhengig av individuell kirurgteknikk. Implementering av en kirurgisk robot kan standardisere kirurgi og føre til en reduksjon i termisk skade forbundet med kirurgi. I denne studien ble tre metoder for robotboring testet for å evaluere termisk skade: horisontal, punkt-for-punkt og pulserende punkt-for-punkt. Horisontal boring benytter et kontinuerlig boreskjema, mens punkt-for-punkt borer flere hull som omfatter kranialvinduet. Pulsert punkt-for-punkt legger til et “2 s på, 2 s av” boreskjema for å tillate avkjøling mellom boring. Fluorescerende avbildning av Evans Blue (EB) fargestoff injisert intravenøst måler skade på hjernevev, mens et termoelement plassert under borestedet måler termisk skade. Termoelementresultater indikerer en signifikant reduksjon i temperaturendring i gruppen pulserende punkt-for-punkt (6,90 °C ± 1,35 °C) sammenlignet med gruppen horisontal (16,66 °C ± 2,08 °C) og punkt-for-punkt (18,69 °C ± 1,75 °C). Tilsvarende viste den pulserende punkt-for-punkt-gruppen også signifikant mindre EB-tilstedeværelse etter kranial vindusboring sammenlignet med den horisontale metoden, noe som indikerer mindre skade på blodkar i hjernen. Dermed ser en pulserende punkt-for-punkt-boremetode ut til å være den optimale ordningen for å redusere termisk skade. En robotdrill er et nyttig verktøy for å minimere trening, variasjon og redusere termisk skade. Med den økende bruken av multifotonavbildning på tvers av forskningslaboratorier, er det viktig å forbedre strengheten og reproduserbarheten av resultatene. Metodene som tas opp her, vil bidra til å informere andre om hvordan man bedre kan bruke disse kirurgiske robotene for å fremme feltet ytterligere.
Introduction
Kranialvinduer har blitt allestedsnærværende brukt innen nevrovitenskap, nevralteknikk og biologi for å muliggjøre direkte visualisering og avbildning av cortex hos levende dyr 1,2,3,4,5,6,7,8,9,10,11 . Den kraftige kombinasjonen av transgene mus og multifotonavbildning har gitt ekstremt verdifull innsikt i kretsaktivitet og annen biologisk innsikt i in vivo-hjernen 12,13,14,15,16,17,18. Miniatyrmikroskoper montert på hodeskallen har ytterligere utvidet disse mulighetene for å muliggjøre opptak i våkne, fritt bevegelige dyr19. Prosessen med å lage et kranialvindu krever kraftboring for å tynne eller helt fjerne kranialbenet for å produsere store nok kraniotomier for å sikre et gjennomsiktig stykke glass over cortex20. Polydimetylsiloksan (PDMS) og andre polymerer har også blitt testet som kraniale vindusmaterialer 9,21. Til syvende og sist er det ideelle kranialvinduet et som ikke endrer eller forstyrrer normal endogen aktivitet under. Imidlertid er det allment akseptert at kranialvinduboring forverrer underliggende vev, noe som fører til skade på hjernen, forstyrrelse av miljøet og påvirker meninges til det punktet å okkludere multifoton bildedybde22. Den resulterende nevroinflammasjonen har et bredt spekter av effekter som spenner fra permeabilitet av blod-hjernebarrieren (BBB), til aktivering og rekruttering av gliaceller rundt implantatstedet23. Derfor er karakterisering av sikrere og mer reproduserbare kraniale vindusboremetoder avgjørende for konsistent bildekvalitet og reduksjon av forstyrrende faktorer.
Mens det tas hensyn til å minimere traumer til det underliggende vevet, har boringen av beinet potensial til å forårsake både termiske og mekaniske forstyrrelser i hjernen24,25. Mekanisk traume fra utilsiktet borepenetrasjon i dura kan ytterligere indusere varierende grad av kortikal skade24. I en studie av Shoffstall et al.25 resulterte varmen fra beinboring i økt BBB-permeabilitet, som indikert ved tilstedeværelsen av Evans Blue (EB) fargestoff i hjerneparenkymet 25. EB-fargestoff, injisert intravenøst, binder seg til sirkulerende albumin i blodet og krysser derfor normalt ikke en sunn BBB i nevneverdige konsentrasjoner. Som et resultat blir EB-fargestoff ofte brukt som en sensitiv markør for BBB-permeabilitet26,27. Selv om studien deres ikke direkte målte virkningen av BBB-permeabiliteten på påfølgende biologiske følger som ble studert, har tidligere studier korrelert BBB-permeabilitet til økt nevroinflammatorisk respons på kronisk implanterte mikroelektroder og endringer i motorisk funksjon28.
Avhengig av målene for studien, kan størrelsen på termisk og mekanisk skade bidra til en kilde til eksperimentell feil, som negativt påvirker studiens strenghet og reproduserbarhet. Det finnes dusinvis av siterte metoder for å produsere kraniale vinduer, hver med forskjellig boreutstyr, hastigheter, teknikker og brukere 1,2,3,4,5,6,7,8,9,10,11. Shoffstall et al.25 rapporterte at den observerte variasjonen i oppvarmingsresultatene ble tilskrevet variabilitet i borets påførte kraft, matehastighet og påføringsvinkel, blant andre aspekter som ikke kan kontrolleres for ved boring for hånd 25. Det er en tro på at automatiserte boresystemer og annet stereotaktisk utstyr kan forbedre reproduserbarhet og utfallskonsistens, men publiserte metodestudier har ikke grundig evaluert temperatur eller BBB-permeabilitet som et av resultatene. Derfor er det behov for mer reproduserbare og konsekvent anvendte metoder for å produsere kraniale vinduer, samt metoder som brukes nøye for å vurdere virkningen av kranialvindusboring på underliggende nevralvev.
Fokus for denne studien er å bestemme og utvikle konsistente og sikre boremetoder for kraniale vinduer. Størrelsen på kraniotomi for kranialvinduinstallasjon er betydelig større enn standard kraniotomier for hjerneimplanterte mikroelektroder. Slike kraniotomier kan ikke kompletteres med et enkelt burrhull ved bruk av standardutstyr, og introduserer dermed mer variasjon i teknikken mellom kirurger når de utføres for hånd20. Kirurgiske boreroboter har blitt introdusert til feltet, men har ikke blitt utbredt 1,6,29. Automatisering av boring gir kontroll over variabler som bidrar til observert variasjon fra forsøk til forsøk, noe som tyder på at bruk av utstyret kan redusere inter- og intrakirurgeffekter. Dette er av spesiell interesse gitt den ekstra vanskeligheten med den større kraniotomien som trengs for kranialvindusplassering. Mens man kan anta at det er klare fordeler med kontrollen som automatiserer boringen gir, har det vært lite vurdering av implementeringen av dette utstyret. Selv om synlige lesjoner ikke er observert5, er man ønskelig med høyere sensitivitetstest med EB.
Her måles BBB-permeabilitet ved hjelp av en kommersielt tilgjengelig kirurgisk borerobot med tilhørende programvare, som muliggjør programmering av stereotaktiske koordinater, kraniotomiplanlegging/kartlegging og et utvalg av borestiler (“punkt-for-punkt” vs “horisontal”), med henvisning til borekronens rutede bane. I utgangspunktet bores åtte “frø” -punkter (figur 1A), som beskriver kranialvinduet. Herfra kuttes mellomrommet mellom frøene ut ved hjelp av enten “punkt-for-punkt” eller “horisontal” boremetode. “Punkt-for-punkt” utfører vertikale pilothullkutt (ligner på en CNC-borepresse), mens “horisontal” utfører horisontale kutt langs omkretsen av kranialvinduet som skisserer hullet (ligner på en CNC-ruter). Resultatet for begge metodene er et stykke hodeskalle som kan fjernes for å avsløre kranialvinduet. For å isolere skader fra boring, fjernes ikke kranialvinduet fysisk, for å unngå ytterligere skade. En kombinasjon av EB-fargestoff kombinert med fluorescerende avbildning brukes til å måle BBB-permeabilitet etter å ha utført kraniotomier hos mus, og et innsatt termoelement brukes til å måle temperaturen på hjerneoverflaten direkte under boring (figur 1B, C). Tidligere observasjoner indikerte at pulserende boring på/av med 2 s intervaller var tilstrekkelig til å redusere borevarme25, og er derfor innarbeidet i den eksperimentelle tilnærmingen for operasjonsroboten.
Hensikten med det presenterte arbeidet er å demonstrere metoder for å vurdere termisk skade fra kraniotomiboring. Mens metodene presenteres i sammenheng med automatisert boring, kan slike metoder også brukes på manuelle boreordninger. Disse metodene kan brukes til å validere bruken av utstyr og/eller boreskjemaer før de tas i bruk som standardprosedyre.
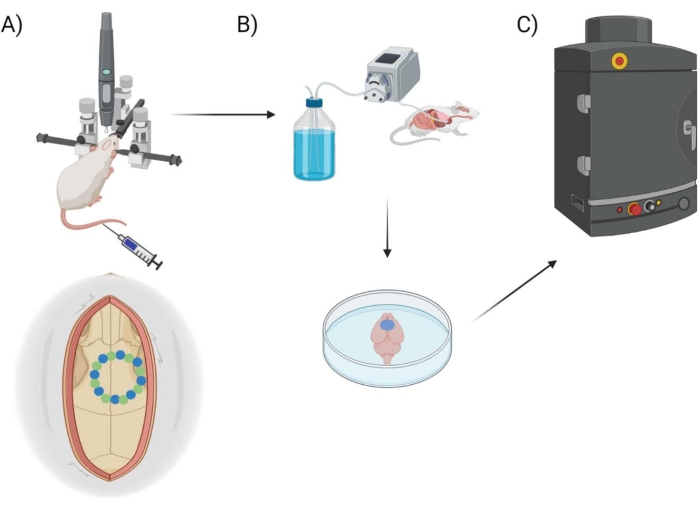
Figur 1: Skjematisk eksperimentell pipeline. Skjematisk demonstrering av prosessen dyr gjennomgikk for EB-kvantifisering etter kranialvindusprosedyre. (A) Skjematisk oppsett av musen med stereotaksisk ramme og kirurgisk robotbor. Et eksempel på kranievindu er vist over den motoriske hjernebarken med frøpunkter (grønn) og kantpunkter (blå). (B) Perfusjonsoppsettet inkluderer injeksjon av 1x fosfatbufret saltvann (PBS) i hele dyret for å fjerne blod, etterfulgt av ekstraksjon av hjernen. (C) Hjernen blir deretter satt inn i EB fluorescerende bildesystemkammer for å utføre fluorescerende avbildning på Evans Blue-fargestoffet. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Bruk av EB-fargestoff og avbildning er enkelt, raskt og nyttig for å evaluere vaskulær skade i hjernen for nye metoder og teknikker. Enten du bruker en kirurgisk robot eller bekrefter metoder som for tiden gjøres i laboratoriet, er det viktig å validere kirurgiske metoder for å isolere effekten av eksperimentelle behandlinger vs. kirurgisk påvirkning og forbedre dyrevelferden. Et termoelementoppsett er også nyttig for å evaluere boremetoder for å sikre at det ikke oppstår oppvarming. Temperaturøkninger på gru…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Denne studien ble støttet delvis av Merit Review Awards GRANT12418820 (Capadona) og GRANTI01RX003420 (Shoffstall / Capadona), og Research Career Scientist Award # GRANT12635707 (Capadona) fra USA (US) Department of Veterans Affairs Rehabilitation Research and Development Service. I tillegg ble dette arbeidet også delvis støttet av National Institute of Health, National Institute of Neurological Disorders and Stroke GRANT12635723 (Capadona), og National Institute for Biomedical Imaging and Bioengineering, T32EB004314, (Capadona / Kirsch). Dette materialet er basert på arbeid støttet av National Science Foundation Graduate Research Fellowship under Grant No. GRANT12635723. Eventuelle meninger, funn og konklusjoner eller anbefalinger uttrykt i dette materialet er de av forfatterne (e) og gjenspeiler ikke nødvendigvis synspunktene til National Science Foundation.
Materials
| 1x Phosphate Buffered Saline Type: Reagent |
VWR | MRGF-6235 | For Evans Blue dilution |
| Aura Software Type: Tool |
Spectral Instruments Imaging | Open access imaging processing software for Lumina imaging sytems | |
| Buprenorphine Type: Drug |
Sourced from Animal Facility | ||
| Carbide Drill Bit, 0.6mm (Robot Drill) Type: Tool |
Stoelting | 58640-1 | |
| Carprofen Type: Drug |
Sourced from Animal Facility | ||
| Cefazolin Type: Drug |
Sourced from Animal Facility | ||
| Evans Blue Dye Type: Reagent |
Millipore Sigma | E2129 | Reconstituted in 1x phosphate-buffered saline |
| Isoflurane Type: Drug |
Sourced from Animal Facility | ||
| IVIS Lumina II Type: Tool |
Perkin Elmer | CLS136334 | IVIS Lumina III currently in place of Lumina II on the market |
| Jenco Linearizing Thermometer Type: Tool |
Jenco | 765JF | For Thermocouple setup |
| Ketamine Type: Drug |
Sourced from Animal Facility | ||
| LivingImage Type: Tool |
Perkin Elmer | Software for IVIS Lumina III | |
| Marcaine Type: Drug |
Sourced from Animal Facility | ||
| Neurostar Software Type: Tool |
Stoelting | Comes with surgical robot purchase | |
| Physiosuite with MouseSTAT® Pulse Oximeter & Heart Rate Monitor Type: Tool |
Kent Scientific | PS-03 | Used to monitor vitals |
| PrismPlus mice Type: Animal |
Jackson Labortory | 031478, RRID:IMSR_JAX:031478, Male, ~8 months old | Animals used for the study |
| Stoelting Drill and Injection Robot for Motorized Stereotaxic Instruments Type: Tool |
Stoelting | 58640 | Main robotic drill with stereotaxic frame |
| Thermocouple Type: Tool |
TC Direct | 206-557 | For Thermocouple setup |
| USB-6008 Multifunction I/O DAQ Type: Tool |
National Instruments | USB-6008 | For Thermocouple setup |
| Xylazine Type: Drug |
Sourced from Animal Facility |
References
- Kilic, K., et al. Chronic cranial windows for long term multimodal neurovascular imaging in mice. Frontiers in Physiology. 11, 612678 (2020).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Augustinaite, S., Kuhn, B. Intrinsic optical signal imaging and targeted injections through a chronic cranial window of a head-fixed mouse. STAR Protocols. 2 (3), 100779 (2021).
- Wang, X., et al. A skull-removed chronic cranial window for ultrasound and photoacoustic imaging of the rodent brain. Frontiers in Neuroscience. 15, 673740 (2021).
- Wang, Y., Xi, L. Chronic cranial window for photoacoustic imaging: a mini review. Visual Computing for Industry, Biomedicine, and Art. 4 (1), 15 (2021).
- Augustinaite, S., Kuhn, B. Chronic cranial window for imaging cortical activity in head-fixed mice. STAR Protocols. 1 (3), 100194 (2020).
- Kunori, N., Takashima, I. An implantable cranial window using a collagen membrane for chronic voltage-sensitive dye imaging. Micromachines. 10 (11), 789 (2019).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomedical Optics Express. 10 (10), 5235-5250 (2019).
- Heo, C., et al. A soft, transparent, freely accessible cranial window for chronic imaging and electrophysiology. Scientific Reports. 6, 27818 (2016).
- Holtmaat, A., et al. Imaging neocortical neurons through a chronic cranial window. Cold Spring Harbor Protocols. 2012 (6), 694-701 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Sundaram, G. S., et al. Characterization of a brain permeant fluorescent molecule and visualization of Abeta parenchymal plaques, using real-time multiphoton imaging in transgenic mice. Organic Letters. 16 (14), 3640-3643 (2014).
- Spires, T. L., et al. Dendritic spine abnormalities in amyloid precursor protein transgenic mice demonstrated by gene transfer and intravital multiphoton microscopy. Journal of Neuroscience. 25 (31), 7278-7287 (2005).
- Price, D. L., et al. High-resolution large-scale mosaic imaging using multiphoton microscopy to characterize transgenic mouse models of human neurological disorders. Neuroinformatics. 4 (1), 65-80 (2006).
- Kimchi, E. Y., Kajdasz, S., Bacskai, B. J., Hyman, B. T. Analysis of cerebral amyloid angiopathy in a transgenic mouse model of Alzheimer disease using in vivo multiphoton microscopy. Journal of Neuropathology and Experimental Neurology. 60 (3), 274-279 (2001).
- Hyman, B. T. The natural history of Alzheimer disease dissected through multiphoton imaging of transgenic mice. Alzheimer Disease and Associated Disorders. 20 (4), 206-209 (2006).
- Korzhova, V., et al. Long-term dynamics of aberrant neuronal activity in awake Alzheimer’s disease transgenic mice. Communications Biology. 4 (1), 1368 (2021).
- Chawda, C., McMorrow, R., Gaspar, N., Zambito, G., Mezzanotte, L. Monitoring immune cell function through optical imaging: a review highlighting transgenic mouse models. Molecular Imaging and Biology. 24 (2), 250-263 (2022).
- Courtin, J., et al. A neuronal mechanism for motivational control of behavior. Science. 375 (6576), (2022).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments. (12), e680 (2008).
- Cramer, S. W., et al. Through the looking glass: A review of cranial window technology for optical access to the brain. Journal of Neuroscience Methods. 354, 109100 (2021).
- Eles, J. R., Vazquez, A. L., Kozai, T. D. Y., Cui, X. T. Meningeal inflammatory response and fibrous tissue remodeling around intracortical implants: An in vivo two-photon imaging study. Biomaterials. 195, 111-123 (2019).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001 (2015).
- Cole, J. T., et al. Craniotomy: true sham for traumatic brain injury, or a sham of a sham. Journal of Neurotrauma. 28 (3), 359-369 (2011).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001 (2018).
- Saunders, N. R., Dziegielewska, K. M., Mollgard, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385 (2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Scientific Reports. 4, 6588 (2014).
- Goss-Varley, M., et al. Microelectrode implantation in motor cortex causes fine motor deficit: Implications on potential considerations to Brain Computer Interfacing and Human Augmentation. Scientific Reports. 7 (1), 15254 (2017).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007 (2021).
- Dougherty, J. D., Zhang, J., Feng, H., Gong, S., Heintz, N. Mouse transgenesis in a single locus with independent regulation for multiple fluorophores. PLoS One. 7 (7), 40511 (2012).
- Jung, S., et al. Analysis of fractalkine receptor CX(3)CR1 function by targeted deletion and green fluorescent protein reporter gene insertion. Molecular and Cellular Biology. 20 (3), 4106-4114 (2000).
- Kiyatkin, E. A., Sharma, H. S. Permeability of the blood-brain barrier depends on brain temperature. 신경과학. 161 (3), 926-939 (2009).
- Eriksson, A. R., Albrektsson, T. Temperature threshold levels for heat-induced bone tissue injury: a vital-microscopic study in the rabbit. The Journal of Prosthetic Dentistry. 50 (1), 101-107 (1983).
- Bonfield, W., Li, C. H. The temperature dependence of the deformation of bone. Journal of Biomechanics. 1 (4), 323-329 (1968).
- Hrapkiewicz, K., Medina, L. . Clinical Laboratory Animal Medicine, second ed. , (2007).
- McLean, R., Moritz, A. R., Roos, A. Studies of thermal Injury. VI. Hyperpotassemia caused by cutaneous exposure to excessive heat. Journal of Clinical Investigations. 26 (3), 497-504 (1947).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments. (123), e52642 (2017).

