Purificación de polisomas a partir de nódulos simbióticos de soja
Summary
Este protocolo describe un método para la purificación de polisomas eucariotas a partir de nódulos de soja intactos. Después de la secuenciación, se pueden utilizar tuberías estándar para el análisis de la expresión génica para identificar genes expresados diferencialmente a nivel de transcriptoma y translatomo.
Abstract
El objetivo de este protocolo es proporcionar una estrategia para estudiar el translatomo eucariota del nódulo simbiótico de soja (Glycine max). Este documento describe métodos optimizados para aislar polirribosomas derivados de plantas y sus ARNm asociados para ser analizados mediante secuenciación de ARN. En primer lugar, los lisados citoplasmáticos se obtienen mediante homogeneización en condiciones de preservación de polisomas y ARN a partir de nódulos de soja enteros congelados. Luego, los lisados se eliminan por centrifugación a baja velocidad, y el 15% del sobrenadante se usa para el aislamiento de ARN total (TOTAL). El lisado eliminado restante se utiliza para aislar polisomas por ultracentrifugación a través de un cojín de sacarosa de dos capas (12% y 33,5%). El ARNm asociado a polisomas (PAR) se purifica a partir de gránulos polisomales después de la resuspensión. Tanto TOTAL como PAR se evalúan mediante electroforesis capilar altamente sensible para cumplir con los estándares de calidad de las bibliotecas de secuenciación para RNA-seq. Como ejemplo de una aplicación posterior, después de la secuenciación, se pueden utilizar tuberías estándar para el análisis de la expresión génica para obtener genes expresados diferencialmente a nivel de transcriptoma y translatomo. En resumen, este método, en combinación con RNA-seq, permite estudiar la regulación traslacional de los ARNm eucariotas en un tejido complejo como es el nódulo simbiótico.
Introduction
Las plantas leguminosas, como la soja (Glycine max), pueden establecer simbiosis con bacterias específicas del suelo llamadas rizobios. Esta relación mutualista provoca la formación de nuevos órganos, los nódulos simbióticos, en las raíces de las plantas. Los nódulos son los órganos de la planta que albergan las bacterias y consisten en células huésped cuyo citoplasma está colonizado con una forma especializada de rizobios llamados bacteroides. Estos bacteroides catalizan la reducción del nitrógeno atmosférico (N2) en amoníaco, que se transfiere a la planta a cambio de carbohidratos 1,2.
Aunque esta simbiosis fijadora de nitrógeno es una de las simbiosis planta-microbio mejor estudiadas, quedan muchos aspectos por comprender mejor, como cómo las plantas sometidas a diferentes condiciones de estrés abiótico modulan su interacción con su pareja simbiótica y cómo esto afecta el metabolismo de los nódulos. Estos procesos podrían entenderse mejor analizando el translatomo de nódulos (es decir, el subconjunto de ARN mensajeros [ARNm] traducidos activamente). Los polirribosomas o polisomas son complejos de múltiples ribosomas asociados con el ARNm, comúnmente utilizados para estudiar la traducción3. El método de perfilado de polisomas consiste en el análisis de los ARNm asociados a polisomas y ha sido utilizado con éxito para estudiar los mecanismos posttranscripcionales que controlan la expresión génica que ocurre en diversos procesos biológicos 4,5.
Históricamente, el análisis de expresión del genoma se ha centrado principalmente en determinar la abundancia de ARNm 6,7,8,9. Sin embargo, existe una falta de correlación entre la transcripción y los niveles de proteínas debido a las diferentes etapas de la regulación posttranscripcional de la expresión génica, particularmente la traducción10,11,12. Además, no se ha observado dependencia entre los cambios a nivel del transcriptoma y los que ocurren a nivel del translatomo13. El análisis directo del conjunto de ARNm que se están traduciendo permite una medición más precisa y completa de la expresión génica celular (cuyo punto final es la abundancia de proteínas) que la obtenida cuando sólo se analizan los niveles de ARNm14,15,16.
Este protocolo describe cómo los polisomas derivados de plantas se purifican a partir de nódulos de soja intactos mediante centrifugación diferencial a través de un cojín de sacarosa de dos capas (Figura 1). Sin embargo, dado que los ribosomas derivados de bacteroides también están presentes en los nódulos, se purifica una mezcla de ribosomas y especies de ARN, aunque los eucariotas representan la fracción principal (90%-95%). También se describe el posterior aislamiento, cuantificación y control de calidad del ARN (Figura 1). Este protocolo, en combinación con RNA-seq, debería proporcionar resultados experimentales sobre la regulación traslacional de los ARNm eucariotas en un tejido complejo como el nódulo simbiótico.
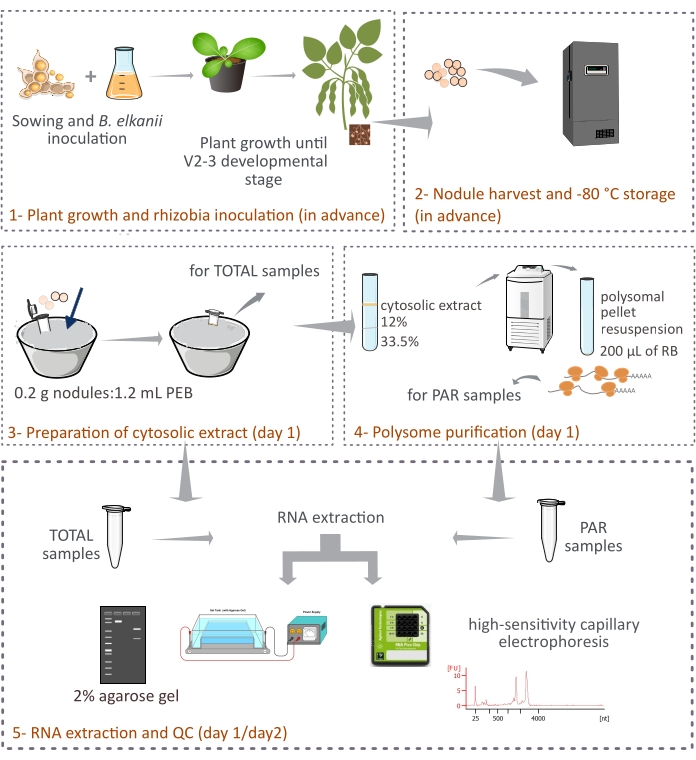
Figura 1: Resumen esquemático de la metodología propuesta para la purificación de polisomas eucariotas a partir de nódulos simbióticos. El esquema ofrece una visión general de los pasos seguidos en el protocolo desde (1) crecimiento de plantas y (2) recolección de nódulos hasta (3) preparación de los extractos citosólicos, (3) obtención de muestras TOTAL y (4) muestras PAR, y (5) extracción de ARN y control de calidad. Abreviaturas: PEB = tampón de extracción de polisomas; RB = tampón de resuspensión; TOTAL = ARN total; PAR = ARNm asociado a polisomas. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
El estudio de la regulación de la expresión génica a nivel traslacional es fundamental para comprender mejor los diferentes procesos biológicos, ya que el punto final de la expresión génica celular es la abundancia de proteínas13,14. Esto se puede evaluar analizando el translatomo del tejido u organismo de interés para el cual se debe purificar la fracción polisomal y analizar sus ARNm asociados 3,4,34,35,36.<sup class=…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Esta investigación ha sido financiada por la subvención I+D 2020 del CSIC nº 282, la subvención FVF 2017 nº 210 y PEDECIBA (María Martha Sainz).
Materials
| Plant growth and rhizobia inoculation | |||
| Orbital shaker | Daihan Scientific | Model SHO-1D | |
| YEM-medium | Amresco | J850 (yeast extract) 0122 (mannitol) | |
| Water deficit treatment | |||
| KNO3 | Merck | 221295 | |
| Porometer | Decagon Device | Model SC-1 | |
| Scalpel | |||
| Preparation of cytosolic extracts | |||
| Brij L23 | Sigma-Aldrich | P1254 | |
| Centrifuge | Sigma | Model 2K15 | |
| Chloranphenicol | Sigma-Aldrich | C0378 | |
| Cycloheximide | Sigma-Aldrich | C7698 | |
| DOC | Sigma-Aldrich | 30970 | |
| DTT | Sigma-Aldrich | D9779 | |
| EGTA | Sigma-Aldrich | E3889 | |
| Igepal CA 360 | Sigma-Aldrich | I8896 | |
| KCl | Merck | 1.04936 | |
| MgCl2 | Sigma-Aldrich | M8266 | |
| Plastic tissue grinder | Fisher Scientific | 12649595 | |
| PMSF | Sigma-Aldrich | P7626 | |
| PTE | Sigma-Aldrich | P2393 | |
| Tris | Invitrogen | 15504-020 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Weighing dish | Deltalab | 1911103 | |
| Preparation of sucrose cushions | |||
| Sucrose | Invitrogen | 15503022 | |
| SW 40 Ti rotor | Beckman-Coulter | ||
| Ultracentrifuge | Beckman-Coulter | Optima L-100K | |
| Ultracentrifuge tubes | Beckman-Coulter | 344059 | 13.2 mL tubes |
| RNA extraction and quality control | |||
| Agarose | Thermo scientific | R0492 | |
| Bioanalyzer | Agilent | Model 2100. Eukaryote total RNA nano assay | |
| Chloroform | DI | 41191 | |
| Ethanol | Dorwil | UN1170 | |
| Isopropanol | Mallinckrodt | 3032-06 | |
| Glycogen | Sigma | 10814-010 | |
| TRIzol LS | Ambion | 102960028 | |
| Miscellaneous | |||
| Falcon tubes 15 mL | Biologix | 10-0152 | |
| Filter tips 10 µL | BioPointe Scientific | 321-4050 | |
| Filter tips 1000 µL | BioPointe Scientific | 361-1050 | |
| Filter tips 20 µL | BioPointe Scientific | 341-4050 | |
| Filter tips 200 µL | Tarsons | 528104 | |
| Microcentrifuge tubes 1.5 mL | Tarsons | 500010-N | |
| Microcentrifuge tubes 2.0 mL | Tarsons | 500020-N | |
| Sequencing company | Macrogen | ||
| Sterile 250 mL flask | Marienfeld | 4110207 |
References
- Limpens, E., et al. Cell- and tissue-specific transcriptome analyses of Medicago truncatula root nodules. PLoS ONE. 8 (5), 64377 (2013).
- Masson-Boivin, C., Giraud, E., Perret, X., Batut, J. Establishing nitrogen-fixing symbiosis with legumes: How many rhizobium recipes. Trends in Microbiology. 17 (10), 458-466 (2009).
- King, H. A., Gerber, A. P. Translatome profiling: Methods for genome-scale analysis of mRNA translation. Briefings in Functional Genomics. 15 (1), 22-31 (2014).
- Chassé, H., Boulben, S., Costache, V., Cormier, P., Morales, J. Analysis of translation using polysome profiling. Nucleic Acids Research. 45 (3), 15 (2017).
- Yángüez, E., Castro-Sanz, A. B., Fernández-Bautista, N., Oliveros, J. C., Castellano, M. M. Analysis of genome-wide changes in the translatome of Arabidopsis seedlings subjected to heat stress. PloS ONE. 8 (8), 71425 (2013).
- Brown, P. O., Botstein, D. Exploring the new world of the genome with DNA microarrays. Nature Genetics. 21, 33-37 (1999).
- Krishnamurthy, A., Ferl, R. J., Paul, A. -. L. Comparing RNA-Seq and microarray gene expression data in two zones of the Arabidopsis root apex relevant to spaceflight. Applications in Plant Sciences. 6 (11), 1197 (2018).
- Shulse, C. N., et al. High-throughput single-cell transcriptome profiling of plant cell types. Cell Reports. 27 (7), 2241-2247 (2019).
- Wang, Z., Gerstein, M., Snyder, M. RNA-Seq: A revolutionary tool for transcriptomics. Nature Reviews Genetics. 10 (1), 57-63 (2009).
- Kawaguchi, R., Girke, T., Bray, E. A., Bailey-Serres, J. Differential mRNA translation contributes to gene regulation under non-stress and dehydration stress conditions in Arabidopsis thaliana. The Plant Journal. 38 (5), 823-839 (2004).
- Larsson, O., Tian, B., Sonenberg, N. Toward a genome-wide landscape of translational control. Cold Spring Harbor Perspectives in Biology. 5 (1), 012302 (2013).
- Vogel, C., Marcotte, E. M. Insights into regulation of protein abundance from proteomics and transcriptomis analyses. Nature Reviews Genetics. 13 (4), 227-232 (2013).
- Tebaldi, T., et al. Widespread uncoupling between transcriptome and translatome variations after a stimulus in mammalian cells. BMC Genomics. 13 (220), 1-15 (2012).
- Wang, T., et al. Translating mRNAs strongly correlate to proteins in a multivariate manner and their translation ratios are phenotype specific. Nucleic Acids Research. 41 (9), 4743-4754 (2013).
- Ingolia, N. T. Ribosome profiling: New views of translation, from single codons to genome scale. Nature Reviews Genetics. 15 (3), 205-213 (2014).
- Lukoszek, R., Feist, P., Ignatova, Z. Insights into the adaptive response of Arabidopsis thaliana to prolonged thermal stress by ribosomal profiling and RNA-Seq. BMC Plant Biology. 16 (1), 1-13 (2016).
- Broughton, W. J., Dilworth, M. J. Control of leghaemoglobin synthesis in snake beans. Biochemical Journal. 125 (4), 1075-1080 (1971).
- Schroeder, A., et al. The RIN: An RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7, 1-14 (2006).
- Rio, D. C., Ares, M., Hannon, G. J., Nilsen, T. W. Nondenaturing agarose gel electrophoresis of RNA nondenaturing agarose gel electrophoresis of RNA. Cold Spring Harbor Protocols. 2010 (6), 1-3 (2012).
- Ewels, P., Magnusson, M., Lundin, S., Käller, M. MultiQC: Summarize analysis results for multiple tools and samples in a single report. Bioinformatics. 32 (19), 3047-3048 (2016).
- Bolger, A. M., Lohse, M., Usadel, B. Trimmomatic: A flexible trimmer for Illumina sequence data. Bioinformatics. 30 (15), 2114-2120 (2014).
- Marcel, M. Cutadapt removes adapter sequences from high-throughput sequencing reads. EMBnet.journal. 17 (1), 10-12 (2011).
- . Sickle: A sliding-window, adaptive, quality-based trimming tool for FastQ files (Version 1.33) Available from: https://github.com/najoshi/sickle (2011)
- Langmead, B., Salzberg, S. L. Fast gapped-read alignment with Bowtie 2. Nature Methods. 9 (4), 357-359 (2012).
- Kim, D., et al. TopHat2: Accurate alignment of transcriptomes in the presence of insertions, deletions and gene fusions. Genome Biology. 14 (4), 1-13 (2013).
- Patro, R., Duggal, G., Love, M. I., Irizarry, R. A., Kingsford, C. Salmon provides fast and bias-aware quantification of transcript expression. Nature Methods. 14 (4), 417-419 (2017).
- Liao, Y., Smyth, G. K., Shi, W. featureCounts: An efficient general purpose program for assigning sequence reads to genomic features. Bioinformatics. 30 (7), 923-930 (2013).
- Robinson, M. D., McCarthy, D. J., Smyth, G. K. edgeR: A Bioconductor package for differential expression analysis of digital gene expression data. Bioinformatics. 26 (1), 139-140 (2010).
- Love, M. I., Huber, W., Anders, S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2. Genome Biology. 15 (550), 1-21 (2014).
- Ritchie, M. E., et al. limma powers differential expression analyses for RNA-sequencing and microarray studies. Nucleic Acids Research. 43 (7), 47 (2015).
- Afgan, E., et al. The Galaxy platform for accessible, reproducible and collaborative biomedical analyses: 2018 update. Nucleic Acids Research. 46, 537-544 (2018).
- Hunt, G. P., et al. GEOexplorer: A webserver for gene expression analysis and visualisation. Nucleic Acids Research. , (2022).
- Imbeaud, S., et al. Towards standardization of RNA quality assessment using user-independent classifiers of microcapillary electrophoresis traces. Nucleic Acids Research. 33 (6), 1-12 (2005).
- Di Paolo, A., et al. PDCD4 regulates axonal growth by translational repression of neurite growth-related genes and is modulated during nerve injury responses. RNA. 26 (11), 1637-1653 (2020).
- Smircich, P., et al. Ribosome profiling reveals translation control as a key mechanism generating differential gene expression in Trypanosoma cruzi. BMC Genomics. 16 (1), 443 (2015).
- Eastman, G., Sharlow, E. R., Lazo, J. S., Bloom, G. S., Sotelo-Silveira, J. R. Transcriptome and translatome regulation of pathogenesis in Alzheimer’s disease model mice. Journal of Alzheimer’s Disease. 86 (1), 365-386 (2022).
- Zanetti, M. E., Chang, I. -. F., Gong, F., Galbraith, D. W., Bailey-Serres, J. Immunopurification of polyribosomal complexes of Arabidopsis for global analysis of gene expression. Plant physiology. 138 (2), 624-635 (2005).
- Mustroph, A., et al. Profiling translatomes of discrete cell populations resolves altered cellular priorities during hypoxia in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 106 (44), 18843-11848 (2009).
- Ingolia, N. T., Ghaemmaghami, S., Newman, J. R. S., Weissman, J. S. Genome-wide analysis in vivo of translation with nucleotide resolution using ribosome profiling. Science. 324 (5924), 218-223 (2009).
- Brar, G. A., Weissman, J. S. Ribosome profiling reveals the what, when, where and how of protein synthesis. Nature Reviews. Molecular Cell Biology. 16 (11), 651-664 (2015).
- Eastman, G., Smircich, P., Sotelo-Silveira, J. R. Following ribosome footprints to understand translation at a genome wide level. Computational and Structural Biotechnology Journal. 16, 167-176 (2018).
- Westermann, A. J., Gorski, S. A., Vogel, J. Dual RNA-seq of pathogen and host. Nature Reviews Microbiology. 10 (9), 618-630 (2012).

