Imágenes en vivo de progenitores cardíacos tempranos en el embrión de ratón
Summary
Presentamos un protocolo detallado para el cultivo de embriones de ratón y la obtención de imágenes que permite obtener imágenes 3D + tiempo de células progenitoras cardíacas. Este kit de herramientas de video aborda las habilidades clave requeridas para obtener imágenes en vivo exitosas que de otro modo serían difíciles de adquirir de publicaciones de solo texto.
Abstract
Los primeros pasos del desarrollo del corazón implican cambios drásticos en el comportamiento y la diferenciación celular. Mientras que el análisis de embriones fijos permite estudiar en detalle etapas específicas del desarrollo en una instantánea fija, las imágenes en vivo capturan eventos morfogenéticos dinámicos, como la migración celular, los cambios de forma y la diferenciación, al obtener imágenes del embrión a medida que se desarrolla. Esto complementa el análisis fijo y amplía la comprensión de cómo se desarrollan los órganos durante la embriogénesis. A pesar de sus ventajas, las imágenes en vivo rara vez se utilizan en modelos de ratón debido a sus desafíos técnicos. Los embriones tempranos de ratón son sensibles cuando se cultivan ex vivo y requieren un manejo eficiente. Para facilitar un uso más amplio de imágenes en vivo en la investigación del desarrollo de ratones, este documento presenta un protocolo detallado para la microscopía viva de dos fotones que permite la adquisición a largo plazo en embriones de ratón. Además del protocolo, se proporcionan consejos sobre el manejo de embriones y la optimización del cultivo. Esto ayudará a comprender los eventos clave en la organogénesis temprana del ratón, mejorando la comprensión de la biología del progenitor cardiovascular.
Introduction
El corazón se forma temprano durante la embriogénesis para comenzar a bombear nutrientes a todo el embrión, mientras continúa desarrollándose1. En embriones de ratón, un día y medio después del inicio de la gastrulación, un órgano cardíaco rudimentario se ensambla en el polo anterior 2,3. En la etapa de Raya Temprana (ES), los progenitores cardíacos en el epiblasto ingresan a través de la raya primitiva a la capa mesodérmica naciente 4,5,6 y comienzan a migrar al polo anterior, donde se diferencian para formar el tubo cardíaco primitivo. A lo largo de este proceso, los progenitores cardíacos tempranos experimentan reordenamientos celulares, transformaciones de forma y diferenciación, además de la migración7 (Figura 1).
Los primeros progenitores cardíacos han atraído a los investigadores durante casi un siglo debido a su notable capacidad para diferenciar y construir un órgano funcional simultáneamente. En las últimas dos décadas, el análisis clonal y los modelos de knockout condicional han demostrado que el desarrollo temprano del corazón implica distintas fuentes celulares en un proceso altamente dinámico 8,9,10. Sin embargo, la estructura 3D del tubo cardíaco primitivo y la naturaleza dinámica de su morfogénesis hacen que sea difícil de estudiar (Figura 1), y estamos lejos de comprender toda su complejidad11.
Para estudiar estos procesos celulares dinámicos, los métodos de imagen en vivo ofrecen ahora un detalle sin precedentes 7,12,13,14. En el modelo de ratón, los enfoques en vivo han sido clave para interrogar temas de desarrollo que son difíciles de abordar mediante análisis estático 7,13,15. Si bien el cultivo ex vivo a largo plazo y las configuraciones robustas de microscopios avanzan rápidamente16,17, pocos investigadores tienen la experiencia para obtener imágenes exitosas de embriones vivos. Aunque las publicaciones en papel proporcionan suficientes detalles técnicos para reproducir experimentos de imágenes en vivo, algunas habilidades y trucos son difíciles de comprender sin ejemplos visuales o asistencia entre pares. Para acelerar este proceso de aprendizaje y difundir el uso de imágenes en vivo entre los laboratorios, ensamblamos un protocolo de video (Figura 2) que reúne las habilidades necesarias para realizar imágenes en vivo en embriones de ratón gastrulados.
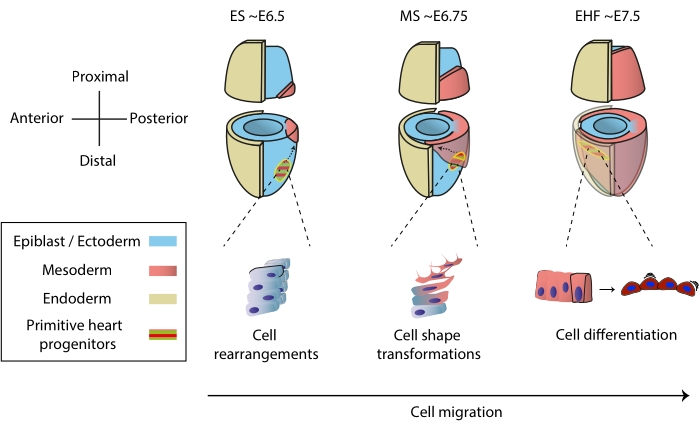
Figura 1: Diferenciación temprana de las células progenitoras cardíacas en el embrión de ratón desde el inicio de la gastrulación hasta la etapa anterior a la formación primitiva del tubo cardíaco. Las células progenitoras cardíacas ingresan al mesodermo poco después del inicio de la gastrulación, migrando al lado opuesto del embrión. La etapa morfológica y embrionaria del día (E) se escribe en la parte superior de los diagramas. Las flechas discontinuas representan la trayectoria de migración de los progenitores primitivos del tubo cardíaco durante la gastrulación. Esta figura fue adaptada de11. Abreviaturas: ES = Early Streak; MS = Racha media; EHF = Pliegue temprano de la cabeza. Haga clic aquí para ver una versión más grande de esta figura.
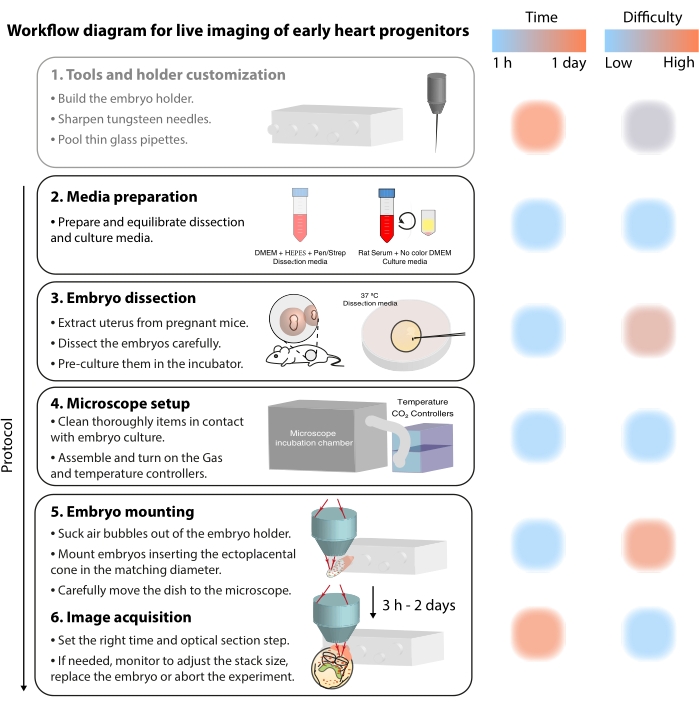
Figura 2: Diagrama de flujo de trabajo para imágenes en vivo de progenitores cardíacos tempranos. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Los primeros progenitores del corazón se organizan en un tubo cardíaco primitivo que comienza a latir mientras aún se está formando. Comprender cómo se lleva a cabo este proceso es clave para identificar el amplio espectro de defectos cardíacos congénitos a eventos morfogenéticos específicos. Para eso, las imágenes en vivo ofrecen la oportunidad de estudiar el desarrollo embrionario normal y defectuoso con una mayor resolución temporal. Esto es especialmente útil para estudiar las células progenitoras cardí…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Los autores reconocen al Dr. Kenzo Ivanovitch por su trabajo previo sobre este método y al grupo del Dr. Shigenori Nonaka (Institutos Nacionales de Ciencias Naturales, Japón) por proporcionar la experiencia inicial en el montaje de embriones. Este estudio ha contado con el apoyo de la subvención PGC2018-096486-B-I00 del Ministerio de Ciencia e Innovación y la subvención H2020-MSCA-ITN-2016-722427 del programa Horizonte 2020 de la UE a MT y la subvención 1380918 del Programa Operativo FEDER Andalucía 2014-2020 a JND. MS ha contado con el apoyo de una beca de doctorado de la Fundación La Caixa (LCF/BQ/DE18/11670014) y una beca itinerante de la Compañía de Biólogos (DEVTF181145). El CNIC cuenta con el apoyo del Ministerio de Ciencia y de la Fundación ProCNIC.
Materials
| #55 Forceps | Dumont | 11295-51 | |
| 35 mm Dish with glass coverslip bottom 14 mm Diameter | Mattek | P35G-1.5-14-C | |
| 35 mm vise table | Grandado | SKU 8798771617573 | |
| 50 mL tubes | BD Falcon | 352070 | |
| Distilled water | |||
| DMEM – Dulbecco's Modified Eagle Medium | Gibco | 11966025 | with L-Glutamine, without Glucose, without Na Pyruvate |
| Fetal Bovine Serum | Invitrogen | 10438-026 | |
| Fluorescent reporter transgenic mice (Tg(CBF:H2BVenus,+) | JAX | ||
| Fluorobrite DMEM | ThermoFisher | A1896701 | DMEM for live-cell imaging |
| High-vacuum silicone grease | Dow Corning | Z273554-1EA | |
| Holder for wires | Perlen Pressen | pwb1 | |
| LSM 780 Upright microscope | Zeiss | ||
| MaiTai Deepsee far red pulsed-laser tuned at 980 nm | Spectra-Physics | ||
| Non Descanned Detectors equipped with the filter sets cyan-yellow (BP450-500/BP520-560), green-red (BP500-520/BP570-610) and yellow-red (BP520-560/BP645-710) |
Zeiss | ||
| Obj: 20x water dipping 1.0 NA, long working distance | Zeiss | ||
| P1000 and P200 pipettes | |||
| Paraffin Oil | Nidacon | VNI0049 | |
| Penicillin-streptomycin | Invitrogen | 15070-063 | (the final concentration should be 50 μg/mL penicillin and 50 μg/mL streptomycin) |
| Petri dishes 35 mm x 10 mm | BD Falcon | 351008 | |
| Pipette tips | |||
| Polymethyl methacrylate | Reused from old laboratory equipment | ||
| Rat Serum culture embryo, male rats SPRAGUE DAWLEY RjHan SD | Janvier Labs | 9979 | |
| Set of 160 mm fines | RS PRO | 541-6933 | |
| Standard 1.0 mm glass capillaries | Anima Lab | 1B100F-3 | |
| Sterile 0.22 μm syringe filter | Corning | 431218 | |
| Sterile 5 mL syringe | Fisher Scientific | 15809152 | |
| Tungsten needles | |||
| Ultrasonic homogeniser (sonicator) | Bandelin | BASO_17021 |
References
- Tyser, R. C. V., et al. Calcium handling precedes cardiac differentiation to initiate the first heartbeat. eLife. 5, 17113 (2016).
- Kelly, R. G., Buckingham, M. E., Moorman, A. F. Heart fields and cardiac morphogenesis. Cold Spring Harbor Perspectives in Medicine. 4 (10), 015750 (2014).
- Evans, S. M., Yelon, D., Conlon, F. L., Kirby, M. L. Myocardial lineage development. Circulation Research. 107 (12), 1428-1444 (2010).
- Tam, P. P., Parameswaran, M., Kinder, S. J., Weinberger, R. P. The allocation of epiblast cells to the embryonic heart and other mesodermal lineages: the role of ingression and tissue movement during gastrulation. Development. 124 (9), 1631-1642 (1997).
- Kinder, S. J., Loebel, D. A. F., Tam, P. P. L. Allocation and early differentiation of cardiovascular progenitors in the mouse embryo. Trends in Cardiovascular Medicine. 11 (5), 177-184 (2001).
- Lawson, K. A. Fate mapping the mouse embryo. International Journal of Developmental Biology. 43 (7), 773-775 (1999).
- Ivanovitch, K., Temiño, S., Torres, M. Live imaging of heart tube development in mouse reveals alternating phases of cardiac differentiation and morphogenesis. eLife. 6, 30668 (2017).
- Meilhac, S. M., Buckingham, M. E. The deployment of cell lineages that form the mammalian heart. Nature Reviews Cardiology. 15 (11), 705-724 (2018).
- Buckingham, M., Meilhac, S., Zaffran, S. Building the mammalian heart from two sources of myocardial cells. Nature Reviews Genetics. 6 (11), 826-835 (2005).
- Meilhac, S. M., Lescroart, F., Blanpain, C. D., Buckingham, M. E. Cardiac cell lineages that form the heart. Cold Spring Harbor Perspectives in Medicine. 4 (9), 013888 (2014).
- Sendra, M., Domínguez, J. N., Torres, M., Ocaña, O. H. Dissecting the complexity of early heart progenitor cells. Journal of Cardiovascular Development and Disease. 9 (1), 5 (2022).
- McDole, K., et al. In toto imaging and reconstruction of post-implantation mouse development at the single-cell level. Cell. 175 (3), 859-876 (2018).
- Saykali, B., et al. Distinct mesoderm migration phenotypes in extra-embryonic and embryonic regions of the early mouse embryo. eLife. 8, 42434 (2019).
- Ichikawa, T., et al. Live imaging of whole mouse embryos during gastrulation: Migration analyses of epiblast and mesodermal cells. PLoS ONE. 8 (7), 64506 (2013).
- Tyser, R. C. V., et al. Single-cell transcriptomic characterization of a gastrulating human embryo. Nature. 600 (7888), 285-289 (2021).
- Aguilera-Castrejon, A., et al. Ex utero mouse embryogenesis from pre-gastrulation to late organogenesis. Nature. 593 (7857), 119-124 (2021).
- Yue, Y., et al. in toto live imaging of cardiomyocyte behaviour during mouse ventricle chamber formation at single-cell resolution. Nature Cell Biology. 22 (3), 332-340 (2020).
- Nowotschin, S., Xenopoulos, P., Schrode, N., Hadjantonakis, A. K. A bright single-cell resolution live imaging reporter of Notch signaling in the mouse. BMC Developmental Biology. 13 (1), 15 (2013).
- Cold Spring Harbor Protocols. Sharpened tungsten needles. Cold Spring Harbor Protocols. , (2012).
- Tam, P. P., Snow, M. H. The in vitro culture of primitive-streak-stage mouse embryos. Journal of Embryology and Experimental Morphology. 59, 131-143 (1980).
- Garcia, M. D., Udan, R. S., Hadjantonakis, A. K., Dickinson, M. E. Preparation of rat serum for culturing mouse embryos. Cold Spring Harbor Protocols. 2011 (4), 5593 (2011).
- Tam, P. P. L. Postimplantation mouse development: Whole embryo culture and micro- manipulation. International Journal of Developmental Biology. 42 (7), 895-902 (1998).
- Optimización de propiedades fisicoquímicas y medios de cultivo para el cultivo del embrión de ratón ex vivo. Universidad de Jaén. Biología Experimental Available from: https://hdl.handle.net/10953.1/1400 (2021)
- Behringer, R., Gertsenstein, M., Vintersen Nagy, K., Nagy, A. . Manipulating the mouse embryo: A laboratory manual, Fourth Edition. , 814 (2014).
- Shea, K., Geijsen, N. Dissection of 6.5 dpc mouse embryos. Journal of Visualized Experiments. (2), e160 (2006).
- Nonaka, S. Modification of mouse nodal flow by applying artificial flow. Methods in Cell Biology. 91, 287-297 (2009).
- Garcia, M. D., Udan, R. S., Hadjantonakis, A. K., Dickinson, M. E. Time-lapse imaging of postimplantation mouse embryos. Cold Spring Harbor Protocols. 2011 (4), 5595 (2011).
- Crainiciuc, G., et al. Behavioural immune landscapes of inflammation. Nature. 601 (7893), 415-421 (2022).

