Screeninganalyse med høyt innhold for identifisering av antistoffavhengige cellulære cytotoksisitetsmodifiserende forbindelser
Summary
Denne protokollen presenterer en automatisert, bildebasert høy gjennomstrømningsteknikk for å identifisere forbindelser som modulerer naturlig drepercellemediert brystkreftcelledreping i nærvær av et terapeutisk anti-HER-2-antistoff.
Abstract
Immunterapi med antigenspesifikke antistoffer eller immunsjekkpunkthemmere har revolusjonert behandlingen av brystkreft. Brystkreftceller som uttrykker den epidermale vekstfaktorreseptoren HER2 kan målrettes av anti-HER-2 antistoffet trastuzumab. Antistoffavhengig cellulær cytotoksisitet (ADCC) er en viktig mekanisme involvert i antitumorvirkningen av HER-2. Trastuzumab bundet til kreftceller kan gjenkjennes av Fc-reseptorene i ADCC-effektorceller (f.eks. naturlige dreperceller, makrofager og granulocytter), og utløser den cytotoksiske aktiviteten til disse immuncellene som fører til kreftcelledød. Vi satte oss fore å utvikle en bildebasert analyse for kvantifisering av ADCC for å identifisere nye ADCC-modulatorforbindelser ved screening med høyt innhold. I analysen blir HER2 overuttrykkende JIMT-1 brystkreftceller dyrket sammen med NK-92-celler i nærvær av trastuzumab, og målcelledød kvantifiseres ved automatisert mikroskopi og kvantitativ bildeanalyse. Målceller skiller seg fra effektorceller basert på deres EGFP-fluorescens. Vi viser hvordan sammensatte biblioteker kan testes i analysen for å identifisere ADCC-modulatormedikamenter. For dette formålet ble en sammensatt bibliotekstestplate satt opp ved hjelp av tilfeldig utvalgte finkjemikalier fra laboratoriehyllen. Tre mikrotubuli destabiliserende forbindelser (kolkisin, vinkristin, podofyllotoksin) som forventes å forstyrre NK-cellemigrasjon og degranulering ble også inkludert i testbiblioteket. Testskjermen identifiserte alle tre positive kontrollforbindelsene som treff som viste metodens egnethet til å identifisere ADCC-modifiserende legemidler i et kjemisk bibliotek. Med denne analysen kan sammensatte biblioteksskjermer utføres for å identifisere ADCC-forsterkende forbindelser som kan brukes som adjuvante terapeutiske midler til behandling av pasienter som får immunterapi mot kreft. I tillegg kan metoden også brukes til å identifisere eventuelle uønskede ADCC-hemmende bivirkninger av terapeutiske legemidler tatt av kreftpasienter for forskjellige indikasjoner.
Introduction
Immunterapi med antistoffer mot kreft, immunsjekkpunkthemmere eller kimære antigenreseptoruttrykkende T-celler (CAR-T) representerer en kraftig tilnærming til kreftbehandling 1,2,3. Trastuzumab er et humanisert monoklonalt anti-HER-2 (humant epidermalt vekstfaktorreseptor 2) antistoff som brukes til behandling av HER-2 positiv tidlig stadium eller metastatisk brystkreft, samt HER-2 positiv metastatisk gastrisk kreft 4,5,6. Det virker primært ved å hemme den proliferasjonsstimulerende effekten av den epidermale vekstfaktor4. Det har imidlertid blitt rapportert at trastuzumab effektivt utløser kreftcelledød selv om kreftcellene har mistet responsen på HER-2-stimulering7. Denne paradoksale effekten av antistoffet skyldes antistoffavhengig cellemediert cytotoksisitet (ADCC)7. ADCC kan medieres av naturlige dreperceller (NK), granulocytter og makrofager kollektivt kjent som effektorcellene til ADCC 8,9. Hvis et antistoff, slik som trastuzumab, binder seg til tumorceller, bruker disse effektorcellene sine Fc-reseptorer til å binde den konstante (Fc) regionen av antistoffet. Antistoffet bygger bro mellom tumorcellene og Fc-reseptorbærende effektorceller, og utløser frigjøringen av deres cytotoksiske mediatorer10. Naturlige dreperceller frigjør den cytotoksiske lasten av granulatene som inneholder perforin for å generere porer i målcellemembranen og granzyme (utløser signalveier for celledød) inn i immunsynapsen, noe som fører til apoptose av kreftcellene (se figur 1).
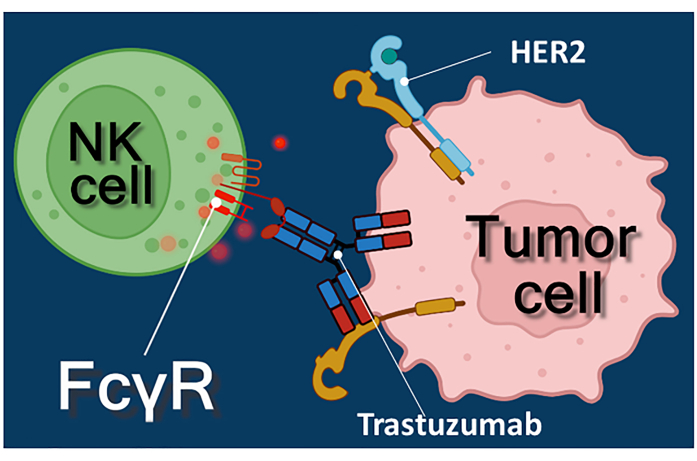
Figur 1: Effektor- og målcelleinteraksjoner i ADCC. Celleoverflaten Fcγ-reseptoren til effektoren NK-cellen gjenkjenner Fc-regionen av anti-HER2-trastuzumabantistoffet spesifikt for HER2-molekylet uttrykt på overflaten av tumorcellen. Dermed etableres den såkalte immunologiske synapsen mellom de to cellene, og induserer den rettede eksocytosen av cytotoksiske granulater i effektorcellen. De frigjorte perforin- og granzymemolekylene resulterer til slutt i apoptose av målcellen. Klikk her for å se en større versjon av denne figuren.
Flere analyser har tidligere blitt utviklet for å kvantifisere cytotoksisitet, inkludert ADCC. Gullstandarden er frigjøringsmetoden for radioaktivt krom, der målcellene er merket med radioaktiv 51Cr-isotop, og ADCC kvantifiseres ved å måle radioaktivitet fra supernatanten til lyserte målceller11. På grunn av de åpenbare problemene på grunn av den strengt regulerte håndteringen, lagringen og avhending av radioaktive legemidler og avfall, har denne metoden blitt stadig mer upopulær blant bioforskere. I tillegg er det heller ikke egnet til applikasjoner med høy gjennomstrømning. Måling av aktiviteten til enzymer (f.eks. Laktat-dehydrogenase) frigjort fra de drepte målcellene kan gi et ikke-radioaktivt alternativ til 51Cr-analysen12. Disse analysene klarer imidlertid ikke å skille mellom mål- og effektorcelledød. ECIS (Electric Cell-Substrate Impedance Sensing) viste seg å være egnet for kvantifisering av ADCC13, men ECIS-utstyret er ikke tilgjengelig i de fleste laboratorier, og teknikken er ikke kompatibel med applikasjoner med høy gjennomstrømning/screening. Fluorescerende merkede celler representerer et populært alternativ i mange cellebiologiske analyser og brukes ofte i flowcytometri eller plateleserbaserte applikasjoner14,15,16. Imidlertid inneholder disse analysene ofte vasketrinn eller er på annen måte uforenlige med applikasjoner med høy gjennomstrømning (f.eks. flowcytometribaserte teknikker). Noen populære cytotoksisitetsanalyser, som i teorien skal være egnet for ADCC-kvantifisering, klarer ikke å bestemme ADCC-effektiviteten på en påliteligmåte 13. Nylig, med spredning av fluorescerende konfokalmikroskopi, blir bildebaserte analyser med høyt innhold stadig mer populære innen ulike områder av biovitenskap17. På den ene siden er cellebildeutstyr nå ganske allestedsnærværende, mens på den annen side kan nesten uendelige morfologiske parametere samles fra de oppkjøpte bildene. Derfor satte vi oss fore å utvikle en screeningkompatibel ADCC-analyse med høyt innhold og demonstrere dens egnethet for sammensatt bibliotekscreening.
Her presenterer vi en bildebasert ADCC-analyse og demonstrerer hvordan denne analysen kan brukes til High-Content Screening (HCS) for å identifisere ADCC-modulerende forbindelser. Modellen er basert på JIMT-1 brystkarsinom målceller, CD16.176V.NK-92 effektorceller og det humaniserte monoklonale anti-HER2 antistoffet trastuzumab. Med denne metoden er det mulig å identifisere medikamenter som kan forsterke den tumordrepende virkningen av NK-celler eller å få innsikt i mekanismen bak NK-cellemediert ADCC ved å identifisere små molekyler som forstyrrer ADCC. Vi foreslår at livsforskere som tar sikte på å kvantifisere cellemediert cytotoksisitet med spesiell hensyn til ADCC, kan ha nytte av å bruke denne analysen enten for oppdagelsesvitenskap eller medisinutvikling. Denne analysen kan være et alternativ hvis et laboratorium har tilgang til og noe erfaring med fluorescerende avbildning og kvantitativ bildeanalyse.
Protocol
Representative Results
Discussion
ADCC-reaksjonen har blitt beskrevet relativt lenge siden. Sentrale molekylære hendelser i prosessen er også beskrevet19. Metoder for måling av ADCC spenner fra gullstandarden radioaktiv kromfrigjøringsanalyse, cytoplasmatiske enzymfrigjøringsanalyser til flere fluorescensbaserte flowcytometri eller mikroplateanalyser20. En vanlig begrensning av disse analysene er imidlertid at de ikke er mottagelige for applikasjoner med høy gjennomstrømning. Tidligere utviklet vi en…
Disclosures
The authors have nothing to disclose.
Acknowledgements
LV mottok finansiering fra National Research, Development and Innovation Office grants GINOP-2.3.2-15-2016-00010 TUMORDNS”, GINOP-2.3.2-15-2016-00048-STAYALIVE og OTKA K132193, K147482. CD16.176V.NK-92 celler ble hentet fra Dr. Kerry S. Campbell (Fox Chase Center, Philapedlphia, PA, på vegne av Brink Biologics, lnc. San Diego, CA), er beskyttet av patenter over hele verden, og ble lisensiert av Nantkwest, lnc. Forfatterne takker György Vereb og Árpád Szöőr for deres hjelp med bruken av NK-92-cellelinjen og for teknisk rådgivning.
Materials
| 5-fluorouracil | Applichem | A7686 | in compound library |
| 96-well Cell Carrier Ultra plate | PerkinElmer | LLC 6055302 | |
| Betulin | Sigma | B9757 | in compound library |
| CD16.176V.NK92 cells | Nankwest Inc. | ||
| Cerulenin | ChemCruz | sc-396822 | in compound library |
| Cisplatin | Santa Cruz Biotechnology | sc-200896 | in compound library |
| Colchicine | Sigma | C9754 | in compound library |
| Concanavalin-A | Calbiochem | 234567 | in compound library |
| Dexamethasone | Sigma | D4902 | in compound library |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT-1 EGFP medium |
| DMSO | Sigma | D2650 | in compound library |
| Etoposide | Sigma | E1383 | E1383 |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1 EGFP and NK medium |
| Fisetin | Sigma | F4043 | in compound library |
| Freedom EVO liquid handling robot | TECAN | ||
| Gallotannin | Fluka Chemical Corp. | 16201 | in compound library |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| Harmony software | PerkinElmer | ||
| Humanized anti-HER2 monoclonal antibody (Herzuma) | EGIS Pharmaceuticals, Budapest Hungary | N/A | |
| Humulin R (insulin) | Eli Lilly | HI0219 | JIMT-1 EGFP medium |
| IL-2 | Novartis Hungária Kft. | PHC0026 | in NK medium |
| Isatin | Sigma | 114618 | in compound library |
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Naringenin | Sigma | N5893 | in compound library |
| NQDI-1 | Sigma | SML0185 | in compound library |
| Opera Phenix High-Content Analysis equipment | PerkinElmer | ||
| Penicillin–streptomycin | Biosera | LM-A4118 | JIMT-1 EGFP and NK medium |
| Pentoxyfilline | Sigma | P1784 | in compound library |
| Phosphate buffered saline (PBS) | Lonza | BE17-517Q | to wash the cells |
| Podophyllotoxin | Sigma | P4405 | in compound library |
| Quercetin | Sigma | Q4951 | in compound library |
| Tannic acid | Sigma | T8406 | in compound library |
| Temozolomide | Sigma | T2577 | in compound library |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Vincristine sulfate | Sigma | V0400000 | in compound library |
| α-MEM | Sigma | M8042 | in NK medium |
References
- Gupta, S. L., Basu, S., Soni, V., Jaiswal, R. K. Immunotherapy: an alternative promising therapeutic approach against cancers. Molecular Biology Reports. 49 (10), 9903-9913 (2022).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Frontiers in Immunology. 13, 867013 (2022).
- June, C. H., O’Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Ross, J. S., et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 14 (4), 320-368 (2009).
- Shitara, K., et al. Discovery and development of trastuzumab deruxtecan and safety management for patients with HER2-positive gastric cancer. Gastric Cancer. 24 (4), 780-789 (2021).
- Gianni, L., et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncology. 13 (1), 25-32 (2012).
- Barok, M., et al. Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. Molecular and Cancer Therapy. 6 (7), 2065-2072 (2007).
- Gauthier, M., Laroye, C., Bensoussan, D., Boura, C., Decot, V. Natural Killer cells and monoclonal antibodies: Two partners for successful antibody dependent cytotoxicity against tumor cells. Crit Rev Oncol Hematol. 160, 103261 (2021).
- Gruijs, M., Sewnath, C. A. N., van Egmond, M. Therapeutic exploitation of neutrophils to fight cancer. Semin Immunol. 57, 101581 (2021).
- Mando, P., Rivero, S. G., Rizzo, M. M., Pinkasz, M., Levy, E. M. Targeting ADCC: A different approach to HER2 breast cancer in the immunotherapy era. Breast. 60, 15-25 (2021).
- van der Haar Avila, I., Marmol, P., Kiessling, R., Pico de Coana, Y. Evaluating antibody-dependent cell-mediated cytotoxicity by chromium release assay. Methods in Molecular Biology. 1913, 167-179 (2019).
- Broussas, M., Broyer, L., Goetsch, L. Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods in Molecular Biology. 988, 305-317 (2013).
- Toth, G., Szollosi, J., Vereb, G. Quantitating ADCC against adherent cells: Impedance-based detection is superior to release, membrane permeability, or caspase activation assays in resolving antibody dose response. Cytometry A. 91 (10), 1021-1029 (2017).
- Chung, S., Nguyen, V., Lin, Y. L., Kamen, L., Song, A. Thaw-and-use target cells pre-labeled with calcein AM for antibody-dependent cell-mediated cytotoxicity assays. Journal of Immunological Methods. 447, 37-46 (2017).
- Lee-MacAry, A. E., et al. Development of a novel flow cytometric cell-mediated cytotoxicity assay using the fluorophores PKH-26 and TO-PRO-3 iodide. Journal of Immunological Methods. 252 (1-2), 83-92 (2001).
- Tanito, K., et al. Comparative evaluation of natural killer cell-mediated cell killing assay based on the leakage of an endogenous enzyme or a pre-loaded fluorophore. Analytical Science. 37 (11), 1571-1575 (2021).
- Lin, S., Schorpp, K., Rothenaigner, I., Hadian, K. Image-based high-content screening in drug discovery. Drug Discovery Today. 25 (8), 1348-1361 (2020).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to trastuzumab-mediated ADCC. Cancer Immunology, Immunotherapy. 71 (9), 2151-2168 (2022).
- Li, F., Liu, S. Focusing on NK cells and ADCC: A promising immunotherapy approach in targeted therapy for HER2-positive breast cancer. Frontiers in Immunology. 13, 1083462 (2022).
- Perussia, B., Loza, M. J. Assays for antibody-dependent cell-mediated cytotoxicity (ADCC) and reverse ADCC (redirected cytotoxicity) in human natural killer cells. Methods in Molecular Biology. 121, 179-192 (2000).
- Garcia-Alonso, S., Ocana, A., Pandiella, A. Trastuzumab emtansine: Mechanisms of action and resistance, clinical progress, and beyond. Trends in Cancer. 6 (2), 130-146 (2020).

