Atomkraftmikroskopi Cantilever-baserad nanoindentation: Mekaniska egenskapsmätningar på nanoskala i luft och vätska
Summary
Kvantifiering av kontaktytan och kraften som appliceras av ett atomkraftmikroskop (AFM) sondspets på en provyta möjliggör mekanisk egenskapsbestämning i nanoskala. Bästa praxis för att implementera AFM cantilever-baserad nanoindentation i luft eller vätska på mjuka och hårda prover för att mäta elastisk modul eller andra nanomekaniska egenskaper diskuteras.
Abstract
Ett atomkraftmikroskop (AFM) mäter i grunden interaktionen mellan en nanoskala AFM-sondspets och provytan. Om kraften som anbringas av sondspetsen och dess kontaktyta med provet kan kvantifieras är det möjligt att bestämma de mekaniska egenskaperna i nanoskala (t.ex. elastisk eller Youngs modul) hos ytan som undersöks. En detaljerad procedur för att utföra kvantitativa AFM cantilever-baserade nanoindentationsexperiment tillhandahålls här, med representativa exempel på hur tekniken kan tillämpas för att bestämma den elastiska modulen för en mängd olika provtyper, allt från kPa till GPa. Dessa inkluderar levande mesenkymala stamceller (MSC) och kärnor i fysiologisk buffert, hartsinbäddade dehydrerade loblolly talltvärsnitt och Bakken-skiffer med varierande sammansättning.
Dessutom används AFM cantilever-baserad nanoindentation för att undersöka brottstyrkan (dvs genombrottskraften) av fosfolipid-dubbelskikt. Viktiga praktiska överväganden som metodval och utveckling, val och kalibrering av prober, identifiering av intresseområde, provheterogenitet, egenskapsstorlek och bildförhållande, spetsslitage, ytjämnhet och dataanalys och mätstatistik diskuteras för att underlätta korrekt implementering av tekniken. Slutligen demonstreras samlokalisering av AFM-härledda nanomekaniska kartor med elektronmikroskopitekniker som ger ytterligare information om elementär sammansättning.
Introduction
Att förstå de mekaniska egenskaperna hos material är en av de mest grundläggande och väsentliga uppgifterna inom teknik. För analys av bulkmaterialegenskaper finns det många metoder tillgängliga för att karakterisera de mekaniska egenskaperna hos materialsystem, inklusive dragprov1, kompressionstester2 och tre- eller fyrpunktsböjningstester (böjningstester)3. Även om dessa tester i mikroskala kan ge ovärderlig information om bulkmaterialegenskaper, utförs de i allmänhet till misslyckande och är därför destruktiva. Dessutom saknar de den rumsliga upplösning som krävs för att noggrant undersöka mikro- och nanoskalans egenskaper hos många materialsystem som är av intresse idag, såsom tunna filmer, biologiska material och nanokompositer. För att börja ta itu med några av problemen med storskalig mekanisk testning, främst dess destruktiva natur, antogs mikrohårdhetstester från mineralogi. Hårdhet är ett mått på ett materials motstånd mot plastisk deformation under specifika förhållanden. I allmänhet använder mikrohårdhetstester en styv sond, vanligtvis tillverkad av härdat stål eller diamant, för att dra in i ett material. Det resulterande fördjupningsdjupet och / eller arean kan sedan användas för att bestämma hårdheten. Flera metoder har utvecklats, inklusive Vickers4, Knoop5 och Brinell6 hårdhet; Var och en ger ett mått på materialhårdhet i mikroskala, men under olika förhållanden och definitioner, och producerar därför endast data som kan jämföras med tester som utförs under samma förhållanden.
Instrumenterad nanoindentation utvecklades för att förbättra de relativa värdena som erhållits via de olika testmetoderna för mikrohårdhet, förbättra den rumsliga upplösningen som är möjlig för analys av mekaniska egenskaper och möjliggöra analys av tunna filmer. Viktigt, genom att använda metoden som först utvecklades av Oliver och Pharr7, kan den elastiska eller Youngs modul, E, av ett provmaterial bestämmas via instrumenterad nanoindentation. Genom att använda en Berkovich tresidig pyramidal nanoindentersond (vars ideala spetsområdesfunktion matchar Vickers fyrsidiga pyramidala sond)8, kan direkt jämförelse mellan nanoskala och mer traditionella hårdhetsmätningar i mikroskala göras. Med AFM: s ökade popularitet började AFM-cantilever-baserad nanoindentation också få uppmärksamhet, särskilt för att mäta de mekaniska egenskaperna hos mjukare material. Som ett resultat, som visas schematiskt i figur 1, är de två vanligaste teknikerna idag för att undersöka och kvantifiera mekaniska egenskaper i nanoskala instrumenterad nanoindentation (figur 1A) och AFM cantilever-baserad nanoindentation (figur 1B)9, varav den senare är fokus för detta arbete.
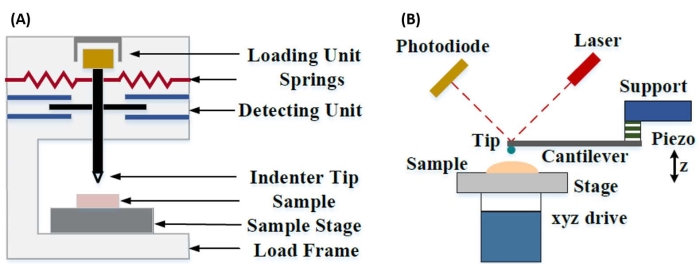
Figur 1: Jämförelse av instrumenterade och AFM-fribärande baserade nanoindentationssystem. Schematiska diagram som visar typiska system för att genomföra (A) instrumenterad nanoindentation och (B) AFM cantilever-baserad nanoindentation. Denna siffra modifierades från Qian et al.51. Förkortning: AFM = atomkraftmikroskopi. Klicka här för att se en större version av denna figur.
Både instrumenterad och AFM cantilever-baserad nanoindentation använder en styv sond för att deformera en provyta av intresse och övervaka den resulterande kraften och förskjutningen som en funktion av tiden. Vanligtvis specificeras antingen den önskade belastningen (dvs. kraft) eller (Z-piezo) förskjutningsprofilen av användaren via programvarugränssnittet och styrs direkt av instrumentet, medan den andra parametern mäts. Den mekaniska egenskapen som oftast erhålls från nanoindentationsexperiment är den elastiska modulen (E), även kallad Youngs modul, som har tryckenheter. Den elastiska modulen för ett material är en grundläggande egenskap relaterad till bindningsstyvheten och definieras som förhållandet mellan drag- eller tryckspänning (σ, den applicerade kraften per ytenhet) och axiell töjning (ε, den proportionella deformationen längs indragningsaxeln) under elastisk (dvs. reversibel eller tillfällig) deformation före början av plastisk deformation (ekvation [1]):
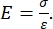 (1)
(1)
Det bör noteras att eftersom många material (särskilt biologiska vävnader) faktiskt är viskoelastiska, består den (dynamiska eller komplexa) modulen i själva verket av både elastiska (lagring, i fas) och viskösa (förlust, ur fas) komponenter. I praktiken är det som mäts i ett nanoindentationsexperiment den reducerade modulen, E *, som är relaterad till den sanna provmodulen av intresse, E, som visas i ekvation (2):
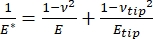 (2)
(2)
Där E-spetsen ochν-spetsen är den elastiska modulen respektive Poissons förhållande för nanoindenterspetsen, och ν är det uppskattade Poissons förhållande för provet. Poissons förhållande är det negativa förhållandet mellan den tvärgående och axiella töjningen och indikerar därmed graden av tvärgående töjning av ett prov när det utsätts för axiell töjning (t.ex. under nanoindentationsbelastning), som visas i ekvation (3):
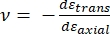 (3)
(3)
Omvandlingen från reducerad till faktisk modul är nödvändig eftersom a) en del av den axiella töjning som ges av indenterspetsen kan omvandlas till tvärgående töjning (dvs. provet kan deformeras via expansion eller sammandragning vinkelrätt mot belastningsriktningen), och b) indenterspetsen är inte oändligt hård, och därmed resulterar handlingen att dra in provet i någon (liten) mängd deformation av spetsen. Observera att i de fall där E-spetsen >> E (dvs. indenterspetsen är mycket hårdare än provet, vilket ofta är sant när man använder en diamantsond), förenklar förhållandet mellan den reducerade och faktiska provmodulen kraftigt till E ≈ E * (1 – v2). Medan instrumenterad nanoindentation är överlägsen när det gäller exakt kraftkarakterisering och dynamiskt omfång, är AFM-cantileverbaserad nanoindentation snabbare, ger storleksordningar större kraft och förskjutningskänslighet, möjliggör avbildning med högre upplösning och förbättrad indragningslokalisering och kan samtidigt undersöka magnetiska och elektriska egenskaper i nanoskala9. I synnerhet är AFM-fribärande baserad nanoindentation överlägsen för kvantifiering av mekaniska egenskaper på nanoskala av mjuka material (t.ex. polymerer, geler, lipid-dubbellager och celler eller andra biologiska material), extremt tunna (sub-μm) filmer (där substrateffekter kan spela in beroende på intrycksdjup)10,11 och suspenderade tvådimensionella (2D) material 12,13,14 såsom grafen15,16, glimmer17, hexagonal bornitrid (h-BN)18 eller övergångsmetalldikalkogenider (TMDC; t.ex. MoS2)19. Detta beror på dess utsökta kraft (sub-nN) och förskjutningskänslighet (sub-nm), vilket är viktigt för att exakt bestämma den ursprungliga kontaktpunkten och förbli inom det elastiska deformationsområdet.
Vid AFM-fribärande nanoindentation påverkas förskjutningen av en AFM-sond mot provytan av ett kalibrerat piezoelektriskt element (figur 1B), med den flexibla utskjutaren så småningom böjd på grund av den resistiva kraften som upplevs vid kontakt med provytan. Denna böjning eller avböjning av utskjutaren övervakas vanligtvis genom att reflektera en laser från baksidan av utskjutaren och in i en fotodetektor (positionskänslig detektor [PSD]). Tillsammans med kunskapen om utskjutande styvhet (i nN/nm) och avböjningskänslighet (i nm/V) är det möjligt att omvandla denna uppmätta fribärande avböjning (i V) till den kraft (i nN) som appliceras på provet. Efter kontakt ger skillnaden mellan Z-piezorörelsen och den utskjutande avböjningen provets intrycksdjup. I kombination med kunskapen om spetsområdets funktion möjliggör detta beräkning av kontaktytan för spetsprovet. Lutningen på kontaktdelarna av de resulterande kraftavstånds- eller kraftförskjutningskurvorna (F-D) kan sedan anpassas med hjälp av en lämplig kontaktmekanikmodell (se avsnittet Dataanalys i diskussionen) för att bestämma provets nanomekaniska egenskaper. Medan AFM cantilever-baserad nanoindentation har några distinkta fördelar jämfört med instrumenterad nanoindentation som beskrivits ovan, presenterar den också flera praktiska implementeringsutmaningar, såsom kalibrering, spetsslitage och dataanalys, som kommer att diskuteras här. En annan potentiell nackdel med AFM cantilever-baserad nanoindentation är antagandet om linjär elasticitet, eftersom kontaktradien och indragningsdjupet måste vara mycket mindre än indenterradien, vilket kan vara svårt att uppnå när man arbetar med AFM-sonder i nanoskala och / eller prover som uppvisar betydande ytjämnhet.
Traditionellt har nanoindentation begränsats till enskilda platser eller små rutnätindragningsexperiment, där en önskad plats (dvs. intresseområde [ROI]) väljs och ett enda kontrollerat indrag, flera indrag på en enda plats åtskilda av viss väntetid och / eller ett grovt rutnät av indrag utförs med en hastighet i storleksordningen Hz. De senaste framstegen inom AFM möjliggör emellertid samtidig förvärv av mekaniska egenskaper och topografi genom användning av höghastighetskraftkurvbaserade bildlägen (refererade till av olika handelsnamn beroende på systemtillverkaren), där kraftkurvor utförs med en kHz-hastighet under belastningskontroll, med den maximala spetsprovkraften som används som bildbörvärde. Point-and-shoot-metoder har också utvecklats, vilket möjliggör förvärv av en AFM-topografibild följt av efterföljande selektiv nanoindentation vid intressanta platser i bilden, vilket ger nanoskala rumslig kontroll över nanoindentationsplatsen. Även om det inte är det primära fokuset för detta arbete, presenteras specifika utvalda applikationsexempel på både kraftkurvbaserad avbildning och point-and-shoot cantilever-baserad nanoindentation i de representativa resultaten och kan användas tillsammans med protokollet som beskrivs nedan om det finns tillgängligt på den specifika AFM-plattformen som används. Specifikt beskriver detta arbete ett generaliserat protokoll för den praktiska implementeringen av AFM cantilever-baserad nanoindentation på alla kapabla AFM-system och ger fyra användningsfallsexempel (två i luft, två i vätska) av tekniken, inklusive representativa resultat och en djupgående diskussion om nyanser, utmaningar och viktiga överväganden för att framgångsrikt använda tekniken.
Protocol
Representative Results
Discussion
Provberedning
För nanoindentering i luft inkluderar vanliga beredningsmetoder kryosektion (t.ex. vävnadsprover), slipning och/eller polering följt av ultramikrotomering (t.ex. hartsinbäddade biologiska prover), jonfräsning eller fokuserad jonstrålberedning (t.ex. halvledar-, porösa eller blandade hårdhetsprover som inte är mottagliga för polering), mekanisk eller elektrokemisk polering (t.ex. metalllegeringar) eller tunnfilmsavsättning (t.ex. atomskikt eller kemisk ångavsättning, molekyl…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Alla AFM-experiment utfördes i Boise State University Surface Science Laboratory (SSL). SEM-karakterisering utfördes i Boise State Center for Materials Characterization (BSCMC). Forskning som rapporteras i denna publikation om råvaror för biobränsle stöddes delvis av US Department of Energy, Office of Energy Efficiency and Renewable Energy, Bioenergy Technologies Office som en del av Feedstock Conversion Interface Consortium (FCIC) och enligt DOE Idaho Operations Office Contract DE-AC07-051ID14517. Cellmekanikstudier stöddes av National Institutes of Health (USA) under bidrag AG059923, AR075803 och P20GM109095, och av National Science Foundation (USA) bidrag 1929188 och 2025505. Arbetet med modelllipiddubbelskiktssystem stöddes av National Institutes of Health (USA) under anslag R01 EY030067. Författarna tackar Dr. Elton Graugnard för att ha producerat den sammansatta bilden som visas i figur 11.
Materials
| Atomic force microscope | Bruker | Dimension Icon | Uses Nanoscope control software, including PeakForce Quantitative Nanomechanical Mapping (PF-QNM), FastForce Volume (FFV), and Point-and-Shoot Ramping experimental workspaces |
| AtomicJ | American Institute of Physics | https://doi.org/10.1063/1.4881683 | Flexible, powerful, free open source Java-based force curve analysis software package. Supports numerous contact mechanic models, such as Hertz, Sneddon DMT, JKR, Maugis, and cone or pyramid (including blunt and truncated). Also includes a variety of initial contact point estimation methods to choose from. Supports batch processing of data and subsequent statistical analysis (e.g., averages, standard deviations, histograms, goodness of fit, etc.). Literature citation is: P. Hermanowicz, M. Sarna, K. Burda, and H. Gabry , “AtomicJ: An open source software for analysis of force curves” Rev. Sci. Instrum. 85: 063703 (2014), https://doi.org/10.1063/1.4881683 , “AtomicJ: An open source software for analysis of force curves” Rev. Sci. Instrum. 85: 063703 (2014), https://doi.org/10.1063/1.4881683 |
| Buffer solution (PBS) | Fisher Chemical (NaCl), Sigma Aldrich (KCl), Fisher BioReagents (Na2HPO4 and KH2PO4) | S271 (>99% purity NaCl), P9541 (>99% purity KCl), BP332(>99% purity Na2HPO4), BP362 (>99% purity KH2PO4) | Phosphate buffered saline (PBS) was prepared in the laboratory as an aqueous solution consisting of 137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, and 1.8 mM KH2PO4 dissolved in ultrapure water. Reagents were measured out using an analytical balance, and glassware was cleaned with soap and water followed by autoclaving immediately prior to use. |
| Chloroform | |||
| Diamond tip AFM probe | Bruker | PDNISP | Pre-mounted factory-calibrated cube corner diamond (E = 1140 GPa) tip AFM probe (nominal R = 40 nm) with a stainless steel cantilever (nominal k = 225 N/m, f0 = 50 kHz). Spring constant is measured at the factory (k = 256 N/m for the probe, Serial #13435414, used here) and calibration data (including AFM images of indents showing probe geometry) is provided with the probe. |
| Diamond ultramicrotome blade | Diatome | Ultra 35° | 2.1 mm width. Also used a standard glass blade for intial rough cut of sample surface before transitioning to diamond blade for final surface preparation |
| Epoxy | Gorilla Glue | 26853-31-6 | Epoxy resin and hardner were mixed in a 1:1 ratio, a small drop was placed on a stainless steel sample puck (Ted Pella), and V1 grade muscovite mica (Ted Pella) was attached to create an atomically flat surface for preparation of phospholipid membranes. |
| Ethanol | |||
| LR white resin, medium grade (catalyzed) | Electron Microscopy Sciences | 14381 | 500 mL bottle, Lot #150629 |
| Mesenchymal stem cells (MSCs) | N/A | N/A | MSCs for nanomechanical studies were primary cells harvested from 8-10 week old male C57BL/6 mice as described in Goelzer, M. et al. "Lamin A/C Is Dispensable to Mechanical Repression of Adipogenesis" Int J Mol Sci 22: 6580 (2021) doi:10.3390/ijms22126580 and Peister, A. et al. "Adult stem cells from bone marrow (MSCs) isolated from different strains of inbred mice vary in surface epitopes, rates of proliferation, and differentiation potential" Blood 103: 1662-1668 (2004), doi:10.1182/blood-2003-09-3070. |
| Modulus standards | Bruker | PFQNM-SMPKIT-12M | Used HOPG (E = 18 GPa) and PS (E = 2.7 GPa). Also contains 2x PDMS (Tack 0, E = 2.5 MPa; Tack 4, E = 3.5 MPa), PS-LDPE (E = 2.0/0.2 GPa), fused silica (E = 72.9 GPa), sapphire (E – 345 GPa), and tip characterization (titanium roughness) sample. All samples come pre-mounted on a 12 mm diameter steel disc (sample puck). |
| Muscovite mica | Ted Pella | 50-12 | 12 mm diameter, V1 grade muscovite mica |
| Nanscope Analysis | Bruker | Version 2.0 | Free AFM image processing and analysis software package, but designed for, and proprietary/limited to Bruker AFMs; similar functionality is available from free, platform-independent AFM image processing and analysis software packages such as Gwyddion, WSxM, and others. Has built-in capabilities for force curve analysis, but AtomicJ is more flexible/full featured (e.g., more built-in contact mechanics models to choose from, statistical analysis of force curve fitting results, etc.) for force curve analysis and handles batch processing of force curves. |
| Phospholipids: POPC, Cholesterol (ovine) | Avanti Polar Lipids | POPC: CAS # 26853-31-6, Cholesterol: CAS # 57-88-5 | POPC lipid dissolved in chloroform (25 mg/mL) was obtained from vendor and used without further purification. Cholesterol powder from the same vendor was dissolved in chloroform (20 mg/mL). |
| Probe holder (fluid, lipid bilayers) | Bruker | MTFML-V2 | Specific to the particular AFM used; MTFML-V2 is a glass probe holder for scanning in fluid on a MultiMode AFM. |
| Probe holder (fluid, MSCs) | Bruker | FastScan Bio Z-scanner | Used with Dimension FastScan head (XY flexure scanners). Serial number MXYPOM5-1B154. |
| Probe holder (standard, ambient) | Bruker | DAFMCH | Specific to the particular AFM used; DAFMCH is the standard contact and tapping mode probe holder for the Dimension Icon AFM, suitable for nanoindentation (PF-QNM, FFV, and point-and-shoot ramping) |
| Sample Puck | Ted Pella | 16218 | Product number is for 15 mm diameter stainless steel sample puck. Also available in 6 mm, 10 mm, 12 mm, and 20 mm diameters at https://www.tedpella.com/AFM_html/AFM.aspx#anchor842459 |
| Sapphire substrate | Bruker | PFQNM-SMPKIT-12M | Extremely hard surface (E = 345 GPa) for measuring deflection sensitivity of probes (want all of the deflection to come from the probe, not the substrate). Part of the PF-QNM/modulus standards kit. |
| Scanning electron microscope | Hitachi | S-3400N-II | Located at Boise State. Used to perform co-localized SEM/EDS on all samples except additively manufactured (AM) Ti-6Al-4V. |
| Silicon AFM probes (standard) | NuNano | Scout 350 | Standard tapping mode silicon probe with reflective aluminum backside coating; k = 42 N/m (nominal), f0 = 350 kHz. Nominal R = 5 nm. Also available uncoated or with reflective gold backside coating. Probes with similar specifications are available from other manufacturers (e.g., Bruker TESPA-V2). |
| Silicon AFM probes (stiff) | Bruker | RTESPA-525, RTESPA-525-30 | Rotated tip etched silicon probes with reflective aluminum backside coating; k = 200 N/m (nominal), f0 = 525 kHz. Nominal R = 8 nm for RTESPA-525, R = 30 nm for RTESPA-525-30. Spring constant of each RTESPA-525-30 is measured individually at the factory via laser Doppler vibrometry and supplied with the probe. |
| Silicon carbide grit paper (abrasive discs) | Allied | 50-10005 | 120 grit |
| Silicon nitride AFM probes (soft, large radius hemispherical tip) | Bruker | MLCT-SPH-5UM, MLCT-SPH-5UM-DC | Also MLCT-SPH-1UM-DC. New product line of factory-calibrated (probe radius and spring constants of all cantilevers) large radius (R = 1 or 5 mm) hemispherical tip (at the end of a 23 mm long cylindrical shaft) probes. DC = drift compensation coating. 6 cantilevers/probe (A-F). Nominal spring constants: A, k = 0.07 N/m; B, k = 0.02 N/m; C, k = 0.01 N/m; D, k = 0.03 N/m; E, k = 0.1 N/m; F, k = 0.6 N/m. |
| Silicon nitride AFM probes (soft, medium sharp tip) | Bruker | DNP | 4 cantilevers/probe (A-d). Nominal spring constants: A, k = 0.35 N/m; B, k = 0.12 N/m; C, k = 0.24 N/m; D, k = 0.06 N/m. Nominal radii of curvature, R = 10 nm. |
| Silicon nitride AFM probes (soft, sharp tip) | Bruker | ScanAsyst-Air | Nominal values: resonance frequency, f0 = 70 kHz; spring constant, k = 0.4 N/m; radius of curvature, R = 2 nm. Designed for force curve based AFM imaging. |
| Superglue | Henkel | Loctite 495 | Cyanoacrylate based instant adhesive. Lots of roughly equivalent products are readily available. |
| Syringe pump | New Era Pump Systems | NE1000US | One channel syringe pump system with infusion and withdrawal capacity |
| Tip characterization standard | Bruker | PFQNM-SMPKIT-12M | Titanium (Ti) roughness standard. Part of the PF-QNM/modulus standards kit. |
| Ultrahigh purity nitrogen (UHP N2), 99.999% | Norco | SPG TUHPNI – T | T size compressed gas cylinder of ultrahigh purity (99.999%) nitrogen for drying samples |
| Ultramicrotome | Leica | EM UC6 | Equipped with a glass blade (standard, for intial sample preparation) and a diamond blade (for final preparation) |
| Ultrapure water | Thermo Fisher | Barnstead Nanopure Model 7146 | Model has been discontinued, but equivalent products are available. Produces ≥18.2 MΩ*cm ultrapure water with 1-5 ppb TOC (total organic content), per inline UV monitoring. Includes 0.2 µm particulate filter, ion exchange columns, and UV oxidation chamber. |
| Variable Speed Grinder | Buehler | EcoMet 3000 | Used with silicon carbide grit papers during hand polishing. |
| Vibration isolation table (active) | Herzan | TS-140 | Used with Bruker MultiMode AFM. Sits on a TMC 65-531 vibration isolation table. Bruker Dimension Icon AFM utilizes strictly passive vibration isolation (comes from manufacturer with custom acoustic hood, air table, and granite slab). |
| Vibration isolation table (passive) | TMC | 65-531 | 35" x 30" vibration isolation table with optional air damping (disabled). Used with Bruker MultiMode AFM. Herzan TS-140 "Table Stable" active vibration control table is located on top. |
References
- Hart, E. W. Theory of the tensile test. Acta Metallurgica. 15 (2), 351-355 (1967).
- Fell, J. T., Newton, J. M. Determination of tablet strength by the diametral-compression test. Journal of Pharmaceutical Sciences. 59 (5), 688-691 (1970).
- Babiak, M., Gaff, M., Sikora, A., Hysek, &. #. 3. 5. 2. ;. Modulus of elasticity in three- and four-point bending of wood. Composite Structures. 204, 454-465 (2018).
- Song, S., Yovanovich, M. M. Relative contact pressure-Dependence on surface roughness and Vickers microhardness. Journal of Thermophysics and Heat Transfer. 2 (1), 43-47 (1988).
- Hays, C., Kendall, E. G. An analysis of Knoop microhardness. Metallography. 6 (4), 275-282 (1973).
- Hill, R., Storåkers, B., Zdunek, A. B. A theoretical study of the Brinell hardness test. Proceedings of the Royal Society of London. A. Mathematical and Physical Sciences. 423 (1865), 301-330 (1989).
- Oliver, W. C., Pharr, G. M. An improved technique for determining hardness and elastic modulus using load and displacement sensing indentation experiments. Journal of Materials Research. 7 (6), 1564-1583 (1992).
- Sakharova, N. A., Fernandes, J. V., Antunes, J. M., Oliveira, M. C. Comparison between Berkovich, Vickers and conical indentation tests: A three-dimensional numerical simulation study. International Journal of Solids and Structures. 46 (5), 1095-1104 (2009).
- Cohen, S. R., Kalfon-Cohen, E. Dynamic nanoindentation by instrumented nanoindentation and force microscopy: a comparative review. Beilstein Journal of Nanotechnology. 4 (1), 815-833 (2013).
- Saha, R., Nix, W. D. Effects of the substrate on the determination of thin film mechanical properties by nanoindentation. Acta Materialia. 50 (1), 23-38 (2002).
- Tsui, T. Y., Pharr, G. M. Substrate effects on nanoindentation mechanical property measurement of soft films on hard substrates. Journal of Materials Research. 14 (1), 292-301 (1999).
- Cao, G., Gao, H. Mechanical properties characterization of two-dimensional materials via nanoindentation experiments. Progress in Materials Science. 103, 558-595 (2019).
- Castellanos-Gomez, A., Singh, V., vander Zant, H. S. J., Steele, G. A. Mechanics of freely-suspended ultrathin layered materials. Annalen der Physik. 527 (1-2), 27-44 (2015).
- Cao, C., Sun, Y., Filleter, T. Characterizing mechanical behavior of atomically thin films: A review. Journal of Materials Research. 29 (3), 338-347 (2014).
- Lee, C., Wei, X., Kysar, J. W., Hone, J. Measurement of the elastic properties and intrinsic strength of monolayer graphene. Science. 321 (5887), 385-388 (2008).
- Elibol, K., et al. Visualising the strain distribution in suspended two-dimensional materials under local deformation. Scientific Reports. 6 (1), 28485 (2016).
- Castellanos-Gomez, A., et al. Mechanical properties of freely suspended atomically thin dielectric layers of mica. Nano Research. 5 (8), 550-557 (2012).
- Song, L., et al. Large scale growth and characterization of atomic hexagonal boron nitride layers. Nano Letters. 10 (8), 3209-3215 (2010).
- Castellanos-Gomez, A., et al. Elastic properties of freely suspended MoS2 nanosheets. Advanced Materials. 24 (6), 772-775 (2012).
- D’Costa, N. P., Hoh, J. H. Calibration of optical lever sensitivity for atomic force microscopy. Review of Scientific Instruments. 66 (10), 5096-5097 (1995).
- Wu, Y., et al. Evaluation of elastic modulus and hardness of crop stalks cell walls by nano-indentation. Bioresource Technology. 101 (8), 2867-2871 (2010).
- Barns, S., et al. Investigation of red blood cell mechanical properties using AFM indentation and coarse-grained particle method. BioMedical Engineering OnLine. 16 (1), 140 (2017).
- Hermanowicz, P., Sarna, M., Burda, K., Gabryś, H. AtomicJ: An open source software for analysis of force curves. Review of Scientific Instruments. 85 (6), 063703 (2014).
- Broitman, E. Indentation hardness measurements at macro-, micro-, and nanoscale: a critical overview. Tribology Letters. 65 (1), 23 (2016).
- Tiwari, A. . Nanomechanical Analysis of High Performance Materials. , (2015).
- Aggarwal, R. L., Ramdas, A. K. . Physical Properties of Diamond and Sapphire. , (2019).
- Boyd, E. J., Uttamchandani, D. Measurement of the anisotropy of Young’s modulus in single-crystal silicon. Journal of Microelectromechanical Systems. 21 (1), 243-249 (2012).
- Harding, J. W., Sneddon, I. N. The elastic stresses produced by the indentation of the plane surface of a semi-infinite elastic solid by a rigid punch. Mathematical Proceedings of the Cambridge Philosophical Society. 41 (1), 16-26 (2008).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis-I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129 (3), 430-440 (2006).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis-II: Adhesion-influenced indentation of soft, elastic materials. Journal of Biomechanical Engineering. 129 (6), 904-912 (2007).
- Haile, S., Palmer, M., Otey, A. Potential of loblolly pine: switchgrass alley cropping for provision of biofuel feedstock. Agroforestry Systems. 90 (5), 763-771 (2016).
- Lu, X., et al. Biomass logistics analysis for large scale biofuel production: Case study of loblolly pine and switchgrass. Bioresource Technology. 183, 1-9 (2015).
- Susaeta, A., Lal, P., Alavalapati, J., Mercer, E., Carter, D. Economics of intercropping loblolly pine and switchgrass for bioenergy markets in the southeastern United States. Agroforestry Systems. 86 (2), 287-298 (2012).
- Garcia, R. Nanomechanical mapping of soft materials with the atomic force microscope: methods, theory and applications. Chemical Society Reviews. 49 (16), 5850-5884 (2020).
- Derjaguin, B. V., Muller, V. M., Toporov, Y. P. Effect of contact deformations on the adhesion of particles. Journal of Colloid and Interface Science. 53 (2), 314-326 (1975).
- Ciesielski, P. N., et al. Engineering plant cell walls: tuning lignin monomer composition for deconstructable biofuel feedstocks or resilient biomaterials. Green Chemistry. 16 (5), 2627-2635 (2014).
- Liu, K., Ostadhassan, M., Zhou, J., Gentzis, T., Rezaee, R. Nanoscale pore structure characterization of the Bakken shale in the USA. Fuel. 209, 567-578 (2017).
- Maryon, O. O., et al. Co-localizing Kelvin probe force microscopy with other microscopies and spectroscopies: selected applications in corrosion characterization of alloys. JoVE. (184), e64102 (2022).
- Eliyahu, M., Emmanuel, S., Day-Stirrat, R. J., Macaulay, C. I. Mechanical properties of organic matter in shales mapped at the nanometer scale. Marine and Petroleum Geology. 59, 294-304 (2015).
- Li, C., et al. Nanomechanical characterization of organic matter in the Bakken formation by microscopy-based method. Marine and Petroleum Geology. 96, 128-138 (2018).
- Bouzid, T., et al. The LINC complex, mechanotransduction, and mesenchymal stem cell function and fate. Journal of Biological Engineering. 13 (1), 68 (2019).
- Dupont, S., et al. Role of YAP/TAZ in mechanotransduction. Nature. 474 (7350), 179-183 (2011).
- Wang, S., et al. CCM3 is a gatekeeper in focal adhesions regulating mechanotransduction and YAP/TAZ signalling. Nature Cell Biology. 23 (7), 758-770 (2021).
- Sen, B., et al. Mechanical strain inhibits adipogenesis in mesenchymal stem cells by stimulating a durable β-catenin signal. Endocrinology. 149 (12), 6065-6075 (2008).
- Sen, B., et al. mTORC2 regulates mechanically induced cytoskeletal reorganization and lineage selection in marrow-derived mesenchymal stem cells. Journal of Bone and Mineral Research. 29 (1), 78-89 (2014).
- Sen, B., et al. Mechanically induced nuclear shuttling of β-catenin requires co-transfer of actin. Stem Cells. 40 (4), 423-434 (2022).
- Newberg, J., et al. Isolated nuclei stiffen in response to low intensity vibration. Journal of Biomechanics. 111, 110012 (2020).
- Ding, Y., Xu, G. -. K., Wang, G. -. F. On the determination of elastic moduli of cells by AFM based indentation. Scientific Reports. 7 (1), 45575 (2017).
- Khadka, N. K., Timsina, R., Rowe, E., O’Dell, M., Mainali, L. Mechanical properties of the high cholesterol-containing membrane: An AFM study. Biochimica et Biophysica Acta. Biomembranes. 1863 (8), 183625 (2021).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surface Science Reports. 61 (10), 429-444 (2006).
- Qian, L., Zhao, H. Nanoindentation of soft biological materials. Micromachines. 9 (12), 654 (2018).
- Pittenger, B., Yablon, D. Improving the accuracy of nanomechanical measurements with force-curve-based AFM techniques. Bruker Application Notes. 149, (2017).
- Vorselen, D., Kooreman, E. S., Wuite, G. J. L., Roos, W. H. Controlled tip wear on high roughness surfaces yields gradual broadening and rounding of cantilever tips. Scientific Reports. 6 (1), 36972 (2016).
- Bhaskaran, H., et al. Ultralow nanoscale wear through atom-by-atom attrition in silicon-containing diamond-like carbon. Nature Nanotechnology. 5 (3), 181-185 (2010).
- Giannazzo, F., Schilirò, E., Greco, G., Roccaforte, F. Conductive atomic force microscopy of semiconducting transition metal dichalcogenides and heterostructures. Nanomaterials. 10 (4), 803 (2020).
- Melitz, W., Shen, J., Kummel, A. C., Lee, S. Kelvin probe force microscopy and its application. Surface Science Reports. 66 (1), 1-27 (2011).
- Kazakova, O., et al. Frontiers of magnetic force microscopy. Journal of Applied Physics. 125 (6), 060901 (2019).
- Kim, H. -. J., Yoo, S. -. S., Kim, D. -. E. Nano-scale wear: A review. International Journal of Precision Engineering and Manufacturing. 13 (9), 1709-1718 (2012).
- Heath, G. R., et al. Localization atomic force microscopy. Nature. 594 (7863), 385-390 (2021).
- Strahlendorff, T., Dai, G., Bergmann, D., Tutsch, R. Tip wear and tip breakage in high-speed atomic force microscopes. Ultramicroscopy. 201, 28-37 (2019).
- Lantz, M. A., et al. Wear-resistant nanoscale silicon carbide tips for scanning probe applications. Advanced Functional Materials. 22 (8), 1639-1645 (2012).
- Khurshudov, A. G., Kato, K., Koide, H. Wear of the AFM diamond tip sliding against silicon. Wear. 203, 22-27 (1997).
- Villarrubia, J. S. Algorithms for scanned probe microscope image simulation, surface reconstruction, and tip estimation. Journal of Research of the National Institute of Standards and Technology. 102 (4), 425 (1997).
- Kain, L., et al. Calibration of colloidal probes with atomic force microscopy for micromechanical assessment. Journal of the Mechanical Behavior of Biomedical Materials. 85, 225-236 (2018).
- Slattery, A. D., Blanch, A. J., Quinton, J. S., Gibson, C. T. Accurate measurement of Atomic Force Microscope cantilever deflection excluding tip-surface contact with application to force calibration. Ultramicroscopy. 131, 46-55 (2013).
- Dobrovinskaya, E. R., Lytvynov, L. A., Pishchik, V. . Sapphire: Material, Manufacturing, Applications. , (2009).
- te Riet, J., et al. Interlaboratory round robin on cantilever calibration for AFM force spectroscopy. Ultramicroscopy. 111 (12), 1659-1669 (2011).
- Pratt, J. R., Shaw, G. A., Kumanchik, L., Burnham, N. A. Quantitative assessment of sample stiffness and sliding friction from force curves in atomic force microscopy. Journal of Applied Physics. 107 (4), 044305 (2010).
- Slattery, A. D., Blanch, A. J., Quinton, J. S., Gibson, C. T. Calibration of atomic force microscope cantilevers using standard and inverted static methods assisted by FIB-milled spatial markers. Nanotechnology. 24 (1), 015710 (2012).
- Higgins, M. J., et al. Noninvasive determination of optical lever sensitivity in atomic force microscopy. Review of Scientific Instruments. 77 (1), 013701 (2006).
- Lévy, R., Maaloum, M. Measuring the spring constant of atomic force microscope cantilevers: thermal fluctuations and other methods. Nanotechnology. 13 (1), 33-37 (2001).
- Sikora, A. Quantitative normal force measurements by means of atomic force microscopy towards the accurate and easy spring constant determination. Nanoscience and Nanometrology. 2 (1), 8-29 (2016).
- Ohler, B. Cantilever spring constant calibration using laser Doppler vibrometry. Review of Scientific Instruments. 78 (6), 063701 (2007).
- Gates, R. S., Pratt, J. R. Accurate and precise calibration of AFM cantilever spring constants using laser Doppler vibrometry. Nanotechnology. 23 (37), 375702 (2012).
- Cleveland, J. P., Manne, S., Bocek, D., Hansma, P. K. A nondestructive method for determining the spring constant of cantilevers for scanning force microscopy. Review of Scientific Instruments. 64 (2), 403-405 (1993).
- Sader, J. E., Chon, J. W. M., Mulvaney, P. Calibration of rectangular atomic force microscope cantilevers. Review of Scientific Instruments. 70 (10), 3967-3969 (1999).
- Sader, J. E., et al. Spring constant calibration of atomic force microscope cantilevers of arbitrary shape. Review of Scientific Instruments. 83 (10), 103705 (2012).
- Sader, J. E. Frequency response of cantilever beams immersed in viscous fluids with applications to the atomic force microscope. Journal of Applied Physics. 84 (1), 64-76 (1998).
- Sader, J. E., Pacifico, J., Green, C. P., Mulvaney, P. General scaling law for stiffness measurement of small bodies with applications to the atomic force microscope. Journal of Applied Physics. 97 (12), 124903 (2005).
- Mendels, D. -. A., et al. Dynamic properties of AFM cantilevers and the calibration of their spring constants. Journal of Micromechanics and Microengineering. 16 (8), 1720-1733 (2006).
- Gao, S., Brand, U. In-situ nondestructive characterization of the normal spring constant of AFM cantilevers. Measurement Science and Technology. 25 (4), 044014 (2014).
- Gibson, C. T., Watson, G. S., Myhra, S. Determination of the spring constants of probes for force microscopy/spectroscopy. Nanotechnology. 7 (3), 259-262 (1996).
- Gates, R. S., Pratt, J. R. Prototype cantilevers for SI-traceable nanonewton force calibration. Measurement Science and Technology. 17 (10), 2852-2860 (2006).
- Neumeister, J. M., Ducker, W. A. Lateral, normal, and longitudinal spring constants of atomic force microscopy cantilevers. Review of Scientific Instruments. 65 (8), 2527-2531 (1994).
- Kim, M. S., Choi, I. M., Park, Y. K., Kang, D. I. Atomic force microscope probe calibration by use of a commercial precision balance. Measurement. 40 (7), 741-745 (2007).
- Kim, M. -. S., Choi, J. -. H., Park, Y. -. K., Kim, J. -. H. Atomic force microscope cantilever calibration device for quantified force metrology at micro- or nano-scale regime: the nano force calibrator (NFC). Metrologia. 43 (5), 389-395 (2006).
- Tian, Y., et al. A novel method and system for calibrating the spring constant of atomic force microscope cantilever based on electromagnetic actuation. Review of Scientific Instruments. 89 (12), 125119 (2018).
- Clifford, C. A., Seah, M. P. The determination of atomic force microscope cantilever spring constants via dimensional methods for nanomechanical analysis. Nanotechnology. 16 (9), 1666-1680 (2005).
- Chen, B. -. Y., Yeh, M. -. K., Tai, N. -. H. Accuracy of the spring constant of atomic force microscopy cantilevers by finite element method. Analytical Chemistry. 79 (4), 1333-1338 (2007).
- Mick, U., Eichhorn, V., Wortmann, T., Diederichs, C., Fatikow, S. Combined nanorobotic AFM/SEM system as novel toolbox for automated hybrid analysis and manipulation of nanoscale objects. 2010 IEEE International Conference on Robotics and Automation. , 4088-4093 (2010).
- Kim, M. -. S., Choi, J. -. H., Kim, J. -. H., Park, Y. -. K. Accurate determination of spring constant of atomic force microscope cantilevers and comparison with other methods. Measurement. 43 (4), 520 (2010).
- Zhang, G., Wei, Z., Ferrell, R. E. Elastic modulus and hardness of muscovite and rectorite determined by nanoindentation. Applied Clay Science. 43 (2), 271-281 (2009).
- Bobko, C. P., Ortega, J. A., Ulm, F. -. J. Comment on "Elastic modulus and hardness of muscovite and rectorite determined by nanoindentation by G. Zhang, Z. Wei and R.E. Ferrell. Applied Clay Science. 46 (4), 425-428 (2009).
- Zhang, G., Wei, Z., Ferrell, R. E. Reply to the Comment on "Elastic modulus and hardness of muscovite and rectorite determined by nanoindentation" by G. Zhang, Z. Wei and R. E. Ferrell. Applied Clay Science. 46 (4), 429-432 (2009).
- Jin, D. W., et al. Thermal stability and Young’s modulus of mechanically exfoliated flexible mica. Current Applied Physics. 18 (12), 1486-1491 (2018).
- Xiao, J., et al. Anisotropic friction behaviour of highly oriented pyrolytic graphite. Carbon. 65, 53-62 (2013).
- Hertz, H. Ueber die Berührung fester elastischer Körper. Journal für die reine und angewandte Mathematik. 1882 (92), 156-171 (1882).
- Johnson, K. L., Kendall, K., Roberts, A. D., Tabor, D. Surface energy and the contact of elastic solids. Proceedings of the Royal Society of London. A. Mathematical and Physical Sciences. 324 (1558), 301-313 (1971).
- Muller, V. M., Derjaguin, B. V., Toporov, Y. P. On two methods of calculation of the force of sticking of an elastic sphere to a rigid plane. Colloids and Surfaces. 7 (3), 251-259 (1983).
- Maugis, D. Adhesion of spheres: The JKR-DMT transition using a dugdale model. Journal of Colloid and Interface Science. 150 (1), 243-269 (1992).
- Muller, V. M., Yushchenko, V. S., Derjaguin, B. V. On the influence of molecular forces on the deformation of an elastic sphere and its sticking to a rigid plane. Journal of Colloid and Interface Science. 77 (1), 91-101 (1980).
- Muller, V. M., Yushchenko, V. S., Derjaguin, B. V. General theoretical consideration of the influence of surface forces on contact deformations and the reciprocal adhesion of elastic spherical particles. Journal of Colloid and Interface Science. 92 (1), 92-101 (1983).
- Johnson, K. L., Greenwood, J. A. An adhesion map for the contact of elastic spheres. Journal of Colloid and Interface Science. 192 (2), 326-333 (1997).
- Shi, X., Zhao, Y. -. P. Comparison of various adhesion contact theories and the influence of dimensionless load parameter. Journal of Adhesion Science and Technology. 18 (1), 55-68 (2004).

