Microdissectie en Whole Mount Scanning Elektronenmicroscopie Visualisatie van muis choroïde plexus
Summary
De choroïde plexus (CP), een onderbelicht weefsel in de neurowetenschappen, speelt een sleutelrol in de gezondheid en ziekte van het centrale zenuwstelsel. Dit protocol beschrijft een microdissectietechniek voor het isoleren van de CP en het gebruik van scanning elektronenmicroscopie om een algemeen beeld te krijgen van de cellulaire structuur.
Abstract
De choroïde plexus (CP), een sterk gevasculariseerde structuur die uitsteekt in de ventrikels van de hersenen, is een van de meest onderbelichte weefsels in de neurowetenschappen. Omdat het steeds duidelijker wordt dat deze kleine structuur een cruciale rol speelt in de gezondheid en ziekte van het centrale zenuwstelsel (CZS), is het van het grootste belang om de CP uit de hersenventrikels goed te ontleden op een manier die downstream-verwerking mogelijk maakt, variërend van functionele tot structurele analyse. Hier wordt isolatie van de laterale en vierde hersenventrikel muis CP beschreven zonder de noodzaak van gespecialiseerde gereedschappen of apparatuur. Deze isolatietechniek behoudt de levensvatbaarheid, functie en structuur van cellen binnen de CP. Vanwege de hoge vascularisatie kan de CP worden gevisualiseerd zwevend in de ventriculaire holtes van de hersenen met behulp van een binoculaire microscoop. Transcardiale perfusie die nodig is voor downstream-analyse kan de identificatie van het CP-weefsel echter bemoeilijken. Afhankelijk van de verdere verwerkingsstappen (bijv. RNA- en eiwitanalyse) kan dit worden opgelost door de CP te visualiseren via transcardiale perfusie met broomfenolblauw. Na isolatie kan de CP worden verwerkt met behulp van verschillende technieken, waaronder RNA, eiwit of eencellige analyse, om meer inzicht te krijgen in de functie van deze speciale hersenstructuur. Hier wordt scanning elektronenmicroscopie (SEM) op whole mount CP gebruikt om een totaalbeeld van de structuur te krijgen.
Introduction
Strakke barrières scheiden het centrale zenuwstelsel (CZS) van de periferie, inclusief de bloed-hersenbarrière (BBB) en de bloed-hersenvocht (CSF) barrière. Deze barrières beschermen het CZS tegen externe beledigingen en zorgen voor een evenwichtige en gecontroleerde micro-omgeving 1,2,3. Hoewel de BBB in de loop van de tijd uitgebreid is bestudeerd, heeft de bloed-CSF-barrière bij de choroïde plexus (CP) het afgelopen decennium alleen maar meer onderzoeksinteresse gekregen. Deze laatste barrière is te vinden in de vier ventrikels van de hersenen (figuur 1A, B) en wordt gekenmerkt door een enkele laag vaatvliesplexusepitheelcellen (CPE) rond een centraal stroma, lekkende haarvaten, fibroblasten en een lymfoïde en myeloïde celpopulatie (figuur 1C)4,5,6. De CPE-cellen zijn stevig met elkaar verbonden door tight junctions, waardoor lekkage van de onderliggende fenestrated bloedcapillairen naar de liquor en de hersenen wordt voorkomen. Bovendien wordt het transport over de CPE-cellen gereguleerd door een aantal in- en uitgaande transportsystemen die de instroom van nuttige verbindingen (bijv. Voedingsstoffen en hormonen) van het bloed naar de liquor en de efflux van schadelijke moleculen (bijv. Metabolisch afval, overtollige neurotransmitters) in de andere richting beheren 1,6. Om hun actieve transportfunctie te kunnen uitoefenen, bevatten de CPE-cellen talrijke mitochondriën in hun cytoplasma7. Bovendien is de CP de belangrijkste bron van CSF en fungeert als de poortwachter van de hersenen door de aanwezigheid van residente ontstekingscellen1. Door zijn unieke locatie tussen het bloed en de hersenen is de CP ook perfect gepositioneerd om immuunsurveillance uit te voeren8.
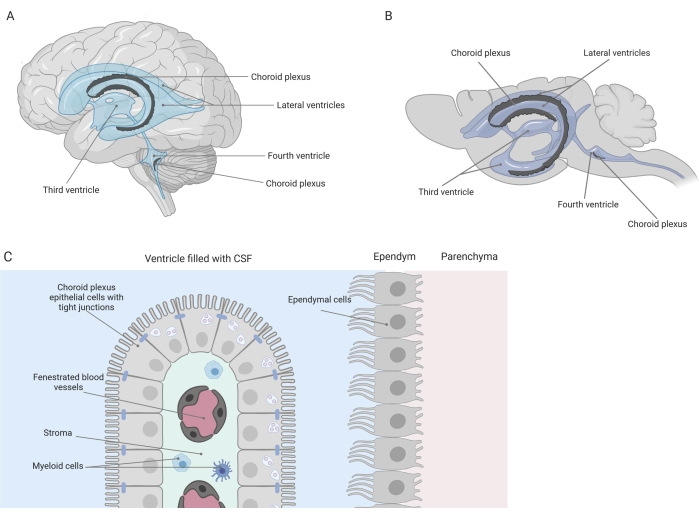
Figuur 1: Schematisch overzicht van de locatie en samenstelling van de plexus choroideus (CP). (A,B) CP-weefsel wordt gevonden in de twee laterale, de derde en de vierde ventrikels van (A) menselijke en (B) muizenhersenen. (C) Het CP-weefsel bestaat uit een enkele laag nauw verbonden kubusvormige CP-epitheel (CPE) -cellen rond fenestratieve haarvaten, los bindweefsel en lymfoïde en myeloïde cellen, en vormt de bloed-cerebrospinale vloeistofbarrière (aangepast en gewijzigd op basis van referentie23). Figuur gemaakt met Biorender.com. Klik hier om een grotere versie van deze figuur te bekijken.
In het afgelopen decennium hebben toenemende bewijzen, waaronder verschillende rapporten van onze onderzoeksgroep, aangetoond dat de CP een centrale rol speelt in gezondheid en ziekte 9,10,11,12,13,14,15,16,17,18 . Zo is bekend dat de verouderende bloed-CSF-barrière morfologische veranderingen vertoont in onder andere de kernen, microvilli en het keldermembraan 1,19. Bovendien is in de context van de ziekte van Alzheimer de algehele barrière-integriteit aangetast en al deze leeftijdsgerelateerde veranderingen lijken nog meer uitgesproken te zijn 1,8,20. Naast morfologische veranderingen zijn het transcriptoom, proteoom en secretoom van de CP veranderd tijdens ziekte 12,21,22,23. Geavanceerde kennis van de CP is dus essentieel om de rol ervan bij neurologische ziekten beter te begrijpen en mogelijk nieuwe therapeutische strategieën te ontwikkelen.
Een efficiënte methode voor nauwkeurige microdissectie van de CP uit de hersenventrikels is de eerste onschatbare stap om goed onderzoek van deze kleine hersenstructuur mogelijk te maken. Vanwege zijn sterk gevasculariseerde aard (figuur 2B) kan de CP die in de ventriculaire holtes van de hersenen zweeft, worden geïdentificeerd met behulp van een binoculaire microscoop. Transcardiale perfusie is echter vaak vereist voor downstream-analyse, wat de juiste identificatie en isolatie van het CP-weefsel bemoeilijkt (figuur 2C). Als de verdere verwerkingsstappen het toelaten (bijvoorbeeld in het geval van RNA- en eiwitanalyse), kan de CP worden gevisualiseerd via transcardiale perfusie met broomfenolblauw (figuur 2A). Verschillende publicaties beschrijven al de isolatie van de CP van rat24 en muizenpuphersenen25. Hier wordt een microdissectie-isolatietechniek beschreven om de CP te isoleren van volwassen muizen. Belangrijk is dat deze isolatietechniek de levensvatbaarheid, functie en structuur van de cellen binnen de CP behoudt. De isolatie van de CP zwevend in de vierde en laterale ventrikels wordt hier beschreven. Kortom, de muizen worden terminaal verdoofd en indien nodig transcardiaal geperfuseerd. Er moet echter worden opgemerkt dat perfusie de structuur van de cellen in de CP kan beschadigen. Als het monster moet worden geanalyseerd met behulp van transmissie-elektronenmicroscopie (TEM), seriële blokgezichtscanning elektronenmicroscopie (SBF-SEM) of gefocusseerde ionenbundel SEM (FIB-SEM), mag perfusie dus niet worden uitgevoerd. Vervolgens worden de hele hersenen geïsoleerd en wordt een tang gebruikt om de hersenen sagittaal te hemisecteren. Vanaf hier kunnen de CP’s die in de laterale ventrikels zweven worden geïdentificeerd en ontleed, terwijl de CP van de vierde ventrikel kan worden geïsoleerd van de cerebellaire kant van de hersenen.
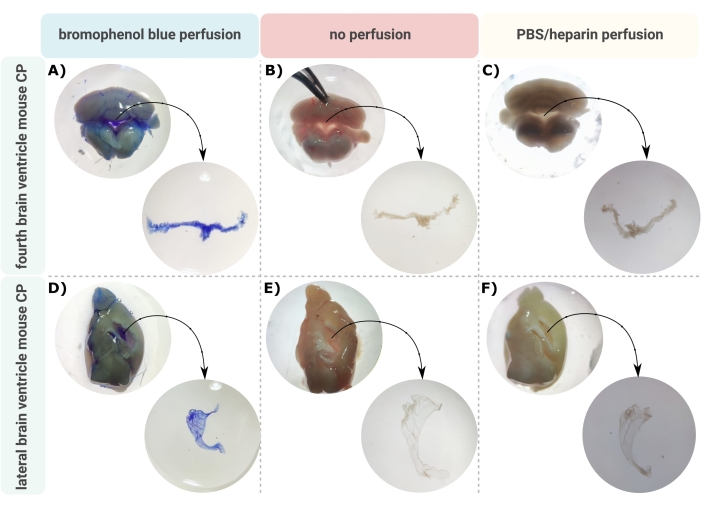
Figuur 2: Visualisatie van de (A-C) vierde en (D-F) laterale ventrikel choroïde plexus (CP) na (A,D) broomfenolblauwe perfusie, (B,E) geen perfusie en (C,F) perfusie met PBS/heparine. De beelden zijn gemaakt met een stereomicroscoop (8x-32x vergroting). Klik hier om een grotere versie van deze figuur te bekijken.
Zodra de CP goed is ontleed uit de hersenventrikels, kan een heel repertoire aan technieken worden toegepast om meer inzicht te krijgen in de functie van deze structuur. Flowcytometrie of eencellige RNA-sequencing kan bijvoorbeeld worden uitgevoerd om de infiltrerende ontstekingscellen onder bepaalde ziekteomstandigheden te kwantificeren en fenotypisch te analyseren26,27. Naast de cellulaire samenstelling kan de moleculaire samenstelling van de CP worden geanalyseerd om de aanwezigheid van cytokines en chemokines te beoordelen via enzyme-linked immunosorbent assay (ELISA), immunoblot of door gelijktijdige analyse van meerdere cytokines met behulp van de cytokine bead array28. Bovendien kunnen transcriptoom-, vasculaire, immuuncelhistologie en secretoomanalyses worden uitgevoerd op de microdissected CP-explantaten29. Hier wordt scanning elektronenmicroscopie (SEM) op whole mount CP gebruikt om een totaalbeeld van de CP-structuur te verkrijgen. SEM gebruikt een bundel van gefocuste elektronen om over het oppervlak te scannen en een beeld te creëren van de topografie en samenstelling van het oppervlak. Omdat de golflengte van elektronen veel kleiner is dan die van licht, ligt de resolutie van SEM in het nanometerbereik en superieur aan die van een lichtmicroscoop. Bijgevolg kunnen morfologische studies op subcellulair niveau worden uitgevoerd via SEM. Kortom, de ontleedde CP wordt onmiddellijk overgebracht in een glutaaraldehyde-bevattend fixatief voor een nachtelijke fixatie, gevolgd door osmicatie en uranylacetaatkleuring. De monsters worden vervolgens behandeld met loodaspartaatvlek, gedehydrateerd en uiteindelijk ingebed voor beeldvorming.
Dit protocol vergemakkelijkt dus de efficiënte isolatie van de CP van de hersenventrikels van de muis, die verder kunnen worden geanalyseerd met behulp van een verscheidenheid aan downstream-technieken om de structuur en functie ervan te onderzoeken.
Protocol
Representative Results
Discussion
Hier wordt een methode beschreven om de plexus choroideus (CP) uit de laterale ventrikel en de vierde ventrikel van een muizenbrein te isoleren. Deze hele montagemethode van de CP vergemakkelijkt verdere analyse met behulp van een repertoire van technieken om een volledig beeld te krijgen van de CP-morfologie, cellulaire samenstelling, transcriptoom, proteoom en secretoom. Dergelijke analyses zijn cruciaal om een beter begrip te krijgen van deze opmerkelijke structuur die uit de ventrikels van de hersenen steekt. Deze ke…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dit werk werd ondersteund door de Belgische Stichting voor Alzheimeronderzoek (NRK; projectnummer: 20200032), het Fonds Wetenschappelijk Onderzoek Vlaanderen (FWO Vlaanderen; projectnummers: 1268823N, 11D0520N, 1195021N) en het Fonds Baillet Latour. We danken de VIB BioImaging Core voor training, ondersteuning en toegang tot het instrumentenpark.
Materials
| 26G x 1/2 needle | Henke Sass Wolf | 4710004512 | |
| Aluminium specimen mounts | EM Sciences | 75220 | |
| Cacodylate buffer | EM Sciences | 11652 | |
| Carbon steel surgial blades | Swann-Morton | 0210 | size: 0.45 mm x 12 mm |
| Carbon adhesive tabs -12 mm | EM Sciences | 77825-12 | |
| Critical point dryer | Bal-Tec | CPD030 | |
| Crossbeam 540 | Zeiss | SEM system | |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Glutaraldehyde | EM Sciences | 16220 | |
| Heparin | Sigma-Aldrich | H-3125 | |
| Ismatec Reglo ICC Digital Peristaltic pump 2-channel | Metrohm Belgium N.V | CPA-7800160 | |
| Osmium Tetroxide | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Phosphate buffered saline (PBS) | Lonza | BE17-516F | |
| Platinum | Quorum | Q150T ES | PBS without Ca++ Mg++ or phenol red; sterile filtered |
| Sodium pentobarbital | Kela NV | 514 | |
| Specimen Basket Stainless Steel | EM Sciences | 70190-01 | |
| Stemi DV4 Stereo microscope | Zeiss | ||
| Surgical scissors | Fine Science Tools GmbH | 91460-11 |
References
- Vandenbroucke, R. E. A hidden epithelial barrier in the brain with a central role in regulating brain homeostasis. Implications for aging. Annals of the American Thoracic Society. 13, 407-410 (2016).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Engelhardt, B., Wolburg-Buchholz, K., Wolburg, H. Involvement of the choroid plexus in central nervous system inflammation. Microscopy Research and Technique. 52 (1), 112-129 (2001).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- De Bock, M., et al. A new angle on blood-CNS interfaces: a role for connexins. FEBS Letters. 588 (8), 1259-1270 (2014).
- Strazielle, N., Ghersi-Egea, J. F. Physiology of blood-brain interfaces in relation to brain disposition of small compounds and macromolecules. Molecular Pharmaceutics. 10 (5), 1473-1491 (2013).
- Redzic, Z. B., Segal, M. B. The structure of the choroid plexus and the physiology of the choroid plexus epithelium. Advanced Drug Delivery Reviews. 56 (12), 1695-1716 (2004).
- Kratzer, I., Ek, J., Stolp, H. The molecular anatomy and functions of the choroid plexus in healthy and diseased brain. Biochimica et Biophysica Acta-Biomembranes. 1862 (11), 183430 (2020).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Clinical implications of leukocyte infiltration at the choroid plexus in (neuro)inflammatory disorders. Drug Discovery Today. 20 (8), 928-941 (2015).
- Brkic, M., et al. Amyloid βoligomers disrupt blood-CSF barrier integrity by activating matrix metalloproteinases. Journal of Neuroscience. 35 (37), 12766-12778 (2015).
- Vandenbroucke, R. E., et al. Matrix metalloprotease 8-dependent extracellular matrix cleavage at the blood-CSF barrier contributes to lethality during systemic inflammatory diseases. Journal of Neuroscience. 32 (29), 9805-9816 (2012).
- Marques, F., et al. The choroid plexus response to a repeated peripheral inflammatory stimulus. BMC Neuroscience. 10, 135 (2009).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews Neuroscience. 16 (8), 445-457 (2015).
- Spector, R., Keep, R. F., Snodgrass, S. R., Smith, Q. R., Johanson, C. E. A balanced view of choroid plexus structure and function: Focus on adult humans. Experimental Neurology. 267, 78-86 (2015).
- Lehtinen, M. K., et al. The choroid plexus and cerebrospinal fluid: emerging roles in development, disease, and therapy. Journal of Neuroscience. 33 (45), 17553-17559 (2013).
- Balusu, S., Brkic, M., Libert, C., Vandenbroucke, R. E. The choroid plexus-cerebrospinal fluid interface in Alzheimer’s disease: more than just a barrier. Neural Regeneration Research. 11 (4), 534-537 (2016).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Therapeutic implications of the choroid plexus-cerebrospinal fluid interface in neuropsychiatric disorders. Brain, Behavior, and Immunity. 50, 1-13 (2015).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta-Molecular Basis of Disease. 1862 (3), 442-451 (2016).
- Serot, J. M., Zmudka, J., Jouanny, P. A possible role for CSF turnover and choroid plexus in the pathogenesis of late onset Alzheimer’s disease. Journal of Alzheimer’s Disease. 30 (1), 17-26 (2012).
- Marques, F., et al. Altered iron metabolism is part of the choroid plexus response to peripheral inflammation. Endocrinology. 150 (6), 2822-2828 (2009).
- Thouvenot, E., et al. The proteomic analysis of mouse choroid plexus secretome reveals a high protein secretion capacity of choroidal epithelial cells. Proteomics. 6 (22), 5941-5952 (2006).
- Vandendriessche, C., et al. Importance of extracellular vesicle secretion at the blood-cerebrospinal fluid interface in the pathogenesis of Alzheimer’s disease. Acta Neuropathologica Communications. 9 (1), 143 (2021).
- Bowyer, J. F., et al. A visual description of the dissection of the cerebral surface vasculature and associated meninges and the choroid plexus from rat brain. Journal of Visualized Experiments. (69), e4285 (2012).
- Inoue, T., Narita, K., Nonami, Y., Nakamura, H., Takeda, S. Observation of the ciliary movement of choroid plexus epithelial cells ex vivo. Journal of Visualized Experiments. (101), e52991 (2015).
- Dani, N., et al. A cellular and spatial map of the choroid plexus across brain ventricles and ages. Cell. 184 (11), 3056-3074 (2021).
- Carloni, S., et al. Identification of a choroid plexus vascular barrier closing during intestinal inflammation. Science. 374 (6566), 439-448 (2021).
- Van Hoecke, L., et al. Involvement of the choroid plexus in the pathogenesis of Niemann-Pick disease type. C. Frontiers in Cell Neuroscience. 15, 757482 (2021).
- Shipley, F. B., et al. Tracking calcium dynamics and immune surveillance at the choroid plexus blood-cerebrospinal fluid interface. Neuron. 108 (4), 623-639 (2020).
- Guerin, C. J., Kremer, A., Borghgraef, P., Lippens, S. Targeted studies using serial block face and focused ion beam scan electron microscopy. Journal of Visualized Experiments. (150), e59480 (2019).
- JoVE. Scanning Electron Microscopy (SEM). JoVE Science Education Database. , (2022).
- Pauwels, M., et al. Choroid plexus derived extracelular vesicles exhibit brain targeting characteristics). Biomaterials. 290, 121830 (2022).

