膜反応器における水素の製造と利用
Summary
メンブレンリアクターは、直接H2 入力なしで周囲条件での水素化を可能にします。これらのシステムでは、大気質量分析(atm-MS)とガスクロマトグラフィー質量分析(GC-MS)を使用して、これらのシステムでの水素の生成と利用を追跡できます。
Abstract
工業用水素化は、年間~11Mtの化石由来H2 ガスを消費します。私たちのグループは、水素化化学にH2 ガスを使用する必要性を回避するために膜反応器を発明しました。膜反応器は水から水素を調達し、再生可能な電力を使用して反応を駆動します。この反応器では、Pdの薄い部分が電気化学的水素製造コンパートメントを化学水素化コンパートメントから分離します。膜反応器内のPdは、(i)水素選択膜、(ii)カソード、および(iii)水素化の触媒として機能します。ここでは、大気質量分析(atm-MS)およびガスクロマトグラフィー質量分析(GC-MS)を使用して、Pd膜全体に適用される電気化学的バイアスが、膜反応器に直接H2 を投入することなく効率的な水素化を可能にすることを実証することを報告します。atm-MSでは、73%の水素透過度を測定し、GC-MSで測定した100%の選択性でプロピオフェノンをプロピルベンゼンに水素化することができました。プロトン性電解質に溶解した低濃度の出発物質に限定される従来の電気化学的水素化とは対照的に、水素生成を膜反応器での利用から物理的に分離することで、任意の溶媒または任意の濃度での水素化が可能になります。高濃度で幅広い溶媒の使用は、反応器のスケーラビリティと将来の商業化にとって特に重要です。
Introduction
熱化学的水素化反応は、すべての化学合成の~20%で使用されます1。これらの反応は、通常化石燃料、150°C〜600°Cの間の温度、および200気圧2までの圧力に由来する大量のH2ガスを必要とする。電気化学的水素化は、これらの要件を回避し、水と再生可能電力を使用して水素化反応を促進するための魅力的な方法です3。従来の電気化学的水素化のために、不飽和供給原料は電気化学セル内のプロトン性電解質に溶解される。セルに電位が印加されると、アノードで水の酸化が起こり、カソードで水素化が起こります。この反応セットアップでは、電気化学的水酸化と化学的水素化の両方が同じ反応環境で発生します。有機基質はプロトン性電解質に溶解され、原料の電気化学的水分解と水素化の両方を可能にします。これらの反応が近接していると、反応物が求核攻撃を受けやすい場合、または反応物の濃度が高すぎる(>0.25 M)場合、副生成物の形成や電極の汚れを引き起こす可能性があります4。
これらの課題により、私たちのグループは水素化反応を電気化学的に駆動する代替方法を模索するようになりました5,6,7。この探索の結果、従来から水素ガス分離に用いられているPd膜を用いた8。電気化学反応器側の水電解用電極として使用しています。パラジウム膜のこの新しいアプリケーションは、電気化学的水酸化部位を化学的水素化部位から物理的に分離することを可能にする。結果として得られる反応器構成は2つの区画を有する:1)水素製造のための電気化学的区画;2)水素化のための化学コンパートメント(図1)。陽子は、Ptアノードとカソードとしても機能するPd膜に電位を印加することによって電気化学コンパートメントで生成されます。その後、これらのプロトンはPd膜に移動し、そこで表面吸着水素原子に還元されます。電気化学区画は、このプロトン移動を促進するためのオプションの陽イオン交換膜を含むように細分化することができる。表面吸着された水素原子は、Pd fcc格子9の格子間八面体部位を透過し、水素化区画の膜の反対側の面に現れ、そこで所与の原料の不飽和結合と反応して水素化生成物7,10,11,12,13,14,15,16を形成する.したがって、膜反応器内のPdは、(i)水素選択性膜、(ii)カソード、および(iii)水素化の触媒として機能します。
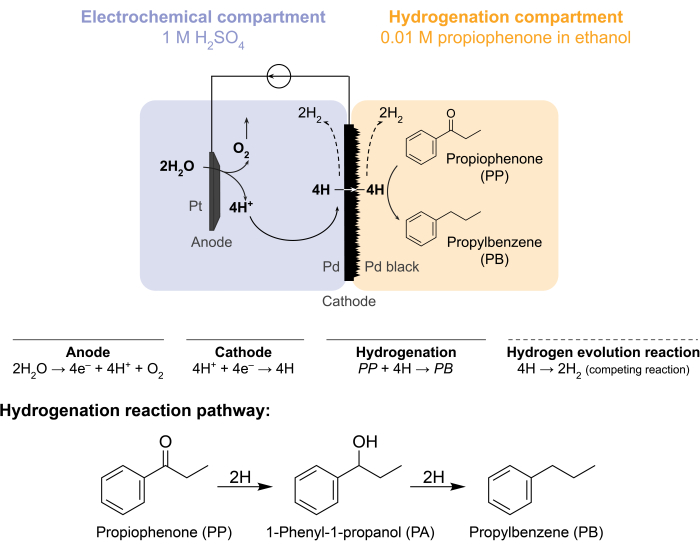
図1:メンブレンリアクターでの水素化。 アノードでの水の酸化はプロトンを生成し、それはパラジウムカソード上で還元される。HはPd膜を透過し、プロピオフェノンと反応してプロピルベンゼンを形成します。水素発生は、パラジウム膜の両側で起こり得る競合反応である。大気質量分析では、化学原料は使用されず、Hは電気化学的または水素化コンパートメントのいずれかでH2 ガスの形態で反応器を離れる必要があります。 この図の拡大版を表示するには、ここをクリックしてください。
膜反応器は、電気化学式Hセル12のアノード区画とカソード区画との間にPd膜を挟むことによって組み立てられる。耐薬品性のOリングを使用して、膜を所定の位置に固定し、漏れのないシールを確保します。膜反応器の電気化学区画は、水素に富む水溶液を含有する。この研究では、1 M H 2 SO4と、5 cm2のプラチナメッシュで包まれたPtワイヤで構成されるアノードを使用します。アノードは、電気化学区画の上部にある穴を通して電解質溶液に沈められる。化学水素化区画は、溶媒および水素化原料7、10、11、12、16、17を含有する。Hセルコンパートメントの上部にある穴は、サンプリングに使用されます。ここに示す実験では、エタノール中の0.01 Mプロピオフェノンを水素化飼料として使用します。しかしながら、出発物質(および濃度)は、実験のニーズに合わせて変化させることができる。例えば、長い炭化水素鎖およびアルキン官能基を含む出発物質をペンタンに溶解して溶解性を向上させることができる11。反応に印加される電流は、5 mA / cm 2〜300 mA / cm2です。全ての反応は周囲温度および圧力下で行われる。
大気圧質量分析(atm−MS)は、水素化区画11、12に透過する電気化学区画内の水素のパーセントを測定するために使用される。この測定は、可能な最大の水素利用率(すなわち、生成される水素のどれだけが実際に水素化反応に使用できるか)を明らかにするため、膜反応器に必要なエネルギー入力を理解するために重要です。Pd膜を通る水素透過は、電気化学的および水素化区画11、12の両方から発生するH2の量を測定することによって計算される。透過値が100%の場合、電気化学コンパートメントで生成されたすべての水素がPd膜を介して水素化コンパートメントに輸送され、その後結合して水素ガスを形成することを意味します。<100%の透過値は、水素発生が膜を透過する前に電気化学区画で起こることを意味する。H2は電気化学的または水素化区画のいずれかから生成されるので、それは器具に入りそしてH2+にイオン化される。四重極はm / z = +2のフラグメントを選択し、対応する電荷が検出器によって測定されます。この手法によって得られるプロットは、経時的なイオン電荷である。イオン電荷は最初に水素化コンパートメントについて測定され、シグナルが安定したら、チャネルが変更されて電気化学コンパートメントが測定されます。水素透過量は、水素化区画内の平均イオン電荷を反応器内で測定された総イオン電荷で割ることによって計算される(式1)11、12。水素透過を計算するために、水素化および電気化学的区画からのH2を、atm−MSを用いて別々に測定する。
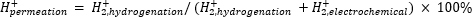 (式 1)
(式 1)
ガスクロマトグラフィー質量分析(GC−MS)は、水素化反応12、14、15、16の進行をモニターするために使用される。例のためのデータを収集するために、反応器の水素化区画はエタノール中の0.01 Mプロピオフェノンで満たされる。PtアノードとPdカソードの両端に電位を印加することにより、反応性水素が水素化区画に供給される。次に、反応性水素原子が不飽和原料を水素化し、GC-MSを使用して生成物を定量し、サンプルを断片化してイオン化します。これらの断片の質量を分析することにより、水素化溶液の組成を決定することができ、反応速度を計算できます12、14、15、16。
Protocol
Representative Results
Discussion
Pd膜は、水素透過と化学的水素化を可能にします。したがって、この膜の調製は、膜反応器の有効性にとって重要です。Pd膜のサイズ、結晶学、および表面は、実験結果を改善するために調整されています。Pd金属は任意の厚さで水素を発生させることができますが、Pd膜は25μmに圧延されます。この膜の厚さの標準化により、水素が膜を透過するのにかかる時間がすべての実験で一定になりま…
Disclosures
The authors have nothing to disclose.
Acknowledgements
カナダ自然科学工学研究評議会(RGPIN-2018-06748)、カナダイノベーション財団(229288)、カナダ高等研究所(BSE-BERL-162173)、およびカナダ研究委員長の財政的支援に感謝します。この研究は、カナダファーストリサーチエクセレンス基金、量子材料および未来技術プログラムからの資金提供のおかげで行われました。GC-MS機器およびメソッド開発を支援してくださったUBC共有機器施設のBen Herringに感謝します。この原稿の開発と編集に貢献してくれたモニカ・ストラー博士に感謝します。最後に、ブリティッシュコロンビア大学のBerlinguetteグループ全体に、膜反応器の研究における継続的な支援と協力に感謝します。
Materials
| Ag/AgCl Reference Electrode | BASi research products | MW-2021 | Reference electrode |
| Analytical Balance | Cole-Parmer | RK-11219-03 | Instrument |
| Atmospheric Mass Spectrometer | ESS CatalySys | NA | Instrument |
| Bench Power Supply | Newark | 1550 | Instrument |
| Conductive Copper Foil Electrical Tape | McMaster Carr | 76555A711 | Electrochemical cell assembly |
| Dichloromethane | Sigma Aldrich | 270997 | Reagent |
| Electric Rolling Press with Dual Micrometer | MTI Corporation | MR100A | Equipment |
| Electrochemical glass H-cell | University of British Columbia glass blowing | NA | Electrochemical cell assembly |
| ESS catalysis QUADSTAR | ESS CatalySys | NA | Software |
| Ethanol | Sigma Aldrich | 493511 | Reagent |
| Flat Rolling Mill | Pepetolls | 18700A | Equipment |
| Gas Chromatography Mass Spectrometer | Agilent | NA | Instrument |
| GC-MS vial | Agilent | 5067-0205 | Vial for GC-MS |
| Hexanes | Sigma Aldrich | 1.0706 | Reagent |
| Hydrochloric Acid | Sigma Aldrich | 258148 | Reagent |
| Hydrogen peroxide solution (30% v/v) | Sigma Aldrich | H1009 | Reagent |
| Isopropyl Alcohol | Sigma Aldrich | W292907 | Reagent |
| Masshunter Aquisition Software | Agilent | G1617FA | Software |
| Micropipette (100 µL – 1000 µL) | Gilson | F123602 | instrument |
| Micropipette (20 µL – 200 µL) | Gilson | F123601 | Instrument |
| Mitutoyo Digital Micrometer | Uline | H-2780 | Instrument |
| Muffle Furnace | MTI Corporation | KSL-1100X | Equipment |
| Nitric acid | Sigma Aldrich | 438073 | Reagent |
| Nitrogen gas | Sigma Aldrich | 608661 | Reagent |
| Palladium (II) Chloride | Sigma Aldrich | 520659 | Reagent |
| Pd wafer bar, 1 oz, 99.95% | Silver Gold Bull. | NA | Reagent |
| Platinum Auxiliary Electrode | BASi research products | MW-1032 | Anode |
| Potentiostat | Metrohm | PGSTAT302N | Instrument |
| Propiophenone | Sigma Aldrich | P51605 | Reagent |
| Proton Exchange Membrane, Nafion 212 | Fuel cell store | NA | Electrochemical cell assembly |
| Sulfuric acid | Sigma Aldrich | 258105 | Reagent |
References
- Rytter, E., Hillestad, M., Austbø, B., Lamb, J. J., Sarker, S., Lamb, J. J., Pollet, B. G. Chapter six – Thermochemical production of fuels. Hydrogen, Biomass and Bioenergy. , 89-117 (2020).
- Arpe, H. -. J. . Industrial Organic Chemistry. , (2017).
- Orella, M. J., Román-Leshkov, Y., Brushett, F. R. Emerging opportunities for electrochemical processing to enable sustainable chemical manufacturing. Current Opinion in Chemical Engineering. 20, 159-167 (2018).
- May, A. S., Biddinger, E. J. Strategies to control electrochemical hydrogenation and hydrogenolysis of furfural and minimize undesired side reactions. ACS Catalysis. 10 (5), 3212-3221 (2020).
- Tang, B. Y., Bisbey, R. P., Lodaya, K. M., Toh, W. L., Surendranath, Y. Reaction environment impacts charge transfer but not chemical reaction steps in hydrogen evolution catalysis. ChemRxiv. , (2022).
- Iwakura, C., Yoshida, Y., Inoue, H. A new hydrogenation system of 4-methylstyrene using a palladinized palladium sheet electrode. Journal of Electroanalytical Chemistry. 431 (1), 43-45 (1997).
- Inoue, H., Abe, T., Iwakura, C. Successive hydrogenation of styrene at a palladium sheet electrode combined with electrochemical supply of hydrogen. Chemical Communications. , 55-56 (1996).
- Conde, J. J., Maroño, M., Sánchez-Hervás, J. M. Pd-based membranes for hydrogen separation: Review of alloying elements and their influence on membrane properties. Separation and Purification Reviews. 46 (2), 152-177 (2017).
- Wicke, E., Brodowsky, H., Züchner, H., Alefeld, G., VÖlkl, J. Hydrogen in palladium and palladium alloys. Hydrogen in Metals II. Topics in Applied Physics., edited by Alefeld, G., Völkl, J. 29, (1978).
- Sato, T., Sato, S., Itoh, N. Using a hydrogen-permeable palladium membrane electrode to produce hydrogen from water and hydrogenate toluene. International Journal Hydrogen Energy. 41 (12), 5419-5427 (2016).
- Sherbo, R. S., Delima, R. S., Chiykowski, V. A., MacLeod, B. P., Berlinguette, C. P. Complete electron economy by pairing electrolysis with hydrogenation. Nature Catalysis. 1, 501-507 (2018).
- Sherbo, R. S., Kurimoto, A., Brown, C. M., Berlinguette, C. P. Efficient electrocatalytic hydrogenation with a palladium membrane reactor. Journal of American Chemical Society. 141 (19), 7815-7821 (2019).
- Kurimoto, A., Sherbo, R. S., Cao, Y., Loo, N. W. X., Berlinguette, C. P. Electrolytic deuteration of unsaturated bonds without using D2. Nature Catalysis. 3, 719-726 (2020).
- Jansonius, R. P., et al. Hydrogenation without H2 using a palladium membrane flow cell. Cell Reports Physical Science. 1 (7), 100105 (2020).
- Huang, A., et al. Electrolysis can be used to resolve hydrogenation pathways at palladium surfaces in a membrane reactor. Journal of American Chemical Society Au. 1 (3), 336-343 (2021).
- Delima, R. S., et al. Selective hydrogenation of furfural using a membrane reactor. Energy and Environmental Science. 15 (1), 215-224 (2021).
- Sato, T., Takada, A., Itoh, N. Low-temperature hydrogenation of toluene by electrolysis of water with hydrogen permeable palladium membrane electrode. Chemistry Letters. 46 (4), 477-480 (2017).
- Maoka, T., Enyo, M. Overpotential decay transients and the reaction mechanism on the Pd-H2 electrode. Surface Technology. 8 (5), 441-450 (1979).
- Kurimoto, A., et al. Physical separation of H2 activation from hydrogenation chemistry reveals the specific role of secondary metal catalysts. Angewandte Chemie International Edition. 60 (21), 11937-11942 (2021).

