멤브레인 반응기에서의 수소 생산 및 활용
Summary
멤브레인 반응기는 직접H2 입력 없이 주변 조건에서 수소화를 가능하게 합니다. 대기 질량 분석법(atm-MS) 및 가스 크로마토그래피 질량 분석법(GC-MS)을 사용하여 이러한 시스템에서 수소 생산 및 활용을 추적할 수 있습니다.
Abstract
산업용 수소화는 매년 ~11Mt의 화석 유래 H2 가스를 소비합니다. 우리 그룹은 수소화 화학을 위해 H2 가스를 사용할 필요성을 우회하기 위해 멤브레인 반응기를 발명했습니다. 멤브레인 반응기는 물에서 수소를 공급하고 재생 가능한 전기를 사용하여 반응을 유도합니다. 이 반응기에서 얇은 Pd 조각은 전기화학적 수소 생산 구획과 화학적 수소화 구획을 분리합니다. 멤브레인 반응기 내의 Pd는 (i) 수소 선택성 멤브레인, (ii) 음극 및 (iii) 수소화 촉매 역할을 한다. 여기에서 우리는 대기 질량 분석법(atm-MS) 및 가스 크로마토그래피 질량 분석법(GC-MS)의 사용을 보고하여 Pd 멤브레인에 적용된 전기화학적 바이어스가 멤브레인 반응기에서 직접H2 입력 없이 효율적인 수소화를 가능하게 한다는 것을 입증합니다. atm-MS를 사용하여 73%의 수소 투과를 측정하여 GC-MS로 측정한 바와 같이 100% 선택성으로 프로피오페논을 프로필벤젠으로 수소화할 수 있었습니다. 양성자성 전해질에 용해된 낮은 농도의 출발 물질로 제한되는 기존의 전기화학적 수소화와 달리, 멤브레인 반응기에서의 이용으로부터 수소 생산의 물리적 분리는 모든 용매 또는 모든 농도에서 수소화를 가능하게 합니다. 고농도 및 광범위한 용매의 사용은 반응기 확장성 및 향후 상용화에 특히 중요합니다.
Introduction
열화학적 수소화 반응은 모든 화학 합성의 ~20%에서 사용됩니다1. 이러한 반응에는 일반적으로 화석 연료에서 파생되는 다량의 H 2 가스, 150 ° C에서 600 ° C 사이의 온도 및 최대 200 atm2의 압력이 필요합니다. 전기화학적 수소화는 이러한 요구 사항을 우회하고 물과 재생 가능한 전기를 사용하여 수소화 반응을 유도하는 매력적인 방법입니다3. 종래의 전기화학적 수소화의 경우, 불포화 공급원료는 전기화학 전지 내의 양성자성 전해질에 용해된다. 전지에 전위가 가해지면 양극에서는 물 산화가 발생하고 음극에서는 수소화가 발생합니다. 이 반응 설정에서는 전기화학적 물 산화와 화학적 수소화가 모두 동일한 반응 환경에서 발생합니다. 유기 기질은 양성자성 전해질에 용해되어 공급 원료의 전기 화학적 물 분해 및 수소화를 가능하게합니다. 이러한 반응의 근접성은 반응물이 친핵성 공격에 취약하거나 반응물 농도가 너무 높을 경우(>0.25M)4 부산물 형성 및 전극 오염을 유발할 수 있습니다.
이러한 도전으로 인해 우리 그룹은 수소화 반응 5,6,7을 전기 화학적으로 유도하는 대체 방법을 모색하게되었습니다. 이러한 검색 결과, 종래 수소 가스 분리에 사용되는 Pd 멤브레인(Pd)이 사용되었다8. 전기화학 반응기 측의 물 전기분해를 위한 전극으로 사용합니다. 팔라듐 멤브레인의 이러한 새로운 적용은 화학적 수소화 부위에서 전기화학적 물 산화 부위의 물리적 분리를 가능하게 합니다. 생성 된 반응기 구성은 2 개의 구획을 갖는다 : 1) 수소 생산을위한 전기 화학 구획; 2) 수소화 반응을 위한 화학적 구획(그림 1). 양성자는 Pt 양극과 음극 역할도 하는 Pd 멤브레인에 전위를 가하여 전기화학적 구획에서 생성됩니다. 그런 다음 이 양성자는 Pd 막으로 이동하여 표면에 흡착된 수소 원자로 환원됩니다. 전기화학적 구획은 이러한 양성자 이동을 용이하게 하기 위해 선택적인 양이온 교환막을 포함하도록 세분될 수 있다. 표면 흡착된 수소 원자는 Pd fcc 격자(9)의 틈새 팔면체 부위를 통해 투과되고 수소화 격실에서 멤브레인의 반대면에 나타나며, 여기서 주어진 공급 원료의 불포화 결합과 반응하여 수소화 생성물 7,10,11,12,13,14,15,16을 형성합니다. 따라서 멤브레인 반응기의 Pd는 (i) 수소 선택성 멤브레인, (ii) 음극 및 (iii) 수소화 촉매 역할을 합니다.
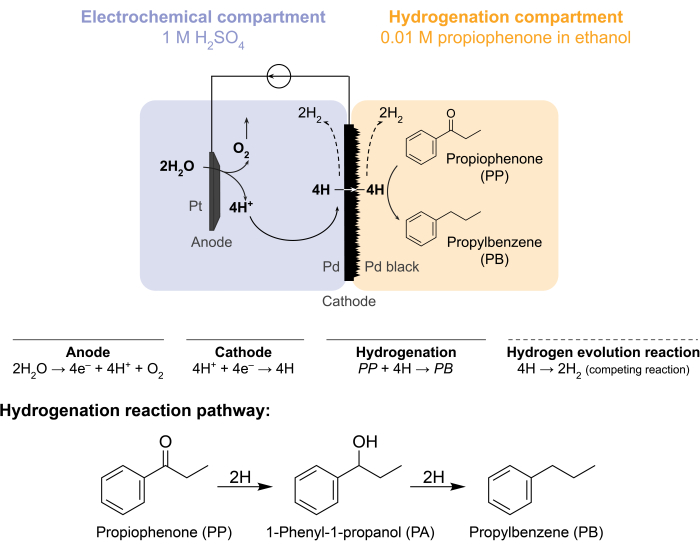
그림 1: 멤브레인 반응기에서의 수소화 반응. 양극에서의 물 산화는 양성자를 생성하며, 이는 팔라듐 음극에서 환원됩니다. H는 Pd 막을 통해 투과하고 프로피오페논과 반응하여 프로필벤젠을 형성합니다. 수소 발생은 팔라듐 막의 양쪽에서 발생할 수 있는 경쟁 반응입니다. 대기 질량 분석법의 경우, 화학 공급 원료가 사용되지 않으므로 H가 H2 가스 형태로 반응기를 전기 화학 또는 수소화 구획에 남겨 둘 필요가 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
멤브레인 반응기는 전기화학적 H-전지(12)의 애노드와 캐소드 격실 사이에 Pd 멤브레인을 끼우고 조립된다. 내화학성 O-링은 멤브레인을 제자리에 고정하고 누출 없는 밀봉을 보장하는 데 사용됩니다. 멤브레인 반응기의 전기화학적 구획에는 수소가 풍부한 수용액이 포함되어 있습니다. 본 연구에서는 1 MH2SO4 및 5 cm2 백금 메쉬 조각으로 둘러싸인 Pt 와이어로 구성된 양극을 사용합니다. 양극은 전기화학적 구획의 상부에 있는 구멍을 통해 전해질 용액에 잠겨 있습니다. 화학적 수소화 구획은 용매 및 수소화 공급 원료 7,10,11,12,16,17을 함유한다. H 셀 구획 상단의 구멍은 샘플링에 사용됩니다. 여기에 표시된 실험은 수소화 사료로 에탄올에 0.01M 프로피오페논을 사용합니다. 그러나, 출발 물질(및 농도)은 실험 요구에 맞게 변화될 수 있다. 예를 들어, 긴 탄화수소 사슬 및 알킨 작용기를 함유하는 출발 물질은 용해도를 향상시키기 위해 펜탄에 용해될 수 있다(11). 반응에 인가된 전류는 5mA/cm2 내지 300mA/cm2 사이일 수 있다. 모든 반응은 상온 및 압력 하에서 수행된다.
대기 질량 분광법(atm-MS)은 수소화 격실(11, 12)로 투과하는 전기화학적 격실에서 수소의 백분율을 측정하기 위해 사용된다. 이 측정은 가능한 최대 수소 이용(즉, 생산되는 수소의 양이 실제로 수소화 반응에 사용될 수 있음)을 나타내기 때문에 멤브레인 반응기에 필요한 에너지 입력을 이해하는 데 중요합니다. Pd 막을 통한 수소 투과는 전기화학적 및 수소화 구획 둘 다로부터 진화하는 H2의 양을 측정함으로써 계산된다(11, 12). 100%의 투과 값은 전기화학적 격실에서 생성된 모든 수소가 Pd 막을 통해 수소화 격실로 운반된 다음 결합하여 수소 가스를 형성한다는 것을 의미합니다. <100%의 투과 값은 멤브레인을 통해 투과되기 전에 전기화학적 구획에서 수소 발생이 발생함을 의미합니다. H 2 는 전기 화학 또는 수소화 구획에서 생성되므로 기기에 들어가 H2 +로 이온화됩니다. 사중극자는 m/z = +2의 단편을 선택하고 해당 전하가 검출기에 의해 측정됩니다. 이 기술로 얻은 플롯은 시간 경과에 따른 이온 전하입니다. 수소화 구획에 대한 이온 전하를 먼저 측정하고 신호가 안정화되면 채널을 변경하여 전기 화학 구획을 측정합니다. 수소 투과는 수소화 구획의 평균 이온 전하를 반응기에서 측정된 총 이온 전하로 나누어 계산합니다(방정식 1)11,12. 수소 투과를 계산하기 위해, 수소화 및 전기화학적 구획으로부터의H2를 atm-MS를 사용하여 별도로 측정한다.
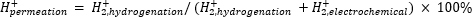 (식 1)
(식 1)
가스 크로마토그래피 질량 분광분석법(GC-MS)은 수소화 반응12,14,15,16의 진행을 모니터링하기 위해 사용된다. 예를 들어, 반응기의 수소화 구획은 에탄올 중 0.01M 프로피오페논으로 채워진다. Pt 양극과 Pd 음극에 전위를 가하면 반응성 수소가 수소화 구획에 공급됩니다. 그런 다음 반응성 수소 원자는 불포화 공급 원료를 수소화하고 GC-MS를 사용하여 생성물을 정량화하여 샘플이 단편화되고 이온화됩니다. 이들 단편의 질량을 분석함으로써, 수소화 용액의 조성이 결정될 수 있고, 반응 속도가 계산될 수 있다12,14,15,16.
Protocol
Representative Results
Discussion
Pd 멤브레인은 수소 투과 및 화학적 수소화를 가능하게 합니다. 따라서이 멤브레인의 제조는 멤브레인 반응기의 효능에 중요합니다. Pd 멤브레인 크기, 결정학 및 표면은 실험 결과를 개선하기 위해 조정됩니다. Pd 금속은 어떤 두께에서도 수소를 방출할 수 있지만 Pd 멤브레인은 25μm로 압연됩니다. 이러한 멤브레인 두께의 표준화는 수소가 멤브레인을 통해 투과하는 데 걸리는 시간이 모든 실험에?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
캐나다 자연 과학 및 공학 연구 위원회(RGPIN-2018-06748), 캐나다 혁신 재단(229288), 캐나다 고등 연구 연구소(BSE-BERL-162173) 및 재정 지원을 해주신 캐나다 연구 위원장에 감사드립니다. 이 연구는 부분적으로 Canada First Research Excellence Fund, Quantum Materials and Future Technologies Program의 자금 지원 덕분에 수행되었습니다. GC-MS 기기 및 분석법 개발에 도움을 주신 UBC Shared Instrument Facility의 Ben Herring에게 감사드립니다. 이 원고의 개발과 편집에 기여한 Monika Stolar 박사에게 감사드립니다. 마지막으로, 멤브레인 반응기 연구에 대한 지속적인 지원과 협력에 대해 브리티시 컬럼비아 대학교의 전체 Berlinguette Group에 감사드립니다.
Materials
| Ag/AgCl Reference Electrode | BASi research products | MW-2021 | Reference electrode |
| Analytical Balance | Cole-Parmer | RK-11219-03 | Instrument |
| Atmospheric Mass Spectrometer | ESS CatalySys | NA | Instrument |
| Bench Power Supply | Newark | 1550 | Instrument |
| Conductive Copper Foil Electrical Tape | McMaster Carr | 76555A711 | Electrochemical cell assembly |
| Dichloromethane | Sigma Aldrich | 270997 | Reagent |
| Electric Rolling Press with Dual Micrometer | MTI Corporation | MR100A | Equipment |
| Electrochemical glass H-cell | University of British Columbia glass blowing | NA | Electrochemical cell assembly |
| ESS catalysis QUADSTAR | ESS CatalySys | NA | Software |
| Ethanol | Sigma Aldrich | 493511 | Reagent |
| Flat Rolling Mill | Pepetolls | 18700A | Equipment |
| Gas Chromatography Mass Spectrometer | Agilent | NA | Instrument |
| GC-MS vial | Agilent | 5067-0205 | Vial for GC-MS |
| Hexanes | Sigma Aldrich | 1.0706 | Reagent |
| Hydrochloric Acid | Sigma Aldrich | 258148 | Reagent |
| Hydrogen peroxide solution (30% v/v) | Sigma Aldrich | H1009 | Reagent |
| Isopropyl Alcohol | Sigma Aldrich | W292907 | Reagent |
| Masshunter Aquisition Software | Agilent | G1617FA | Software |
| Micropipette (100 µL – 1000 µL) | Gilson | F123602 | instrument |
| Micropipette (20 µL – 200 µL) | Gilson | F123601 | Instrument |
| Mitutoyo Digital Micrometer | Uline | H-2780 | Instrument |
| Muffle Furnace | MTI Corporation | KSL-1100X | Equipment |
| Nitric acid | Sigma Aldrich | 438073 | Reagent |
| Nitrogen gas | Sigma Aldrich | 608661 | Reagent |
| Palladium (II) Chloride | Sigma Aldrich | 520659 | Reagent |
| Pd wafer bar, 1 oz, 99.95% | Silver Gold Bull. | NA | Reagent |
| Platinum Auxiliary Electrode | BASi research products | MW-1032 | Anode |
| Potentiostat | Metrohm | PGSTAT302N | Instrument |
| Propiophenone | Sigma Aldrich | P51605 | Reagent |
| Proton Exchange Membrane, Nafion 212 | Fuel cell store | NA | Electrochemical cell assembly |
| Sulfuric acid | Sigma Aldrich | 258105 | Reagent |
References
- Rytter, E., Hillestad, M., Austbø, B., Lamb, J. J., Sarker, S., Lamb, J. J., Pollet, B. G. Chapter six – Thermochemical production of fuels. Hydrogen, Biomass and Bioenergy. , 89-117 (2020).
- Arpe, H. -. J. . Industrial Organic Chemistry. , (2017).
- Orella, M. J., Román-Leshkov, Y., Brushett, F. R. Emerging opportunities for electrochemical processing to enable sustainable chemical manufacturing. Current Opinion in Chemical Engineering. 20, 159-167 (2018).
- May, A. S., Biddinger, E. J. Strategies to control electrochemical hydrogenation and hydrogenolysis of furfural and minimize undesired side reactions. ACS Catalysis. 10 (5), 3212-3221 (2020).
- Tang, B. Y., Bisbey, R. P., Lodaya, K. M., Toh, W. L., Surendranath, Y. Reaction environment impacts charge transfer but not chemical reaction steps in hydrogen evolution catalysis. ChemRxiv. , (2022).
- Iwakura, C., Yoshida, Y., Inoue, H. A new hydrogenation system of 4-methylstyrene using a palladinized palladium sheet electrode. Journal of Electroanalytical Chemistry. 431 (1), 43-45 (1997).
- Inoue, H., Abe, T., Iwakura, C. Successive hydrogenation of styrene at a palladium sheet electrode combined with electrochemical supply of hydrogen. Chemical Communications. , 55-56 (1996).
- Conde, J. J., Maroño, M., Sánchez-Hervás, J. M. Pd-based membranes for hydrogen separation: Review of alloying elements and their influence on membrane properties. Separation and Purification Reviews. 46 (2), 152-177 (2017).
- Wicke, E., Brodowsky, H., Züchner, H., Alefeld, G., VÖlkl, J. Hydrogen in palladium and palladium alloys. Hydrogen in Metals II. Topics in Applied Physics., edited by Alefeld, G., Völkl, J. 29, (1978).
- Sato, T., Sato, S., Itoh, N. Using a hydrogen-permeable palladium membrane electrode to produce hydrogen from water and hydrogenate toluene. International Journal Hydrogen Energy. 41 (12), 5419-5427 (2016).
- Sherbo, R. S., Delima, R. S., Chiykowski, V. A., MacLeod, B. P., Berlinguette, C. P. Complete electron economy by pairing electrolysis with hydrogenation. Nature Catalysis. 1, 501-507 (2018).
- Sherbo, R. S., Kurimoto, A., Brown, C. M., Berlinguette, C. P. Efficient electrocatalytic hydrogenation with a palladium membrane reactor. Journal of American Chemical Society. 141 (19), 7815-7821 (2019).
- Kurimoto, A., Sherbo, R. S., Cao, Y., Loo, N. W. X., Berlinguette, C. P. Electrolytic deuteration of unsaturated bonds without using D2. Nature Catalysis. 3, 719-726 (2020).
- Jansonius, R. P., et al. Hydrogenation without H2 using a palladium membrane flow cell. Cell Reports Physical Science. 1 (7), 100105 (2020).
- Huang, A., et al. Electrolysis can be used to resolve hydrogenation pathways at palladium surfaces in a membrane reactor. Journal of American Chemical Society Au. 1 (3), 336-343 (2021).
- Delima, R. S., et al. Selective hydrogenation of furfural using a membrane reactor. Energy and Environmental Science. 15 (1), 215-224 (2021).
- Sato, T., Takada, A., Itoh, N. Low-temperature hydrogenation of toluene by electrolysis of water with hydrogen permeable palladium membrane electrode. Chemistry Letters. 46 (4), 477-480 (2017).
- Maoka, T., Enyo, M. Overpotential decay transients and the reaction mechanism on the Pd-H2 electrode. Surface Technology. 8 (5), 441-450 (1979).
- Kurimoto, A., et al. Physical separation of H2 activation from hydrogenation chemistry reveals the specific role of secondary metal catalysts. Angewandte Chemie International Edition. 60 (21), 11937-11942 (2021).

