Vätgasproduktion och användning i en membranreaktor
Summary
Membranreaktorer möjliggör hydrogenering i omgivande förhållanden utan direktH2-ingång . Vi kan spåra väteproduktionen och användningen i dessa system med hjälp av atmosfärisk masspektrometri (atm-MS) och gaskromatografi masspektrometri (GC-MS).
Abstract
Industriell hydrogenering förbrukar ~ 11 Mt fossil-härleddH2-gas årligen. Vår grupp uppfann en membranreaktor för att kringgå behovet av att användaH2-gas för hydrogeneringskemi. Membranreaktorn hämtar väte från vatten och driver reaktioner med förnybar el. I denna reaktor separerar en tunn bit Pd ett elektrokemiskt väteproduktionsfack från ett kemiskt hydrogeneringsfack. Pd i membranreaktorn fungerar som (i) ett väteselektivt membran, (ii) en katod och (iii) en katalysator för hydrogenering. Här rapporterar vi användningen av atmosfärisk masspektrometri (atm-MS) och gaskromatografimasspektrometri (GC-MS) för att visa att en applicerad elektrokemisk bias över ett Pd-membran möjliggör effektiv hydrogenering utan direktH2-ingång i en membranreaktor. Med atm-MS mätte vi en vätegenomträngning på 73%, vilket möjliggjorde hydrogenering av propiofenon till propylbensen med 100% selektivitet, mätt med GC-MS. Till skillnad från konventionell elektrokemisk hydrogenering, som är begränsad till låga koncentrationer av utgångsmaterial upplöst i en protisk elektrolyt, möjliggör den fysiska separationen av väteproduktion från användning i membranreaktorn hydrogenering i vilket lösningsmedel som helst eller vid vilken koncentration som helst. Användningen av höga koncentrationer och ett brett spektrum av lösningsmedel är särskilt viktigt för reaktorns skalbarhet och framtida kommersialisering.
Introduction
Termokemiska hydrogeneringsreaktioner används i ~ 20% av all kemisk syntes1. Dessa reaktioner kräver stora mängderH2-gas , som vanligtvis härrör från fossila bränslen, temperaturer mellan 150 °C och 600 °C och tryck upp till 200 atm2. Elektrokemisk hydrogenering är ett tilltalande sätt att kringgå dessa krav och att driva hydrogeneringsreaktioner med vatten och förnybar el3. För konventionell elektrokemisk hydrogenering löses en omättad råvara i en protisk elektrolyt i en elektrokemisk cell. När en potential appliceras på cellen sker vattenoxidation vid anoden, medan hydrogenering sker vid katoden. I denna reaktionsinställning sker både elektrokemisk vattenoxidation och kemisk hydrogenering i samma reaktionsmiljö. Det organiska substratet löses i en protisk elektrolyt för att möjliggöra både elektrokemisk vattenspjälkning och hydrogenering av råmaterialet. Närheten till dessa reaktioner kan leda till biproduktbildning och elektrodnedsmutsning när reaktanten är mottaglig för nukleofil attack eller om reaktantkoncentrationen är för hög (>0,25 M)4.
Dessa utmaningar fick vår grupp att utforska alternativa sätt att elektrokemiskt driva hydrogeneringsreaktioner 5,6,7. Denna sökning resulterade i användningen av ett Pd-membran, som konventionellt används vid vätgasseparation8. Vi använder den som elektrod för vattenelektrolys på den elektrokemiska reaktorsidan. Denna nya tillämpning av ett palladiummembran möjliggör fysisk separation av platsen för elektrokemisk vattenoxidation från platsen för kemisk hydrogenering. Den resulterande reaktorkonfigurationen har två fack: 1) ett elektrokemiskt fack för väteproduktion; och 2) en kemisk avdelning för hydrogenering (figur 1). Protoner genereras i det elektrokemiska facket genom att applicera en potential över Pt-anoden och Pd-membranet, som också fungerar som katoden. Dessa protoner migrerar sedan till Pd-membranet, där de reduceras till ytadsorberade väteatomer. Det elektrokemiska facket kan delas upp för att inkludera ett valfritt katjonbytesmembran för att underlätta denna protonmigration. De ytadsorberade väteatomerna tränger igenom de interstitiella oktaedriska platserna i Pd fcc-gitteret9 och dyker upp på motsatt sida av membranet i hydrogeneringsfacket, där de reagerar med de omättade bindningarna hos en given råvara för att bilda hydrerade produkter 7,10,11,12,13,14,15,16. Pd i membranreaktorn fungerar därför som (i) ett väteselektivt membran, (ii) en katod och (iii) en katalysator för hydrogenering.
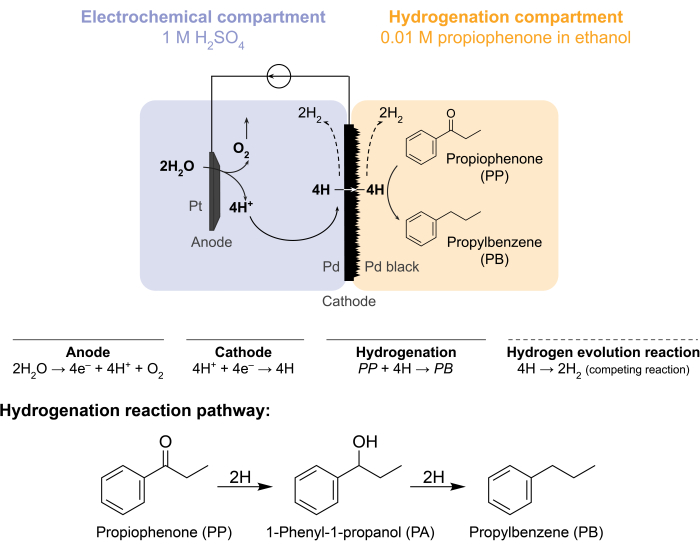
Figur 1: Hydrogenering i en membranreaktor. Vattenoxidation vid anoden producerar protoner, vilka reduceras på palladiumkatoden. H tränger igenom Pd-membranet och reagerar med propiofenon för att bilda propylbensen. Väteutveckling är en konkurrerande reaktion som kan inträffa på vardera sidan av palladiummembranet. För atmosfärisk masspektrometri används ingen kemisk råvara, vilket kräver att H lämnar reaktorn i form avH2-gas i antingen elektrokemiska utrymmen eller hydrogeneringsutrymmen. Klicka här för att se en större version av denna figur.
Membranreaktorn monteras genom att ett Pd-membran kläms in mellan anod- och katodfacken i en elektrokemisk H-cell12. Kemikaliebeständiga O-ringar används för att säkra membranet på plats och säkerställa en läckagefri tätning. Membranreaktorns elektrokemiska fack innehåller en väterik vattenhaltig lösning. I denna studie använder vi 1 M H 2SO4 och en anod som består av en Pt-tråd innesluten i ett 5 cm2stycke platinanät. Anoden är nedsänkt i elektrolytlösningen genom ett hål i toppen av det elektrokemiska facket. Det kemiska hydrogeneringsfacket innehåller ett lösningsmedel och hydrogeneringsråvara 7,10,11,12,16,17. Hålet på toppen av H-cellfacket används för provtagning. Experimenten som visas här använder 0,01 M propiofenon i etanol som hydrogeneringsmatning. Utgångsmaterialet (och koncentrationen) kan dock varieras för att passa experimentella behov. Till exempel kan ett utgångsmaterial som innehåller en lång kolvätekedja och en alkynfunktionell grupp lösas i pentan för att förbättra lösligheten11. Den applicerade strömmen för reaktionen kan vara mellan 5 mA / cm 2 och 300 mA / cm2. Alla reaktioner utförs under omgivningstemperatur och tryck.
Atmosfärisk masspektrometri (atm-MS) används för att mäta procentandelen väte i det elektrokemiska facket som tränger igenom hydrogeneringsfacket11,12. Denna mätning är viktig för att förstå den energitillförsel som krävs för membranreaktorn, eftersom den avslöjar det maximala möjliga väteutnyttjandet (dvs. hur mycket av vätet som produceras faktiskt kan användas för hydrogeneringsreaktioner). Vätegenomträngning genom Pd-membranet beräknas genom att mäta mängden H2 som utvecklas från både elektrokemiska och hydrogeneringsfack11,12. Ett genomträngningsvärde på 100% innebär att allt väte som produceras i det elektrokemiska facket transporteras genom Pd-membranet till hydrogeneringsfacket och sedan kombineras för att bilda vätgas. Ett genomträngningsvärde på <100% innebär att väteutveckling sker i det elektrokemiska facket innan det tränger igenom membranet. EftersomH2 produceras från antingen det elektrokemiska eller hydrogeneringsfacket kommer det in i instrumentet och joniseras tillH2+. Kvadrupolen väljer fragment av m / z = +2, och motsvarande laddning mäts av detektorn. Diagrammet erhållet med denna teknik är jonladdningen över tiden. Den joniska laddningen mäts först för hydrogeneringsfacket, och när signalen stabiliseras ändras kanalerna för att mäta det elektrokemiska facket. Vätegenomträngning beräknas genom att dividera den genomsnittliga jonladdningen i hydrogeneringsutrymmet med den totala jonladdningen uppmätt i reaktorn (ekvation 1)11,12. För att beräkna vätegenomträngning mätsH2 från hydrogenering och elektrokemiska fack separat med användning av atm-MS.
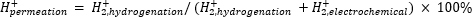 (Ekv. 1)
(Ekv. 1)
Gaskromatografi masspektrometri (GC-MS) används för att övervaka utvecklingen av hydrogeneringsreaktionen12,14,15,16. För att samla in data för exemplet fylls reaktorns hydrogeneringsfack med 0,01 M propiofenon i etanol. Genom att applicera en potential över Pt-anoden och Pd-katoden tillförs reaktivt väte till hydrogeneringsfacket. De reaktiva väteatomerna hydrerar sedan det omättade råmaterialet och produkterna kvantifieras med GC-MS, där provet fragmenteras och joniseras. Genom att analysera massan av dessa fragment kan hydrogeneringslösningens sammansättning bestämmas och reaktionshastigheterna kan beräknas12,14,15,16.
Protocol
Representative Results
Discussion
Pd-membranet möjliggör vätegenomträngning och kemisk hydrogenering. Beredningen av detta membran är därför viktig för membranreaktorns effektivitet. Pd-membranstorleken, kristallografin och ytan är inställda för att förbättra experimentresultaten. Även om Pd-metall kan utveckla väte vid vilken tjocklek som helst, rullas Pd-membranen till 25 μm. Denna standardisering av membrantjockleken säkerställer att den tid det tar för väte att tränga igenom membranet är konstant för alla experiment. Dessutom, …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi är tacksamma för Canadian Natural Sciences and Engineering Research Council (RGPIN-2018-06748), Canadian Foundation for Innovation (229288), Canadian Institute for Advanced Research (BSE-BERL-162173) och Canada Research Chairs för ekonomiskt stöd. Denna forskning genomfördes delvis tack vare finansiering från Canada First Research Excellence Fund, Quantum Materials and Future Technologies Program. Vi tackar Ben Herring på UBC Shared Instrument Facility för hjälp med GC-MS-instrumentet och metodutveckling. Vi tackar Dr. Monika Stolar för bidrag till utvecklingen och redigeringen av detta manuskript. Slutligen tackar vi hela Berlinguette-gruppen vid University of British Columbia för deras fortsatta stöd och samarbete i studien av membranreaktorn.
Materials
| Ag/AgCl Reference Electrode | BASi research products | MW-2021 | Reference electrode |
| Analytical Balance | Cole-Parmer | RK-11219-03 | Instrument |
| Atmospheric Mass Spectrometer | ESS CatalySys | NA | Instrument |
| Bench Power Supply | Newark | 1550 | Instrument |
| Conductive Copper Foil Electrical Tape | McMaster Carr | 76555A711 | Electrochemical cell assembly |
| Dichloromethane | Sigma Aldrich | 270997 | Reagent |
| Electric Rolling Press with Dual Micrometer | MTI Corporation | MR100A | Equipment |
| Electrochemical glass H-cell | University of British Columbia glass blowing | NA | Electrochemical cell assembly |
| ESS catalysis QUADSTAR | ESS CatalySys | NA | Software |
| Ethanol | Sigma Aldrich | 493511 | Reagent |
| Flat Rolling Mill | Pepetolls | 18700A | Equipment |
| Gas Chromatography Mass Spectrometer | Agilent | NA | Instrument |
| GC-MS vial | Agilent | 5067-0205 | Vial for GC-MS |
| Hexanes | Sigma Aldrich | 1.0706 | Reagent |
| Hydrochloric Acid | Sigma Aldrich | 258148 | Reagent |
| Hydrogen peroxide solution (30% v/v) | Sigma Aldrich | H1009 | Reagent |
| Isopropyl Alcohol | Sigma Aldrich | W292907 | Reagent |
| Masshunter Aquisition Software | Agilent | G1617FA | Software |
| Micropipette (100 µL – 1000 µL) | Gilson | F123602 | instrument |
| Micropipette (20 µL – 200 µL) | Gilson | F123601 | Instrument |
| Mitutoyo Digital Micrometer | Uline | H-2780 | Instrument |
| Muffle Furnace | MTI Corporation | KSL-1100X | Equipment |
| Nitric acid | Sigma Aldrich | 438073 | Reagent |
| Nitrogen gas | Sigma Aldrich | 608661 | Reagent |
| Palladium (II) Chloride | Sigma Aldrich | 520659 | Reagent |
| Pd wafer bar, 1 oz, 99.95% | Silver Gold Bull. | NA | Reagent |
| Platinum Auxiliary Electrode | BASi research products | MW-1032 | Anode |
| Potentiostat | Metrohm | PGSTAT302N | Instrument |
| Propiophenone | Sigma Aldrich | P51605 | Reagent |
| Proton Exchange Membrane, Nafion 212 | Fuel cell store | NA | Electrochemical cell assembly |
| Sulfuric acid | Sigma Aldrich | 258105 | Reagent |
References
- Rytter, E., Hillestad, M., Austbø, B., Lamb, J. J., Sarker, S., Lamb, J. J., Pollet, B. G. Chapter six – Thermochemical production of fuels. Hydrogen, Biomass and Bioenergy. , 89-117 (2020).
- Arpe, H. -. J. . Industrial Organic Chemistry. , (2017).
- Orella, M. J., Román-Leshkov, Y., Brushett, F. R. Emerging opportunities for electrochemical processing to enable sustainable chemical manufacturing. Current Opinion in Chemical Engineering. 20, 159-167 (2018).
- May, A. S., Biddinger, E. J. Strategies to control electrochemical hydrogenation and hydrogenolysis of furfural and minimize undesired side reactions. ACS Catalysis. 10 (5), 3212-3221 (2020).
- Tang, B. Y., Bisbey, R. P., Lodaya, K. M., Toh, W. L., Surendranath, Y. Reaction environment impacts charge transfer but not chemical reaction steps in hydrogen evolution catalysis. ChemRxiv. , (2022).
- Iwakura, C., Yoshida, Y., Inoue, H. A new hydrogenation system of 4-methylstyrene using a palladinized palladium sheet electrode. Journal of Electroanalytical Chemistry. 431 (1), 43-45 (1997).
- Inoue, H., Abe, T., Iwakura, C. Successive hydrogenation of styrene at a palladium sheet electrode combined with electrochemical supply of hydrogen. Chemical Communications. , 55-56 (1996).
- Conde, J. J., Maroño, M., Sánchez-Hervás, J. M. Pd-based membranes for hydrogen separation: Review of alloying elements and their influence on membrane properties. Separation and Purification Reviews. 46 (2), 152-177 (2017).
- Wicke, E., Brodowsky, H., Züchner, H., Alefeld, G., VÖlkl, J. Hydrogen in palladium and palladium alloys. Hydrogen in Metals II. Topics in Applied Physics., edited by Alefeld, G., Völkl, J. 29, (1978).
- Sato, T., Sato, S., Itoh, N. Using a hydrogen-permeable palladium membrane electrode to produce hydrogen from water and hydrogenate toluene. International Journal Hydrogen Energy. 41 (12), 5419-5427 (2016).
- Sherbo, R. S., Delima, R. S., Chiykowski, V. A., MacLeod, B. P., Berlinguette, C. P. Complete electron economy by pairing electrolysis with hydrogenation. Nature Catalysis. 1, 501-507 (2018).
- Sherbo, R. S., Kurimoto, A., Brown, C. M., Berlinguette, C. P. Efficient electrocatalytic hydrogenation with a palladium membrane reactor. Journal of American Chemical Society. 141 (19), 7815-7821 (2019).
- Kurimoto, A., Sherbo, R. S., Cao, Y., Loo, N. W. X., Berlinguette, C. P. Electrolytic deuteration of unsaturated bonds without using D2. Nature Catalysis. 3, 719-726 (2020).
- Jansonius, R. P., et al. Hydrogenation without H2 using a palladium membrane flow cell. Cell Reports Physical Science. 1 (7), 100105 (2020).
- Huang, A., et al. Electrolysis can be used to resolve hydrogenation pathways at palladium surfaces in a membrane reactor. Journal of American Chemical Society Au. 1 (3), 336-343 (2021).
- Delima, R. S., et al. Selective hydrogenation of furfural using a membrane reactor. Energy and Environmental Science. 15 (1), 215-224 (2021).
- Sato, T., Takada, A., Itoh, N. Low-temperature hydrogenation of toluene by electrolysis of water with hydrogen permeable palladium membrane electrode. Chemistry Letters. 46 (4), 477-480 (2017).
- Maoka, T., Enyo, M. Overpotential decay transients and the reaction mechanism on the Pd-H2 electrode. Surface Technology. 8 (5), 441-450 (1979).
- Kurimoto, A., et al. Physical separation of H2 activation from hydrogenation chemistry reveals the specific role of secondary metal catalysts. Angewandte Chemie International Edition. 60 (21), 11937-11942 (2021).

