Modelado realista de membranas utilizando mezclas lipídicas complejas en estudios de simulación
Summary
La diversidad lipídica de la membrana en estructura y composición es un importante contribuyente a los procesos celulares y puede ser un marcador de enfermedad. Las simulaciones de dinámica molecular nos permiten estudiar las membranas y sus interacciones con biomoléculas a resolución atomística. Aquí, proporcionamos un protocolo para construir, ejecutar y analizar sistemas de membranas complejos.
Abstract
Los lípidos son componentes estructurales de las membranas celulares; Las especies de lípidos varían entre los orgánulos celulares y entre los organismos. Esta variedad da como resultado diferentes propiedades mecánicas y estructurales en la membrana que impactan directamente en las moléculas y procesos que ocurren en esta interfaz. La composición lipídica es dinámica y puede servir para modular los procesos de señalización celular. Los enfoques computacionales se utilizan cada vez más para predecir las interacciones entre biomoléculas y proporcionar información molecular a los observables experimentales. La dinámica molecular (MD) es una técnica basada en la mecánica estadística que predice el movimiento de los átomos en función de las fuerzas que actúan sobre ellos. Las simulaciones de MD se pueden utilizar para caracterizar la interacción de biomoléculas. Aquí, presentamos brevemente la técnica, describimos los pasos prácticos para principiantes que estén interesados en simular bicapas lipídicas, demostramos el protocolo con un software amigable para principiantes y discutimos alternativas, desafíos y consideraciones importantes del proceso. En particular, enfatizamos la relevancia del uso de mezclas lipídicas complejas para modelar una membrana celular de interés para capturar los entornos hidrofóbicos y mecánicos apropiados en la simulación. También discutimos algunos ejemplos en los que la composición y las propiedades de la membrana modulan las interacciones de las bicapas con otras biomoléculas.
Introduction
Los lípidos son los principales constituyentes de las membranas, que proporcionan límites para las células y permiten la compartimentación intracelular 1,2,3. Los lípidos son anfifílicos, con un grupo de cabeza polar y dos colas de ácidos grasos hidrofóbicos; Estos se autoensamblan en una bicapa para minimizar el contacto de las cadenas hidrofóbicas con el agua 3,4. Varias combinaciones de grupos de cabezas hidrofílicas y colas hidrofóbicas dan como resultado diferentes clases de lípidos en las membranas biológicas, como glicerofosfolípidos, esfingolípidos y esteroles (Figura 1)1,5,6. Los glicerofosfolípidos son componentes primarios de las membranas celulares eucariotas compuestas de glicerofosfato, ácidos grasos de cadena larga y grupos principales de bajo peso molecular7. La nomenclatura lipídica se basa en las diferencias en los grupos de cabeza; algunos ejemplos son la fosfatidilcolina (PC), la fosfatidil-etanolamina (PE), la fosfatidil-serina (PS), el fosfatidilglicerol (PG), el fosfatidil-inositol (PI) o el ácido fosfatídico (PA) no modificado5,6. En cuanto a las colas hidrofóbicas, la longitud y el grado de saturación varían, junto con la estructura de la columna vertebral. Las combinaciones posibles son numerosas, resultando en miles de especies lipídicas en células de mamíferos6. Los cambios en la composición lipídica de la membrana conducen a diferentes propiedades mecánicas y estructurales de la membrana que afectan la actividad tanto de las proteínas integrales de membrana como de las proteínas periféricas 2,6.
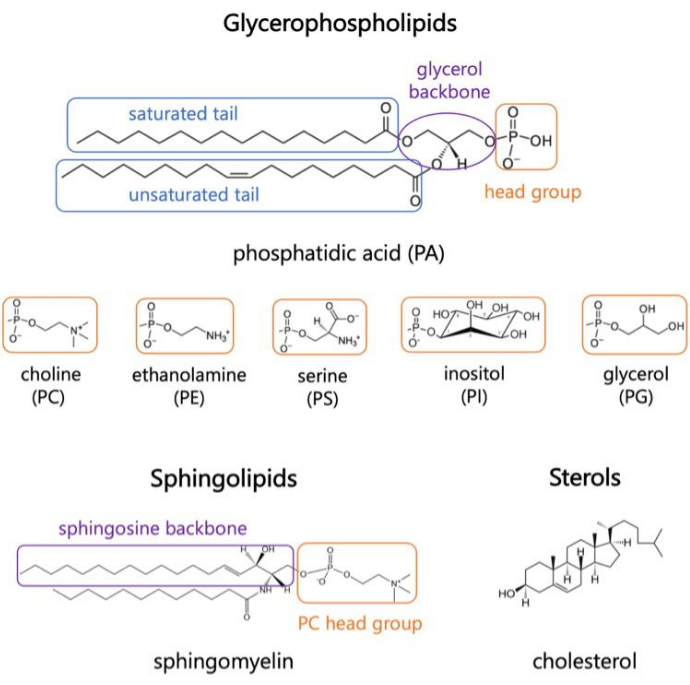
Figura 1. Estructuras lipídicas representativas. Las colas de ácidos grasos se muestran en cuadros azules, los grupos de cabezas de lípidos comunes en naranja y las columnas vertebrales de las muestras en púrpura. Haga clic aquí para ver una versión más grande de esta figura.
Los lípidos son actores activos en los procesos celulares, en la activación de proteínas en las cascadas de señalización y en la homeostasis de las células sanas 8,9. La alteración de la dinámica lipídica es el resultado de la infección o puede ser marcador de patogenia de la enfermedad 10,11,12,13,14,15. Como barreras para la célula, el estudio de los lípidos de membrana y su papel en la permeación de moléculas pequeñas es relevante para los sistemas de liberación de fármacos y los mecanismos de disrupción de la membrana16,17. La diversidad química y las diferentes proporciones de especies lipídicas en orgánulos, tejidos y organismos dan lugar a una dinámica compleja de membranas2. Por lo tanto, es importante mantener estas características en los estudios de modelización de bicapas lipídicas, especialmente cuando el objetivo de un estudio es examinar las interacciones de otras biomoléculas con la membrana. Las especies lipídicas a considerar en un modelo dependen del organismo y del compartimento celular de interés. Por ejemplo, los lípidos PG son importantes para la transferencia de electrones en la batería fotosintética18, mientras que los lípidos fosforilados de inositol (PIP) son actores importantes en la dinámica de la membrana plasmática (PM) y en las cascadas de señalización en las células de mamíferos19,20. Dentro de la célula, el PM, el retículo endoplásmico (RE), Golgi y las membranas mitocondriales contienen abundancias lipídicas únicas que influyen en su función. Por ejemplo, el RE es el centro de la biogénesis lipídica y transporta el colesterol hacia el PM y el Golgi; contiene una alta diversidad lipídica con abundancia de PC y PE, pero bajo contenido de esteroles, lo que promueve la fluidez de la membrana21,22,23,24. Por el contrario, el PM incorpora cientos e incluso miles de especies lipídicas dependiendo del organismo25, contiene altos niveles de esfingolípidos y colesterol que le confieren una rigidez característica en comparación con otras membranas de la célula24. Se debe considerar la asimetría de las valvas para membranas como la PM, que tiene una valva externa rica en esfingomielina, PC y colesterol, y una valva interna rica en PE, PI y PS que son importantes para las cascadas de señalización24. Finalmente, la diversidad lipídica también propicia la formación de microdominios que difieren en el empaquetamiento y el orden interno, conocidos como balsas lipídicas24,26; Estos exhiben asimetría lateral, se supone que juegan un papel importante en la señalización celular26 y son difíciles de estudiar debido a su naturaleza transitoria.
Se han utilizado técnicas experimentales como la fluoroscopia, la espectroscopia y sistemas de membranas modelo como las vesículas unilamelares gigantes (GUV) para investigar las interacciones de las biomoléculas con las membranas. Sin embargo, la naturaleza compleja y dinámica de los componentes involucrados es difícil de capturar solo con métodos experimentales. Por ejemplo, existen limitaciones en la obtención de imágenes de los dominios transmembrana de las proteínas, la complejidad de las membranas utilizadas en dichos estudios y la identificación de estados intermedios o transitorios durante el proceso de interés27,28,29. Desde el advenimiento de la simulación molecular de monocapas y bicapas lipídicas en la década de 198029, los sistemas lípido-proteína y sus interacciones pueden cuantificarse a nivel molecular. La simulación de dinámica molecular (MD) es una técnica computacional común que predice el movimiento de las partículas en función de sus fuerzas intermoleculares. Un potencial de interacción aditiva describe las interacciones enlazadas y no enlazadas entre las partículas del sistema30. El conjunto de parámetros utilizados para modelar estas interacciones se denomina campo de fuerza de simulación (FF). Estos parámetros se obtienen a partir de cálculos ab initio, semiempíricos y de mecánica cuántica, y se optimizan para reproducir datos de experimentos de rayos X y difracción de electrones, RMN, espectroscopía infrarroja, Raman y de neutrones, entre otros métodos31.
Las simulaciones de MD se pueden utilizar para estudiar sistemas en varios niveles de resolución32,33,34. Los sistemas que tienen como objetivo caracterizar interacciones biomoleculares específicas, enlaces de hidrógeno y otros detalles de alta resolución se estudian con simulaciones de todos los átomos (AA). Por el contrario, las simulaciones de grano grueso (CG) agrupan los átomos en grupos funcionales más grandes para reducir el costo computacional y examinarla dinámica a mayor escala. Entre estos dos se encuentran las simulaciones de átomos unidos (UA), donde los átomos de hidrógeno se combinan con sus respectivos átomos pesados para acelerar el cálculo33,35. Las simulaciones MD son una poderosa herramienta para la exploración de la dinámica de las membranas lipídicas y sus interacciones con otras moléculas y pueden servir para proporcionar mecanismos a nivel molecular para procesos de interés en la interfaz de la membrana. Además, las simulaciones de MD pueden servir para acotar objetivos experimentales y predecir las propiedades macromoleculares de un sistema determinado en función de las interacciones microscópicas.
En resumen, dado un conjunto de coordenadas iniciales, velocidades y un conjunto de condiciones como temperatura y presión constantes, las posiciones y velocidades de cada partícula se calculan a través de la integración numérica del potencial de interacción y la Ley del movimiento de Newton. Esto se repite de forma iterativa, generando así una trayectoria de simulación30. Estos cálculos se realizan con un motor MD; entre varios paquetes de código abierto, GROMACS36 es uno de los motores más utilizados y el que describimos aquí. También incluye herramientas para el análisis y la construcción de las coordenadas iniciales de los sistemas a simular37. Otros motores MD incluyen NAMD38; CHARMM39 y AMBER40, que el usuario puede seleccionar a su propia discreción en función del rendimiento computacional de un sistema determinado. Es fundamental visualizar las trayectorias durante la simulación, así como para el análisis e interpretación de los resultados. Hay una variedad de herramientas disponibles; aquí discutimos la dinámica molecular visual (VMD) que ofrece una amplia gama de características, incluida la visualización tridimensional (3-D) con métodos expansivos de dibujo y coloreado, la visualización de datos volumétricos, la construcción, preparación y análisis de trayectorias de sistemas de simulación MD y la creación de películas de trayectoria sin límites en el tamaño del sistema, si la memoria está disponible41,42,43.
La precisión de la dinámica predicha entre los componentes del sistema está directamente influenciada por el FF elegido para la propagación de la trayectoria. Los esfuerzos empíricos de parametrización de FF son llevados a cabo por pocos grupos de investigación. Los FF más establecidos y comunes para la distrofia muscular incluyen CHARMM39, AMBER 40, Martini44, OPLS45 y SIRAH46. El campo de fuerza47 del CHARMM36 aditivo de todos los átomos (C36) se usa ampliamente para AA MD de sistemas de membrana, ya que reproduce con precisión los datos estructurales experimentales. Fue desarrollado originalmente por la comunidad CHARMM y es compatible con múltiples motores MD como GROMACS y NAMD. A pesar de las mejoras en los FF comunes, existe un esfuerzo continuo para mejorar los conjuntos de parámetros para permitir predicciones que reproduzcan fielmente los observables experimentales, impulsados por el interés en sistemas particulares de estudio48,49.
Un reto a la hora de simular membranas lipídicas es determinar la longitud de la trayectoria de simulación. Esto depende en gran medida de las métricas a analizar y del proceso que se pretenda caracterizar. Típicamente, las mezclas lipídicas complejas requieren más tiempo para alcanzar el equilibrio, ya que más especies deben tener tiempo suficiente para difundirse en el plano de la membrana y alcanzar una organización lateral estable. Se dice que una simulación está en equilibrio cuando la propiedad de interés ha alcanzado una meseta y fluctúa alrededor de un valor constante. Es una práctica común obtener al menos 100-200 ns de trayectoria equilibrada para llevar a cabo un análisis estadístico adecuado sobre las propiedades e interacciones de interés. Es común ejecutar simulaciones solo de membrana entre 200 y 500 ns, dependiendo de la complejidad de la mezcla de lípidos y la pregunta de investigación. Las interacciones proteína-lípidos suelen requerir tiempos de simulación más largos, entre 500 y 2000 ns. Algunos enfoques para acelerar el muestreo y la dinámica observable con sistemas de membranas son: (i) el modelo mimético de membrana altamente móvil (HMMM), que reemplaza los carbonos finales de los lípidos en la membrana con solvente orgánico para acelerar el muestreo50; y ii) la repartición de la masa de hidrógeno (HMR), que combina una fracción de las masas de los átomos pesados dentro de un sistema con las de los átomos de hidrógeno para permitir el uso de un paso de tiempo de simulación más grande51.
En el siguiente protocolo se describe un enfoque fácil de usar para principiantes para crear, ejecutar y analizar modelos de membrana realistas mediante AA MD. Dada la naturaleza de las simulaciones de MD, se deben ejecutar múltiples trayectorias para tener en cuenta la reproducibilidad y el análisis estadístico adecuado de los resultados. Es una práctica actual ejecutar un mínimo de tres réplicas por sistema de interés. Una vez que se han seleccionado las especies lipídicas para el organismo y el proceso de interés, se describen y resumen en la Figura 2 los pasos básicos para construir, ejecutar y analizar una trayectoria de simulación de un sistema solo de membrana.
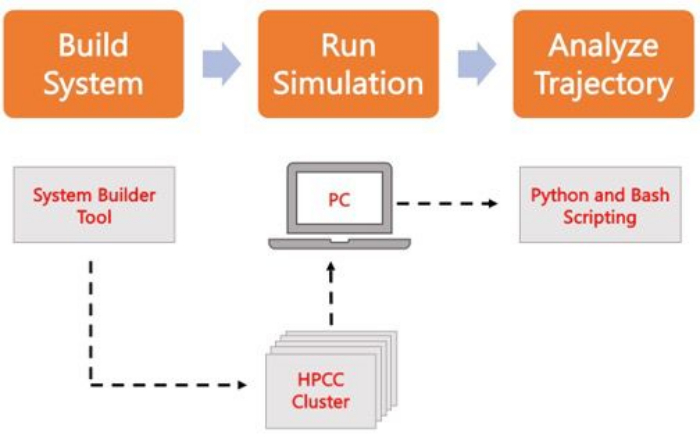
Figura 2. Esquema para ejecutar simulaciones de MD. Las casillas naranjas corresponden a los tres pasos principales descritos en el protocolo. Debajo está el flujo de trabajo del proceso de simulación. Durante la configuración del sistema, el sistema que contiene las coordenadas iniciales de un sistema de membrana solvatada se construye con un generador de entrada del sistema como CHARMM-GUI Membrane Builder. Después de transferir los archivos de entrada a un clúster informático de alto rendimiento, la trayectoria de simulación se propaga mediante un motor MD, como GROMACS. El análisis de la trayectoria se puede realizar en el clúster informático o en una estación de trabajo local junto con la visualización. A continuación, se lleva a cabo el análisis, ya sea utilizando paquetes con código de análisis incorporado, como GROMACS y VMD, o mediante scripts de Bash o varias bibliotecas de Python. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Las técnicas experimentales permiten visualizar biomoléculas de alta resolución utilizando criomicroscopía electrónica (crio-EM)58, técnicas de fluorescencia y microscopía de fuerza atómica (AFM)59. Sin embargo, es difícil captar la interacción y la dinámica de las interacciones moleculares que subyacen a las vías biológicas, la patogénesis de la enfermedad y la administración terapéutica a nivel atómico o de aminoácidos. Aquí, se discutieron las capacida…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Los autores agradecen a Jinhui Li y Ricardo X. Ramírez por sus trayectorias de simulación y discusiones durante la redacción de este manuscrito. O.C. contó con el apoyo de la Beca Presidencial de la Universidad de Buffalo y la Iniciativa para Maximizar la Capacitación en Desarrollo Estudiantil del Instituto Nacional de Salud 1T32GM144920-01 otorgada a Margarita L. Dubocovich (PI).
Materials
| Anaconda3 | Anaconda Inc (Python & related libraries) | N/A | |
| CHARMM-GUI.org | Im lab, Lehigh University | N/A | |
| GROMACS | GROMACS development team | N/A | |
| Linux HPC Cluster | UB CCR | N/A | |
| MATLAB | MathWorks | N/A | |
| VMD | Theoretical and Computational Biophysics Group | N/A |
References
- Vanni, S., Riccardi, L., Palermo, G., De Vivo, M. Structure and Dynamics of the Acyl Chains in the Membrane Trafficking and Enzymatic Processing of Lipids. Accounts of Chemical Research. 52 (11), 3087-3096 (2019).
- Harayama, T., Riezman, H. Understanding the diversity of membrane lipid composition. Nature Reviews Molecular Cell Biology. 19 (5), 281-296 (2018).
- Tanaka, M., Edward, H. .. . E. g. e. l. m. a. n. . Comprehensive Biophysics. , 261-272 (2012).
- Bruce Alberts, A. J., Julian Lewis, , Martin Raff, , Keith Roberts, , Peter Walter, . Molecular Biology of the Cell. , (2002).
- Watson, H. Biological membranes. Essays in Biochemistry. 59, 43-69 (2015).
- Coskun, &. #. 2. 2. 0. ;., Simons, K. Cell Membranes: The Lipid Perspective. Structure. 19 (11), 1543-1548 (2011).
- Douglas G, H. a. y. e. s., Daniel, K. Y., Solaiman, D., Richard, . Biobased Surfactants (Second Edition) eds. , 515-529 (2019).
- González-Rubio, P., Gautier, R., Etchebest, C., Fuchs, P. F. J. Amphipathic-Lipid-Packing-Sensor interactions with lipids assessed by atomistic molecular dynamics. Biochimica et Biophysica Acta (BBA) – Biomembranes. 1808, 2119-2127 (2011).
- Halbleib, K., et al. Activation of the Unfolded Protein Response by Lipid Bilayer Stress. Molecular Cell. 67, 673-684 (2017).
- Andreasen, M., Lorenzen, N., Otzen, D. Interactions between misfolded protein oligomers and membranes: A central topic in neurodegenerative diseases. Biochimica et Biophysica Acta (BBA) – Biomembranes. 1848 (9), 1897-1907 (2015).
- Calianese, D. C., Birge, R. B. Biology of phosphatidylserine (PS): basic physiology and implications in immunology, infectious disease, and cancer. Cell Commununication and Signaling. 18 (1), 41 (2020).
- Nieto-Garai, J. A., Contreras, F. X., Arboleya, A., Lorizate, M. Role of Protein-Lipid Interactions in Viral Entry. Advanced Biology. 6, 2101264 (2022).
- Mazzon, M., Mercer, J. Lipid interactions during virus entry and infection. Cell Microbiology. 16, 1493-1502 (2014).
- Colombelli, C., Aoun, M., Tiranti, V. Defective lipid metabolism in neurodegeneration with brain iron accumulation (NBIA) syndromes: not only a matter of iron. Journal of Inherited Metabolic Disease. 38 (1), 123-136 (2015).
- Saini-Chohan, H. K., Mitchell, R. W., Vaz, F. M., Zelinski, T., Hatch, G. M. Delineating the role of alterations in lipid metabolism to the pathogenesis of inherited skeletal and cardiac muscle disorders: Thematic Review Series: Genetics of Human Lipid Diseases. Journal of Lipid Research. 53 (1), 4-27 (2012).
- Martinotti, C., Ruiz-Perez, L., Deplazes, E., Mancera, R. L. Molecular Dynamics Simulation of Small Molecules Interacting with Biological Membranes. ChemPhysChem. 21 (14), 1486-1514 (2020).
- Li, J., Kalyanram, P., Rozati, S., Monje-Galvan, V., Gupta, A. Interaction of Cyanine-D112 with Binary Lipid Mixtures: Molecular Dynamics Simulation and Differential Scanning Calorimetry Study. ACS Omega. 7 (11), 9765-9774 (2022).
- Nagy, L., et al. Protein/Lipid Interaction in the Bacterial Photosynthetic Reaction Center: Phosphatidylcholine and Phosphatidylglycerol Modify the Free Energy Levels of the Quinones. 생화학. 43 (40), 12913-12923 (2004).
- Ramirez, R. X., Campbell, O., Pradhan, A. J., Atilla-Gokcumen, G. E., Monje-Galvan, V. Modeling the molecular fingerprint of protein-lipid interactions of MLKL on complex bilayers. Frontiers in Chemistry. 10, (2023).
- Dondelinger, Y., et al. MLKL Compromises Plasma Membrane Integrity by Binding to Phosphatidylinositol Phosphates. Cell Reports. 7 (4), 971-981 (2014).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature Reviews Molecular Cell Biology. 9 (2), 112-124 (2008).
- van Meer, G., de Kroon, A. I. P. M. Lipid map of the mammalian cell. Journal of Cell Science. 124 (1), 5 (2011).
- Lee, H. R., Lee, G. Y., You, D. G., Kim, H. K., Young, D. Y. Hepatitis C virus p7 induces membrane permeabilization by interacting with phosphatidylserine. International Journal of Molecular Sciences. 21 (3), 897 (2020).
- Casares, D., Escribá, P. V., Rosselló, C. A. Membrane Lipid Composition: Effect on Membrane and Organelle Structure, Function and Compartmentalization and Therapeutic Avenues. International Journal of Molecular Sciences. 20 (9), 2167 (2019).
- Marrink, S. J., et al. Computational Modeling of Realistic Cell Membranes. Chemical Reviews. 119 (9), 6184-6226 (2019).
- Janmey, P. A., Kinnunen, P. K. J. Biophysical properties of lipids and dynamic membranes. Trends in Cell Biology. 16 (10), 538-546 (2006).
- Brémaud, E., Favard, C., Muriaux, D. Deciphering the Assembly of Enveloped Viruses Using Model Lipid Membranes. Membranes. 12, 441 (2022).
- Campbell, O., Monje-Galvan, V. Protein-driven membrane remodeling: Molecular perspectives from Flaviviridae infections. Biophysical Journal. 122 (11), 1890-1899 (2022).
- Loschwitz, J., Olubiyi, O. O., Hub, J. S., Strodel, B., Poojari, C. S. Computer simulations of protein-membrane systems. Progress in molecular biology and translational science. 170, 273-403 (2020).
- Shell, M. S., Scott Shell, M. . Thermodynamics and Statistical Mechanics: An Integrated ApproachCambridge Series in Chemical Engineering. , 21-49 (2015).
- Yang, J., et al. Molecular Dynamic Simulation of Ni-Al Alloy-H2O Reactions Using the ReaxFF Reactive Force Field. ACS Omega. 8 (11), 9807-9814 (2023).
- Ingólfsson, H. I., Arnarez, C., Periole, X., Marrink, S. J. Computational ‘microscopy’ of cellular membranes. Journal of Cell Science. 129 (2), 257-268 (2016).
- Klauda, J. B. Perspective: Computational modeling of accurate cellular membranes with molecular resolution. The Journal of Chemical Physics. 149 (22), 220901 (2018).
- Chavent, M., Duncan, A. L., Sansom, M. S. P. Molecular dynamics simulations of membrane proteins and their interactions: from nanoscale to mesoscale. Current Opinion in Structural Biology. 40, 8-16 (2016).
- Khakbaz, P., Monje-Galvan, V., Zhuang, X., Klauda, J. B., Otto Geiger, . Biogenesis of Fatty Acids, Lipids and Membranes. , 1-19 (2017).
- Abraham, M. J., et al. GROMACS: High performance molecular simulations through multi-level parallelism from laptops to supercomputers. SoftwareX. 1, 19-25 (2015).
- Lemkul, J. A. From Proteins to Perturbed Hamiltonians: A Suite of Tutorials for the GROMACS-2018 Molecular Simulation Package. Living Journal of Computational Molecular Science. 1 (1), 5068 (2018).
- Phillips, J. C., et al. Scalable molecular dynamics on CPU and GPU architectures with NAMD. The Journal of Chemical Physics. 153 (4), 044130 (2020).
- Klauda, J. B., et al. Update of the CHARMM All-Atom Additive Force Field for Lipids: Validation on Six Lipid Types. The Journal of Physical Chemistry B. 114 (23), 7830-7843 (2010).
- Wang, J., Wolf, R. M., Caldwell, J. W., Kollman, P. A., Case, D. A. Development and testing of a general amber force field. Journal of Computational Chemistry. 25 (9), 1157-1174 (2004).
- John Stone, A. A., et al. . Using VMD. , (2011).
- Humphrey, W., Dalke, A., Schulten, K. VMD: Visual molecular dynamics. Journal of Molecular Graphics. 14 (1), 33-38 (1996).
- Hsin, J., Arkhipov, A., Yin, Y., Stone, J. E., Schulten, K. Using VMD: An Introductory Tutorial. Current Protocols in Bioinformatics. 24 (1), 5.7.1-5.7.48 (2008).
- Souza, P. C. T., et al. Martini 3: a general purpose force field for coarse-grained molecular dynamics. Nature Methods. 18 (4), 382-388 (2021).
- Jorgensen, W. L., Maxwell, D. S., Tirado-Rives, J. Development and Testing of the OPLS All-Atom Force Field on Conformational Energetics and Properties of Organic Liquids. Journal of the American Chemical Society. 118 (45), 11225-11236 (1996).
- Machado, M. R., et al. The SIRAH 2.0 Force Field: Altius, Fortius, Citius. Journal of Chemical Theory and Computation. 15 (4), 2719-2733 (2019).
- Huang, J., et al. CHARMM36m: an improved force field for folded and intrinsically disordered proteins. Nature Methods. 14 (1), 71-73 (2017).
- Mu, J., Liu, H., Zhang, J., Luo, R., Chen, H. F. Recent Force Field Strategies for Intrinsically Disordered Proteins. Journal of Chemical Information and Modeling. 61 (3), 1037-1047 (2021).
- Inakollu, V. S. S., Geerke, D. P., Rowley, C. N., Yu, H. Polarisable force fields: what do they add in biomolecular simulations. Current Opinion in Structural Biology. 61, 182-190 (2020).
- Ohkubo, Y. Z., et al. Accelerating Membrane Insertion of Peripheral Proteins with a Novel Membrane Mimetic Model. Biophysical Journal. 102 (9), 2130-2139 (2012).
- Hopkins, C. W., Le Grand, S., Walker, R. C., Roitberg, A. E. Long-Time-Step Molecular Dynamics through Hydrogen Mass Repartitioning. Journal of Chemical Theory and Computation. 11 (4), 1864-1874 (2015).
- Park, S., Beaven, A. H., Klauda, J. B., Im, W. How Tolerant are Membrane Simulations with Mismatch in Area per Lipid between Leaflets. Journal of Chemical Theory and Computation. 11 (7), 3466-3477 (2015).
- Park, S., Im, W., Pastor, R. W. Developing initial conditions for simulations of asymmetric membranes: a practical recommendation. Biophysical Journal. 120 (22), 5041-5059 (2021).
- Wu, E. L., et al. CHARMM-GUI Membrane Builder toward realistic biological membrane simulations. Journal of Computational Chemistry. 35 (27), 1997-2004 (2014).
- Center for Computational Research, U.a.B.. . CCR Facility Description. , (2019).
- Piggot, T. J., Allison, J. R., Sessions, R. B., Essex, J. W. On the Calculation of Acyl Chain Order Parameters from Lipid Simulations. Journal of Chemical Theory and Computation. 13 (11), 5683-5696 (2017).
- Li, J., Monje-Galvan, V. Effect of Glycone Diversity on the Interaction of Triterpenoid Saponins and Lipid Bilayers. ACS Applied Bio Materials. , (2023).
- Renaud, J. P., et al. Cryo-EM in drug discovery: achievements, limitations and prospects. Nature Reviews Drug Discovery. 17 (7), 471-492 (2018).
- Ando, T., Uchihashi, T., Kodera, N. High-Speed AFM and Applications to Biomolecular Systems. Annual Review of Biophysics. 42 (1), 393-414 (2013).
- Martínez, L., Andrade, R., Birgin, E. G., Martínez, J. M. PACKMOL: A package for building initial configurations for molecular dynamics simulations. Journal of Computational Chemistry. 30 (13), 2157-2164 (2009).
- Jewett, A. I., et al. Moltemplate: A Tool for Coarse-Grained Modeling of Complex Biological Matter and Soft Condensed Matter Physics. Journal of Molecular Biology. 433 (11), 166841 (2021).
- Jo, S., Kim, T., Iyer, V. G., Im, W. CHARMM-GUI: A web-based graphical user interface for CHARMM. Journal of Computational Chemistry. 29 (11), 1859-1865 (2008).
- Polêto, M. D., Lemkul, J. A. Integration of experimental data and use of automated fitting methods in developing protein force fields. Communications Chemistry. 5 (1), 38 (2022).
- Hynninen, A. P., Crowley, M. F. New faster CHARMM molecular dynamics engine. Journal of Computational Chemistry. 35 (5), 406-413 (2014).
- Kim, S. Issues on the Choice of a Proper Time Step in Molecular Dynamics. Physics Procedia. 53, 60-62 (2014).
- Grubmüller, H., Heller, H., Windemuth, A., Schulten, K. Generalized Verlet Algorithm for Efficient Molecular Dynamics Simulations with Long-range Interactions. Molecular Simulation. 6 (1-3), 121-142 (1991).
- Darden, T., York, D., Pedersen, L. Particle mesh Ewald: An N·log(N) method for Ewald sums in large systems. Journal of Chemical Physics. 98 (12), 10089-10092 (1993).
- . . Hepatitis C. , (2021).
- Braun, E., et al. Best Practices for Foundations in Molecular Simulations [Article v1.0]. Living Journal of Computational Molecular Science. 1 (1), 5957 (2018).
- Moradi, S., Nowroozi, A., Shahlaei, M. Shedding light on the structural properties of lipid bilayers using molecular dynamics simulation: a review study. RSC Advances. 9 (8), 4644-4658 (2019).
- Monje-Galvan, V., Klauda, J. B. Modeling Yeast Organelle Membranes and How Lipid Diversity Influences Bilayer Properties. 생화학. 54 (45), 6852-6861 (2015).
- Michaud-Agrawal, N., Denning, E. J., Woolf, T. B., Beckstein, O. MDAnalysis: A toolkit for the analysis of molecular dynamics simulations. Journal of Computational Chemistry. 32 (10), 2319-2327 (2011).
- Gowers, R., et al. MDAnalysis: A Python Package for the Rapid Analysis of Molecular Dynamics Simulations. SciPy. , (2016).
- McGibbon, R. o. b. e. r. t. . T., et al. MDTraj: A Modern Open Library for the Analysis of Molecular Dynamics Trajectories. Biophysical Journal. 109 (8), 1528-1532 (2015).
- Fortunato, M. E., Colina, C. M. pysimm: A python package for simulation of molecular systems. SoftwareX. 6, 7-12 (2017).
- Scherer, M. K., et al. PyEMMA 2: A Software Package for Estimation, Validation, and Analysis of Markov Models. Journal of Chemical Theory and Computation. 11 (11), 5525-5542 (2015).
- Song, W., et al. PyLipID: A Python Package for Analysis of Protein-Lipid Interactions from Molecular Dynamics Simulations. Journal of Chemical Theory and Computation. 18 (2), 1188-1201 (2022).
- Monje-Galvan, V., Klauda, J. B. Peripheral membrane proteins: Tying the knot between experiment and computation. Biochimica et Biophysica Acta (BBA) – Biomembranes. 1858 (7, Part B), 1584-1593 (2016).
- Monje-Galvan, V., Voth, G. A. Binding mechanism of the matrix domain of HIV-1 gag on lipid membranes. eLife. 9, e58621 (2020).
- Wang, B., Guo, C. Concentration-Dependent Effects of Cholesterol on the Dimerization of Amyloid-β Peptides in Lipid Bilayers. ACS Chemical Neuroscience. 13 (18), 2709-2718 (2022).

