Ein thermoplasmonischer Ansatz zur Untersuchung der Reparatur von Plasmamembranen in lebenden Zellen und Modellmembranen
Summary
Die thermoplasmonische Punktionsmethode integriert konfokale Mikroskopie, optische Pinzetten und Goldnanopartikel, um Proteinantworten während der Reparatur von Plasmamembranen in Zellen und riesigen unilamellären Vesikeln zu untersuchen. Die Technik ermöglicht eine schnelle und lokalisierte Membranpunktion und ermöglicht die Identifizierung von Schlüsselproteinen und ihrer funktionellen Rolle in der komplizierten Plasmamembran-Reparaturmaschinerie.
Abstract
Die Zellmembran ist entscheidend für das Überleben der Zelle, und die Gewährleistung ihrer Integrität ist von entscheidender Bedeutung, da die Zelle während ihres gesamten Lebenszyklus Verletzungen erleidet. Um eine Schädigung der Membran zu verhindern, haben Zellen effiziente Reparaturmechanismen der Plasmamembran entwickelt. Diese Reparaturmechanismen können durch die Kombination von konfokaler Mikroskopie und nanoskaliger Thermoplasmonik untersucht werden, um die Rolle von Schlüsselproteinen wie Annexinen zu identifizieren und zu untersuchen, die an der Oberflächenreparatur in lebenden Zellen und Membranmodellsystemen beteiligt sind.
Bei der Punktionsmethode wird ein Laser verwendet, um bei der Bestrahlung mit Nanopartikeln eine stark lokalisierte Erwärmung zu induzieren. Die Verwendung von Nahinfrarotlicht minimiert die Phototoxizität in der biologischen Probe, während der Großteil der Absorption im Nahinfrarot-resonanten plasmonischen Nanopartikel stattfindet. Diese thermoplasmonische Methode wurde für potenzielle photothermische und biophysikalische Forschung genutzt, um das Verständnis intrazellulärer Mechanismen und zellulärer Reaktionen durch Vesikel- und Zellfusionsstudien zu verbessern. Der Ansatz hat sich als komplementär zu bestehenden Methoden zur Membranzerstörung erwiesen, wie z. B. mechanisch, chemisch oder optisch induzierte Verletzungen, und bietet ein hohes Maß an Kontrolle durch die Zufügung extrem lokalisierter Verletzungen. Das Ausmaß der Verletzung ist auf die Nähe des sphärischen Nanopartikels beschränkt, und im Gegensatz zu gepulsten Lasern mit unterschiedlichen Wellenlängen treten entlang des Strahlengangs keine schädlichen Schäden auf. Trotz gewisser Einschränkungen, wie z.B. der Bildung von Nanobläschen, bietet die thermoplasmonische Methode ein einzigartiges Werkzeug, um zelluläre Reaktionen bei der Reparatur von Plasmamembranen in einer nahezu nativen Umgebung zu untersuchen, ohne die Lebensfähigkeit der Zellen zu beeinträchtigen.
In Kombination mit der konfokalen Mikroskopie kann die Punktionsmethode ein mechanistisches Verständnis der Membrandynamik in Modellmembransystemen sowie quantitative Informationen über Proteinreaktionen auf Membranschäden, einschließlich der Proteinrekrutierung und ihrer biophysikalischen Funktion, liefern. Insgesamt kann die Anwendung dieser Methode auf reduzierte Modellsysteme unser Verständnis der komplizierten Plasmamembran-Reparaturmaschinerie in lebenden Zellen verbessern.
Introduction
Die Zellmembran, die sowohl als physikalische Barriere als auch als Signalplattform dient, ist für das Überleben der Zellen von entscheidender Bedeutung1. Während ihres gesamten Zellzyklus ist die Plasmamembran (PM) Schäden ausgesetzt, wie z. B. mechanischen 2,3,4,5- und chemischen 6-Stress-induzierten Verletzungen. Um die Integrität der Membran aufrechtzuerhalten und das Überleben der Zellen zu sichern, hat die Zelle robuste Mechanismen zur Reparatur der Plasmamembran (PMR) entwickelt. Diese Mechanismen hängen von verschiedenen Strategien ab, wie z. B. der Reorganisation des Zytoskeletts, der Membranfusion und den Membranersatzstrategien 7,8,9,10,11, die alle auf der Rekrutierung spezifischer Proteine beruhen. Insbesondere wurden Mitglieder der Annexin-Proteinfamilie als Schlüsselproteine identifiziert, die mit den Prozessen von PMR 1,9,12,13,14,15,16 assoziiert sind. Nach einer PM-Verletzung kommt es in der Zelle zu einem Einstrom von Kalziumionen (Ca2+), der eine unmittelbare Bedrohung für das Überleben der Zelle darstellt17. Als Reaktion auf denCa2+-Einstrom binden Annexinproteine, die sich überwiegend im Zytosol befinden, im Rahmen der PMR-Strategien an das innere Segel der geschädigten Plasmamembran18. Annexin A2 (ANXA2) war eines der ersten Mitglieder der Annexin-Familie, das mit PMR bei Dysferlin-defizienter Muskeldystrophie assoziiert wurde, und es wurde vorgeschlagen, die Reparatur durch die Fusion intrazellulärer Vesikel mit dem PM in der Nähe der Verletzungsstelle zu vermitteln 5,19,20,21. In der Folge wurden den Anhängen22 mehrere Funktionen zugeschrieben, und ihre Rolle in der PMR hat in den letzten 20 Jahren immer mehr Aufmerksamkeit erregt. Die genaue Rolle von Annexinen in der PMR ist jedoch noch nicht vollständig geklärt 15,18,21,22.
In diesem Artikel wird eine Methode zur Untersuchung der Protein-Membran-Interaktion und der Membrandynamik in einer kontrollierten und hochgradig lokalisierten Weise vorgeschlagen, wobei eine Kombination aus konfokaler Mikroskopie, optischer Pinzette und Goldnanopartikeln (AuNPs) verwendet wird. Diese Methode ermöglicht die quantitative Untersuchung von Protein-, Lipid- und niedermolekularen Wechselwirkungen als Reaktion auf Membranschäden und Ca2+ Einstrom. Trotz der Komplexität und Vielfalt der Komponenten, die am Prozess der Membranreparatur beteiligt sind, wurden vereinfachte Membransysteme, die die Plasmamembran nachahmen, eingesetzt, um ein tieferes mechanistisches Verständnis der Membrandynamik und der Reaktion von Annexinproteinen auf Membranstörungen zu erlangen16. Als Modellmembransystem wurden riesige unilamellare Lipidvesikel (GUVs) mit einer spezifizierten Lipidzusammensetzung gewählt. Die GUVs wurden mit der gelunterstützten Hydratationsmethode, insbesondere der Polyvinylalkohol-Gelhydratation, wie von Weinberger et al.23 beschrieben, erzeugt, die eine effiziente Verkapselung von Annexinen in GUVs ermöglichte.
Die Verwendung von Nahinfrarot-Laserbestrahlung (NIR) auf metallischen Nanopartikeln (NPs) induziert eine signifikante Erwärmung des NP, was sie zu einer effektiven Methode zur Etablierung einer lokalen Wärmequelle macht, die in biomedizinischen Anwendungen genutzt wird24. Die Methode wurde ursprünglich verwendet, um die Temperatur, die einen einzelnen AuNP umgibt, sowohl in 2D- als auch in 3D-biomimetischen Assays direkt zu messen. In diesen Assays 25,26 wurden die plasmonischen Nanopartikel auf einer geträgerten Lipiddoppelschicht bestrahlt oder optisch in der Nähe von GUVs gefangen, die bei lokaler Erwärmung einen lokalen thermischen Phasenübergang durchliefen, was eine Quantifizierung und Kontrolle des genauen Temperaturprofils um das Partikel herum ermöglichte. Dieses Referenztemperaturprofil wurde bei der Untersuchung oder Manipulation biologischer Proben verwendet. Weitere Fortschritte in der Methode haben die Induktion nanoskopischer Poren in Membranen27 erleichtert, was eine Vesikel- und Zellfusion ermöglicht28,29. Andere Studien haben das Verhalten von peripheren Membranproteinen in GUVs29 und Transmembranproteinen30 untersucht, indem sie neuartige Hybridvesikel geschaffen haben, während die zellspezifische Wirkstoffabgabe ebenfalls untersucht wurde, um zelluläre Reaktionen oder Genexpression zu kontrollieren und zu untersuchen 28,29,31,32,33. Kürzlich wurde die Methode verwendet, um Proteinantworten auf Membranschäden zu untersuchen 32,34,35.
Es gibt mehrere Methoden, um die Plasmamembran aufzubrechen, um zelluläre Reaktionen und die Membranreparatur zu untersuchen. Dazu gehören Mikronadelpunktionen, Mikroperlenschütteln und Zellschaben, die alle die Zellmembran mechanisch stören können 14,36,37. Chemisch induzierte Schäden können durch Zugabe von Detergenzien 5,38 oder bakteriellen Toxinen39,40 erreicht werden, die die Lipiddoppelschicht destabilisieren und Membranporen über der Plasmamembran erzeugen. Darüber hinaus wurden optisch induzierte Verletzungen durch kontinuierliche und gepulste Laser verwendet, um PMR-Komponenten, wie z. B. die Annexinproteine 5,14,21,41, in Kombination mit plasmonischen Nanopartikeln 42,43,44,45 zu untersuchen. Trotz der Effizienz von gepulsten Hochleistungslasern können sie entlang des Strahlengangs erhebliche Verletzungen und Schäden im Zellinneren verursachen. Darüber hinaus müssen die detaillierten Veränderungen, die bei gepulster Laserbestrahlung in der biologischen Materie auftreten, und ob dadurch eine gut definierte Pore entsteht, noch weiter untersucht werden. In diesem Artikel wird eine alternative Methode vorgestellt, bei der die Thermoplasmonik eingesetzt wird, um nanoskopische Löcher im Feinstaub auf kontrollierte Weise zu induzieren34,35, ohne die inneren Strukturen signifikant zu beschädigen. Dies wird erreicht, indem plasmonische NPs einem hochfokussierten NIR-Laser ausgesetzt werden, was zu einem extrem lokalisierten Temperaturanstieg führt, der leicht Temperaturen von über 200 °C erreichen kann, was zu kleinen nanoskopischen Explosionen führen kann 25,46,47. Dieser Prozess kann durch Einstellen der Laserintensität sowie der Größe, Form und Zusammensetzung der NPs48 gesteuert werden. Durch den Einsatz dieser Technik können Forscher die Rolle von Proteinen bei der PM-Reparatur in lebenden Zellen untersuchen, was dazu beitragen könnte, einige der unbeantworteten Fragen bezüglich der Beteiligung von Annexin-Proteinen an der Membranreparatur zu beantworten, ohne die Lebensfähigkeit der Zellen zu beeinträchtigen.
Das optische Einfangen von plasmonischen Nanopartikeln ist in früheren Studien gut etabliert 25,49,50,51,52; zusätzliche Erkenntnisse über die thermoplasmonischen Eigenschaften der Nanopartikel 53,54,55 können jedoch in den ergänzenden Materialien (Ergänzungsdatei 1) gewonnen werden. Mit der thermoplasmonischen Methode können nanoskopische Löcher im PM erzeugt werden, um die zelluläre Reaktion und Reparaturmechanismen zu untersuchen. Genauer gesagt kann die Punktion durch die optische Erwärmung von AuNPs in unmittelbarer Nähe der Membran erreicht werden, wie in den Abbildungen 1A und B gezeigt. Diese lokalisierte Punktion ermöglicht einen Ca2+ Einstrom, der durch einen Kalziumsensor verifiziert wurde, wodurch die PMR-Maschinerie aktiviert wurde. Für Lebendzellexperimente wurden AuNPs mit einem Durchmesser von 200 nm auf der Oberfläche unter der Zelle immobilisiert, um die Rolle von ANXA2 in der PMR mittels konfokaler Mikroskopie zu überwachen. Der NIR-Laser (Abbildung 1A, B) mit einer Wellenlänge von 1064 nm bestrahlt das AuNP unter Ausnutzung seiner plasmonischen Eigenschaften (Abbildung 1C), was zu einer erheblichen lokalen Erwärmung (Abbildung 1D) im biologischen Transparenzfenster49 führt, während die Zelle selbst nur minimal beschädigt wird. Der Hochtemperaturbereich, der den AuNP umgibt, nimmt in einem Abstand, der dem Radius des NP entspricht, schnell um 30-40% ab, wie in Abbildung 1E dargestellt, was eine extrem begrenzte Verletzung in allen drei Dimensionen ermöglicht.
Ergänzendes Dossier 1. Bitte klicken Sie hier, um diese Datei herunterzuladen.
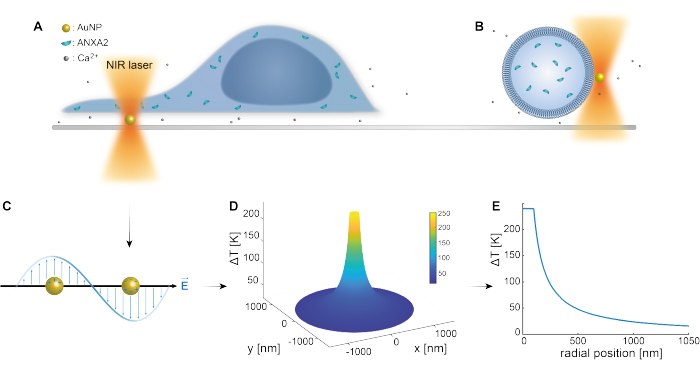
Abbildung 1: Schematische Darstellung der experimentellen Methode. (A) ANXA-transfizierte Zellen befinden sich auf immobilisierten Goldnanopartikeln (AuNPs) auf der Oberfläche, oder (B) riesige unilamellare Vesikel (GUVs) mit eingekapseltem ANXA sind in einem Medium suspendiert, das AuNPs enthält. (C) Ein einzelnes AuNP wird von der optischen NIR-Falle bestrahlt, wobei die Wechselwirkung zwischen dem einfallenden elektromagnetischen Feld und den Leitungselektronen zu einer kollektiven Schwingung der Elektronen innerhalb des NP führt. (D) Dieser Prozess führt zu einem sehr begrenzten, aber signifikanten Temperaturanstieg. Um die Temperatur an der NP-Oberfläche abzuschätzen, wird die Mie-Theorie verwendet und ein (E)-Temperaturprofil für einen AuNP mit einem Durchmesser von 200 nm und einer Laserintensität I = 6,36 x 108 W/cm2 berechnet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Um den thermischen Effekt auf die Zellmembran zu minimieren, werden die AuNPs nur für ~1 Sekunde bestrahlt. Dies führt zu einem vorübergehenden und lokalen Erhitzungsschub, der die Schädigung von Proteinen reduziert, die normalerweise mehr Zeit benötigen, um sich zu entfalten. Bei der Membranpunktion werden Annexinproteine im Bruchteil einer Sekunde rekrutiert, und innerhalb weniger Sekunden bildet sich ein Annexin-Ring-ähnliches Gerüst um die Verletzungsstelle (Abbildung 2). Dieser Ansatz wurde auch angewendet, um die Beteiligung von ANXA5 sowohl in lebenden Zellen als auch in Modellmembranen16 zu untersuchen, um das vollständige Schema der Reparaturprozesse zu beleuchten. Während das Hauptaugenmerk auf der korrelierenden Rekrutierung verschiedener Annexin-Proteine lag, sind die biophysikalischen Aspekte des Reparaturmechanismus noch nicht geklärt.
Um die vorgeschlagene Methode vollständig umzusetzen, sind drei Schlüsselkomponenten erforderlich: konfokale Mikroskopie, optische Pinzette und Metallnanopartikel. Optische Pinzetten werden verwendet, um AuNPs einzufangen, und ihre Konstruktion kann nach dem von Neuman et al.49 beschriebenen Verfahren erreicht werden. Wenn sich der Bau einer optischen Pinzette jedoch als zu schwierig erweist, kann ein eng fokussierter NIR-Laser verwendet werden, um AuNPs zu bestrahlen, die unter den Zellen immobilisiert sind. Während für dieses Protokoll sphärische AuNPs ausgewählt wurden, konnte auch eine Vielzahl von plasmonischen Partikeln mit einstellbaren Absorptionsspektren verwendet werden, um einen stark lokalisierten Temperaturgradienten innerhalb des NIR-Bereichszu erreichen 48.
Die Fluoreszenzbildgebung ist notwendig, um die Rolle der fluoreszenzmarkierten Proteine zu beobachten, und daher könnte die Totalreflexionsmikroskopie (TIRF)56 als Alternative zur konfokalen Bildgebung in Betracht gezogen werden. Diese Technik erlaubt jedoch nur die Oberflächenbildgebung und wäre nicht kompatibel mit den Modell-Membranvesikel-Experimenten. Folglich sind sowohl die optische Pinzette als auch das konfokale Mikroskop für die präzise Lokalisierung des Nanopartikels und die detaillierte Untersuchung des lokalen Bereichs um die Zellverletzung unerlässlich. Um das Nanopartikel effektiv mit einem beugungsbegrenzten Laserfokus zu bestrahlen, ist es notwendig, das Nanopartikel sichtbar zu machen. Dies kann durch die Reflexionsmikroskopie, die ein Standard-Bildgebungsmerkmal der konfokalen Mikroskope von Leica ist, optimal erreicht werden. Wenn jedoch keine Reflexions- oder Streubildgebung verfügbar ist, können alternative Methoden, wie z. B. die weniger effiziente fluoreszierende AuNP-Markierung, in Betracht gezogen werden.
Zusammenfassend lässt sich sagen, dass die in dieser Studie vorgestellte hochgradig kontrollierbare und lokalisierte thermoplasmonische Methode das Potenzial hat, als hervorragende Plattform für die Untersuchung der molekularen Komponenten zu dienen, die an zellulären Reaktionen und PM-Reparaturmechanismen in lebenden Zellen beteiligt sind. Neben der Untersuchung der Proteinantwort auf PM-Schäden kann dieser Ansatz auch für die lokale Punktion von Vesikeln verwendet werden, wodurch eine Untersuchung der Proteinantwort sowohl in der Protein-Protein- als auch in der Protein-Membran-Dynamik ermöglicht wird. Darüber hinaus ermöglicht diese Methode eine quantitative Analyse der Wechselwirkungen zwischen Proteinen, Lipiden und kleinen Molekülen, wenn Membranen aufgebrochen werden. Zusammengenommen haben diese Fortschritte das Potenzial, einige der ungelösten Fragen in Bezug auf die komplizierte und komplexe Reparaturmaschinerie von Plasmamembranen zu beleuchten.
Protocol
Representative Results
Discussion
Die Studie hebt den thermoplasmonischen Ansatz als vielversprechende Technik hervor, um Proteinantworten in lebenden Zellen und Modellmembranen nach Membranaufschluss zu untersuchen. Diese Methode liefert nicht nur umfangreiche Informationen über die Proteinrekrutierung, sondern auch über die biophysikalische Funktion von Proteinen, die an der Proteinmembrandynamik beteiligt sind. Folglich erleichtert es die Identifizierung molekularer Komponenten, die für die Oberflächenreparatur verantwortlich sind, und fördert das Verständnis der komplexen, aber lebenswichtigen Maschinerie der Plasmamembranreparatur. Obwohl es verschiedene Methoden gibt, um Membranaufschluss zu induzieren, wie z. B. mechanische, chemische und optische Techniken, leiden diese Methoden unter Einschränkungen, wie z. B. dass sie nicht spezifisch für Zellen sind, mehrere Verletzungen der Zellmembran verursachen oder eine erhebliche Schädigung der Membran verursachen und internes Zellmaterial entlang des Laserpfads abtragen, wenn gepulste Hochleistungslaser verwendet werden. Während die Integration von konfokaler Mikroskopie und optischer Pinzette die umfassendsten Informationen bietet, könnten auch alternative Bildgebungsmodalitäten verwendet werden. Da beispielsweise die Abbildung des plasmonischen Nanopartikels mit Hilfe der Reflexionsmikroskopie, einem eingebauten Bildgebungsmodus in konfokalen Leica-Mikroskopen, erreicht wird, könnten zusätzliche bildgebende Verfahren wie die Dunkelfeldmikroskopie65,66, andere Streumethoden wie iSCAT67,68 oder die Fluoreszenzmarkierung des Nanopartikels für die AuNP-Visualisierung eingesetzt werden, obwohl dies die Anwendbarkeit der Methode einschränken könnte.
Die vorgestellte Methode ist zusätzlich in der Lage, nanoskopische Löcher in Modellmembranen zu induzieren, was die Untersuchung von Synergieeffekten zwischen verschiedenen Anhängsen ermöglicht. Dies wird durch die Verkapselung unterschiedlich markierter rekombinanter Annexine, z.B. RFP bzw. GFP, erreicht, gefolgt von einer thermoplasmonischen Punktion. Dieses Modellsystem gibt Aufschluss darüber, wie Annexine mit Membranen in der Nähe freier Kanten interagieren, wie in Abbildung 2D gezeigt. Anders als in Zellen dehnen sich die Löcher bei GUVs jedoch weiter aus, gefolgt von einer Destabilisierung des Vesikels. Die Abbildung der Lochentwicklung mit konfokaler Mikroskopie kann aufgrund der schnellen Ausdehnung des Lochdurchmessers eine Herausforderung darstellen, kann aber durch die Erfassung mehrerer Z-Stapel im Laufe der Zeit erreicht werden. Eine alternative Methode wäre die Verwendung einer konfokalen rotierenden Scheibe für eine schnellere Bildgebung. Darüber hinaus liefert der thermoplasmonische Ansatz in der Regel eine begrenzte Anzahl optimaler Ergebnisse pro Stunde, wenn er auf Einzelzellen oder GUV-Experimente angewendet wird, in der Regel zwei bis drei, bei Probentemperaturen zwischen 20 °C und 30 °C. Um eine möglichst genaue Beobachtung der Protein-Membran-Dynamik zu erhalten, wird empfohlen, die Zellen in einem HEPES-haltigen Puffer zu halten und die Probe stündlich auszutauschen. Alternativ könnte das experimentelle Fenster erweitert werden, indem die Versuche in einer Zellinkubationskammer, d.h. bei einer konstanten Temperatur von 37 °C mit 5 %CO2, durchgeführt werden. Darüber hinaus könnte die Kombination dieses Ansatzes mit anderen bildgebenden Verfahren, wie der stochastischen optischen Rekonstruktionsmikroskopie (STORM), ein tieferes Verständnis der biophysikalischen Funktion und Interaktion von Schlüsselproteinen liefern, die an der Membranreparatur auf Einzelmolekülebene beteiligt sind. Dies könnte detaillierte Informationen über den Ort der Verletzung liefern, einschließlich der Wundgeometrie und der Lage der Annexin-Proteine, sowie andere Schlüsselakteure identifizieren, die an der Reparatur der Membranoberfläche beteiligt sind.
Um maximale Effektivität und Präzision bei der Induktion von Membranverletzungen zu erreichen, ist es zwingend erforderlich, die Position des Laserfokus vor jedem Experiment zu überprüfen und sicherzustellen, dass die axiale Position des Laserfokus mit dem konfokalen Fokus übereinstimmt. Diese Ausrichtung optimiert die Intensität während der AuNP-Bildgebung, was zu einem maximalen lokalen Temperaturanstieg und einer daraus resultierenden Membranverletzung bei geringerer Laserleistung führt. Dieser Prozess wird manuell ausgeführt und ist daher anfällig für Schwankungen in der Membranbrucheffizienz, da der Fokus manuell in eine Position verschoben wird, die mit der Position des Partikels übereinstimmt. Bei Mikroskopen, die keinen Reflexionsmodus haben, wie z. B. in einigen kommerziellen Systemen, kann die Kolokalisierung von Laserfokus und Partikel eine Herausforderung darstellen. In solchen Fällen können alternative Bildgebungsmodi (z. B. Hellfeld) verwendet werden, und ein langsamer Rasterscan kann um die erwartete Partikelposition herum durchgeführt werden. Es sollte beachtet werden, dass eine niedrige Laserleistung wahrscheinlich nur eine Membranpermeabilisierung induziert, während eine hohe Laserleistung Temperaturen um den NP herum erzeugen kann, die den Siedepunkt von Wasser überschreiten, selbst wenn die Glasoberfläche einen kühlenden Effekt hat. Es wird geschätzt, dass die Bildung von Nanoblasen, die die NPs umgeben, zwischen 200 °C und 300 °Cstattfindet 25,48, wobei die explosive Hitze entweder zu einer Partikelverschiebung aus dem Laserfokus oder zu einer Partikelfragmentierung führen kann. Darüber hinaus stellt die Bildung von Nano- oder Mikrobläschen beim Erhitzen eine Herausforderung für diese Methode dar. Da Luftgrenzflächen die Membranen entfeuchten und eine Proteindestabilisierung verursachen können, was unerwünscht ist, ist es zwingend erforderlich, die Erwärmung bei der Untersuchung der Membranreparatur zu begrenzen. Bemerkenswert ist, dass Goldnanoschalen keine hohen Temperaturen tolerieren und sich unter diesen Bedingungen abbauen, wie die hochauflösende Mikroskopie58 zeigt.
Dieser Artikel enthält ein detailliertes Protokoll für die Verwendung von Thermoplasmonik zur Durchführung stark lokalisierter Punktionen in Membranen, das sowohl auf Zellen als auch auf Modellmembranen anwendbar ist. Um das Ausmaß der Erwärmung weiter zu reduzieren, können kleinere Nanopartikel verwendet werden, die mit NIR-Licht in Resonanz stehen, was intrazelluläre Punktionen in Endosomen, im endoplasmatischen Retikulum und in der Kernhülle ermöglicht. Solche Nanopartikel, einschließlich Stäbchen und Nanomatroschkas48, können verwendet werden, um die Reparatur der Kernhülle zu untersuchen, indem sie auf endozytosierte Goldnanopartikel abzielen, die leicht an der Zelloberfläche aufgenommen und in Richtung des Zellkerns69 transportiert werden. Insgesamt ermöglicht diese Technik die Identifizierung und Untersuchung von molekularen Schlüsselkomponenten, die an der PMR beteiligt sind, und klärt ihre biophysikalische Funktion und Rolle auf, während die Lebensfähigkeit der Zellen erhalten bleibt.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Wir danken Jesper Nylandsted für die Bereitstellung von rekombinanten Annexin-Proteinen und Plasmiden, die für Annexine kodieren. Diese Arbeit wurde finanziell unterstützt vom Dänischen Rat für unabhängige Forschung, Naturwissenschaften (DFF-4181-00196), vom Interdisziplinären Synergieprogramm 2018 der Novo Nordisk Foundation (NNF18OC0034936), dem Wissenschaftlichen Komitee der Dänischen Krebsgesellschaft (R90-A5847-14-S2), der Lundbeck Foundation (R218-2016-534) und vom Lundbeck Foundation Center of Excellence (Biomembranes in Nanomedicine).
Materials
| 1064 nm trapping laser | Spectra Physics | N/A | Spectra Physics J201-BL-106C, Nd: YVO4 NIR laser |
| 160 nm Gold Nanoshells | NanoComposix | NCXGSIR150 | |
| 200 nm Gold Nanoparticles | BBI Solutions | EM.GC200/7 | |
| 35 mm glass surface MatTex microwell | MATTEK | P35G-1.5-14-C | |
| Amber-glass vials | Supelco Sigma Aldrich | 243438 | |
| Annexin A2 plasmids | N/A | N/A | Received from our collaborator at the Danish Cancer Research Center |
| Annexin A4 recombinant-protein | N/A | N/A | N-terminal GFP tagged ANXA4 received from our collaborator at the Danish Cancer Research Center |
| Annexin A5 recombinant-protein | N/A | N/A | N-terminal GFP tagged ANXA5 received from our collaborator at the Danish Cancer Research Center |
| beta-casein | Sigma Life Science | C6905-1G | |
| CaCl2 | Suprlco (sigma Aldrich) | 10035-04-8 | |
| Centrifuge 5702 | Eppendorf | 5702 | |
| Chloroform | VWR Chemicals | 67-66-3 | |
| Culture dish (Nunclon Delta Surface) | Thermo scientific | 150460 | |
| DID cell-labelling Solution | Invitrogen | 7757 | |
| Distilled water | Gibco | 15230-089 | |
| DOPC | Avanti Polar Lipids | 850375C | Dissolved in chloroform |
| DOPS | Avanti Polar Lipids | 840035C | Dissolved in chloroform |
| Dulbecco's Modified Eage's Medium | Thermo Fisher Scientific | 11995065 | |
| FIJI ImageJ distribution | ImageJ2 | N/A | |
| GCaMP6s-CAAX | N/A | Received from our collaborator at the Danish Cancer Research Center | |
| Gibco Fetal Bovine Serum | Fisher Scientific | 11573397 | 10% of the culture medium |
| Glucose | PROLABO | 24 374.297 | |
| Hamilton syringes | Hamilton Company | N/A | 50 and 500 microliters |
| Harrick Plasma Cleaner PDG-002 | Harrick Plasma | N/A | |
| HEK293T cells | N/A | Received from our collaborator at the Danish Cancer Research Center | |
| Leica Acousto-Optical Beam Splitter (AOBS) | Leica | N/A | |
| Leica PL APO 63x water immersion objective, NA = 1.2 | Leica | N/A | |
| Leica SP5 confocal scanning microscope | Leica | N/A | |
| Lipofectamine | Fisher Scientific | 15338030 | |
| MatLab | The Mathworks, Inc., Natick, Massachusetts, United States | N/A | |
| NaCl | VWR Chemicals | 7647-14-5 | |
| Opti-MEM Reduced-Serum Medium | Thermo Fisher Scientific | 11058021 | |
| Parafilm | Bemis | PM-992 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 1% of the culture medium |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | 10010023 | |
| Piezoelectric stage (PI 731.20) | Physik Instrumente (Germany) | N/A | |
| Poly-L-Lysine | Sigma-Aldrich | P8920-100ML | 0.01-0.1% for coating |
| Polyvinyl alcohol | Sigma-Aldrich | 363065-25G | |
| round glass slide 25 mm Ø | VWR | 631-1584 | |
| Sonicator Brandson 2800 | Brandson | N/A | |
| sucrose | Sigma Life Science | 57-50-1 | |
| T25 tissue culture flask | Falcon | 353108 | Blue Vented cap |
| Tris-HCl | Invitrogen | 15567-027 | |
| TrypLE | Thermo Fisher Scientific | A1285901 | |
| Trypsin-EDTA | Fisher Scientific | 11590626 | |
| VWR Mixer mini vortex 230V EU | VWR | 12620-84 | ECN: 444-2790, SN: 150713022 |
References
- Bendix, P. M., et al. Interdisciplinary synergy to reveal mechanisms of annexin-mediated plasma membrane shaping and repair. Cells. 9 (4), 1029 (2020).
- Gajic, O., Lee, J., Doerr, C. H., Berrios, J. C., Myers, J. L., Hubmayr, R. D. Ventilator-induced Cell Wounding and Repair in the Intact Lung. American Journal of Respiratory and Critical Care Medicine. 167, 1057-1063 (2003).
- McNeil, P. L., Khakee, R. Disruptions of muscle fiber plasma membranes. Role in exercise-induced damage. The American Journal of Pathology. 140 (5), 1097-1109 (1992).
- Yu, Q. C., McNeil, P. L. Transient disruptions of aortic endothelial cell plasma membranes. The American Journal of Pathology. 141 (6), 1349-1360 (1992).
- Boye, T. L., et al. Annexin A4 and A6 induce membrane curvature and constriction during cell membrane repair. Nature Communications. 8, 1623 (2017).
- Bischofberger, M., Gonzalez, M. R., van der Goot, F. G. Membrane injury by pore-forming proteins. Current Opinion in Cell Biology. 21, 589-595 (2009).
- Tang, S. K. Y., Marshall, W. F. Self-repairing cells. Science (New York, N.Y.). 356, 1022-1025 (2017).
- Abreu-Blanco, M. T., Verboon, J. M., Parkhurst, S. M. Single cell wound repair: Dealing with life’s little traumas. Bioarchitecture. 1, 114-121 (2011).
- Sønder, S. L., et al. Annexin A7 is required for ESCRT III-mediated plasma membrane repair. Scientific Reports. 9, 6726 (2019).
- Andrews, N. W., Almeida, P. E., Corrotte, M. Damage control: cellular mechanisms of plasma membrane repair. Trends in Cell Biology. 24 (12), 734-742 (2014).
- Idone, V., Tam, C., Goss, J. W., Toomre, D., Pypaert, M., Andrews, N. W. Repair of injured plasma membrane by rapid Ca2+-dependent endocytosis. The Journal of Cell Biology. 180 (5), 905-914 (2008).
- Lauritzen, S. P., Boye, T. L., Nylandsted, J. Annexins are instrumental for efficient plasma membrane repair in cancer cells. Seminars in Cell & Developmental Biology. 45, 32-38 (2015).
- Häger, S. C., Nylandsted, J. Annexins: players of single cell wound healing and regeneration. Communicative & Integrative Biology. 12 (1), 162-165 (2019).
- Jaiswal, J. K., et al. S100A11 is required for efficient plasma membrane repair and survival of invasive cancer cells. Nature Communications. 5, 3795 (2014).
- Draeger, A., Monastyrskaya, K., Babiychuk, E. B. Plasma membrane repair and cellular damage control: The annexin survival kit. Biochemical Pharmacology. 81 (6), 703-712 (2011).
- Moreno-Pescador, G. S., et al. Thermoplasmonic nano-rupture of cells reveals annexin V function in plasma membrane repair. Nanoscale. 14 (21), 7778-7787 (2022).
- Zhivotovsky, B., Orrenius, S. Calcium and cell death mechanisms: A perspective from the cell death community. Cell Calcium. 50 (3), 211-221 (2011).
- Gerke, V., Moss, S. E. Annexins: From structure to function. Physiological Reviews. 82 (2), 331-371 (2002).
- Idone, V., Tam, C., Andrews, N. W. Two-way traffic on the road to plasma membrane repair. Trends in Cell Biology. 18 (11), 552-559 (2008).
- Boye, T. L., et al. Annexins induce curvature on free-edge membranes displaying distinct morphologies. Scientific Reports. 8, 10309 (2018).
- Bouter, A., et al. Annexin-A5 assembled into two-dimensional arrays promotes cell membrane repair. Nature Communications. 2, 270 (2011).
- Boye, T. L., Nylandsted, J. Annexins in plasma membrane repair. Biological Chemistry. 397 (10), 961-969 (2016).
- Weinberger, A., et al. Gel-assisted formation of giant unilamellar vesicles. Biophysical Journal. 105 (1), 154-164 (2013).
- Numata, T., Tatsuta, H., Morita, Y., Otani, Y., Umeda, N. Localized thermal processing with a laser-trapped and heated metal nanoparticle. IEEJ Transactions on Electrical and Electronic Engineering. 2, 398-401 (2007).
- Bendix, P. M., Reihani, S. N. S., Oddershede, L. B. Direct measurements of heating by electromagnetically trapped gold nanoparticles on supported lipid bilayers. ACS Nano. 4 (4), 2256-2262 (2010).
- Kyrsting, A., Bendix, P. M., Stamou, D. G., Oddershede, L. B. Heat profiling of three-dimensionally optically trapped gold nanoparticles using vesicle cargo release. Nano Letters. 11 (2), 888-892 (2011).
- Andersen, T., Kyrsting, A., Bendix, P. M. Local and transient permeation events are associated with local melting of giant liposomes. Soft Matter. 10 (24), 4268-4274 (2014).
- Bahadori, A., Oddershede, L. B., Bendix, P. M. Hot-nanoparticle-mediated fusion of selected cells. Nano Research. 10, 2034-2045 (2017).
- Rørvig-Lund, A., Bahadori, A., Semsey, S., Bendix, P. M., Oddershede, L. B. Vesicle fusion triggered by optically heated gold nanoparticles. Nano Letters. 15 (6), 4183-4188 (2015).
- Moreno-Pescador, G., Arastoo, M. R., Ruhoff, V. T., Chiantia, S., Daniels, R., Bendix, P. M. Thermoplasmonic vesicle fusion reveals membrane phase segregation of influenza spike proteins. Nano Letters. 23 (8), 3377-3384 (2023).
- Bahadori, A., Lund, A. R., Semsey, S., Oddershede, L. B., Bendix, P. M. Controlled cellular fusion using optically trapped plasmonic nano-heaters. SPIE Proceedings. SPIE 9922, Optical Trapping and Optical Micromanipulation XIII. 992211, (2016).
- Bahadori, A., Moreno-Pescador, G., Oddershede, L. B., Bendix, P. M. Remotely controlled fusion of selected vesicles and living cells: a key issue review. Reports on Progress in Physics. 81 (3), 32602 (2018).
- Moreno-Pescador, G., Arastoo, M. R., Chiantia, S., Daniels, R., Bendix, P. M. Thermoplasmonic induced vesicle fusion for investigating membrane protein phase affinity. bioRxiv. , (2022).
- Pescador, G. S. M., et al. Investigating plasma-membrane repair employing thermoplasmonics. Biophysical Journal. 120 (3), 45A (2021).
- Moreno-Pescador, G. S., Qoqaj, I., Thusgaard Ruhoff, V., Iversen, J., Nylandsted, J., Bendix, P. M. Effect of local thermoplasmonic heating on biological membranes. SPIE 11083, Optical Trapping and Optical Micromanipulation XVI. 110830M, (2019).
- Bement, W. M., Mandato, C. A., Kirsch, M. N. Wound-induced assembly and closure of an actomyosin purse string in Xenopus oocytes. Current Biology. 9 (11), 579-587 (1999).
- Weisleder, N., et al. Recombinant MG53 protein modulates therapeutic cell membrane repair in treatment of muscular dystrophy. Science Translational Medicine. 4 (139), 139ra85 (2012).
- Sudji, I. R., Subburaj, Y., Frenkel, N., García-Sáez, A. J., Wink, M. Membrane disintegration caused by the steroid saponin digitonin is related to the presence of cholesterol. Molecules. 20 (11), 20146-20160 (2015).
- Babiychuk, E. B., Monastyrskaya, K., Potez, S., Draeger, A. Intracellular Ca2+ operates a switch between repair and lysis of streptolysin O-perforated cells. Cell Death & Differentiation. 16, 1126-1134 (2009).
- Nygård Skalman, L., Holst, M. R., Larsson, E., Lundmark, R. Plasma membrane damage caused by listeriolysin O is not repaired through endocytosis of the membrane pore. Biology Open. 7 (10), bio035287 (2018).
- Swaggart, K. A., et al. Annexin A6 modifies muscular dystrophy by mediating sarcolemmal repair. Proceedings of the National Academy of Sciences of the United States of America. 111, 6004-6009 (2014).
- Yeheskely-Hayon, D., Minai, L., Golan, L., Dann, E. J., Yelin, D. Optically induced cell fusion using bispecific nanoparticles. Small. 9 (22), 3771-3777 (2013).
- Minai, L., Yeheskely-Hayon, D., Golan, L., Bisker, G., Dann, E. J., Yelin, D. Optical nanomanipulations of malignant cells: Controlled cell damage and fusion. Small. 8 (11), 1732-1739 (2012).
- Lukianova-Hleb, E., et al. Plasmonic nanobubbles as transient vapor nanobubbles generated around plasmonic nanoparticles. ACS Nano. 4 (4), 2109-2123 (2010).
- Vogel, A., Noack, J., Hüttman, G., Paltauf, G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B. 81, 1015-1047 (2005).
- Baffou, G., Polleux, J., Rigneault, H., Monneret, S. Super-heating and micro-bubble generation around plasmonic nanoparticles under cw illumination. Journal of Physical Chemistry C. 118 (9), 4890-4898 (2014).
- Sasikumar, K., Liang, Z., Cahill, D. G., Keblinski, P. Curvature induced phase stability of an intensely heated liquid. Journal of Chemical Physics. 140 (23), 234506 (2014).
- Jauffred, L., Samadi, A., Klingberg, H., Bendix, P. M., Oddershede, L. B. Plasmonic heating of nanostructures. Chemical Reviews. 119 (13), 8087-8130 (2019).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nature Methods. 5 (6), 491-505 (2008).
- Bendix, P. M., Jauffred, L., Norregaard, K., Oddershede, L. B. Optical trapping of nanoparticles and quantum dots. IEEE Journal of Selected Topics in Quantum Electronics. 20, 15-26 (2014).
- Samadi, A., Bendix, P. M., Oddershede, L. B. Optical manipulation of individual strongly absorbing platinum nanoparticles. Nanoscale. 46, 18449-18455 (2017).
- Jørgensen, J. T., Norregaard, K., Tian, P., Bendix, P. M., Kjaer, A., Oddershede, L. B. Single particle and PET-based platform for identifying optimal plasmonic nano-heaters for photothermal cancer therapy. Scientific Reports. 6, 30076 (2016).
- Goldenberg, H., Tranter, C. J. Heat flow in an infinite medium heated by a sphere. British Journal of Applied Physics. 3 (9), 296-298 (1952).
- Eustis, S., El-Sayed, M. A. Why gold nanoparticles are more precious than pretty gold: Noble metal surface plasmon resonance and its enhancement of the radiative and nonradiative properties of nanocrystals of different shapes. Chemical Society Reviews. 35, 209-217 (2006).
- Landau, L. D., Lifshitz, E. M. . Fluid Mechanics: Landau and Lifshitz: Course of Theoretical Physics. 6, (2013).
- Niederauer, C., Seynen, M., Zomerdijk, J., Kamp, M., Ganzinger, K. A. The K2: Open-source simultaneous triple-color TIRF microscope for live-cell and single-molecule imaging. HardwareX. 13, e00404 (2023).
- Richardson, A. C., Reihani, N., Oddershede, L. B. Combining confocal microscopy with precise force-scope optical tweezers. SPIE Proceedings:SPIE 6326, Optical Trapping and Optical Micromanipulation III. 632628, (2006).
- Samadi, A., Klingberg, H., Jauffred, L., Kjær, A., Bendix, P. M., Oddershede, L. B. Platinum nanoparticles: a non-toxic, effective and thermally stable alternative plasmonic material for cancer therapy and bioengineering. Nanoscale. 10 (19), 9097-9107 (2018).
- . Available from: https://www.thermofisher.com/order/catalog/product/A7816 (2023)
- Kreibig, U., Vollmer, M. Theoretical considerations. In: Optical Properties of Metal Clusters. 25, (1995).
- Mie, G. Beiträge zur Optik trüber Medien, speziell kolloidaler Metallösungen. Annalen der Physik. 330 (3), 377-445 (1908).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Klenow, M. B., Heitmann, A. S. B., Nylandsted, J., Simonsen, A. C. Timescale of hole closure during plasma membrane repair estimated by calcium imaging and numerical modeling. Scientific Reports. 11, 4226 (2021).
- Li, T., Wu, X., Liu, F., Li, N. Analytical methods based on the light-scattering of plasmonic nanoparticles at the single particle level with dark-field microscopy imaging. Analyst. 142 (2), 248-256 (2017).
- Gibbs-Flournoy, E. A., Bromberg, P. A., Hofer, T. P. J., Samet, J. M., Zucker, R. M. Darkfield-Confocal Microscopy detection of nanoscale particle internalization by human lung cells. Particle and Fibre Toxicology. 8 (1), 2 (2011).
- Taylor, R. W., Sandoghdar, V. Interferometric scattering microscopy: Seeing single nanoparticles and molecules via Rayleigh scattering. Nano Letters. 19 (8), 4827-4835 (2019).
- Wu, Y., Ali, M. R. K., Chen, K., Fang, N., El-Sayed, M. A. Gold nanoparticles in biological optical imaging. Nano Today. 24, 120-140 (2019).
- Klingberg, H., Oddershede, L. B., Loeschner, K., Larsen, E. H., Loft, S., Møller, P. Uptake of gold nanoparticles in primary human endothelial cells. Toxicology Research. 4 (3), 566-666 (2015).

