Uma Abordagem Termoplasmônica para Investigação do Reparo da Membrana Plasmática em Células Vivas e Membranas Modelo
Summary
O método de punção termoplasmônica integra microscopia confocal, pinças ópticas e nanopartículas de ouro para estudar as respostas proteicas durante o reparo da membrana plasmática em células e vesículas unilamelares gigantes. A técnica permite a punção rápida e localizada da membrana, permitindo a identificação de proteínas-chave e seus papéis funcionais na intrincada maquinaria de reparo da membrana plasmática.
Abstract
A membrana celular é crucial para a sobrevivência celular, e garantir sua integridade é essencial, pois a célula sofre lesões ao longo de todo o seu ciclo de vida. Para evitar danos à membrana, as células desenvolveram mecanismos eficientes de reparo da membrana plasmática. Esses mecanismos de reparo podem ser estudados combinando microscopia confocal e termoplasmônica em nanoescala para identificar e investigar o papel de proteínas-chave, como as anexinas, envolvidas no reparo de superfície em células vivas e sistemas modelo de membrana.
O método de punção emprega um laser para induzir aquecimento altamente localizado sobre a irradiação de nanopartículas. O uso de luz infravermelha próxima minimiza a fototoxicidade na amostra biológica, enquanto a maior parte da absorção ocorre na nanopartícula plasmônica ressonante do infravermelho próximo. Este método termoplasmônico tem sido explorado para potenciais pesquisas fototérmicas e biofísicas para melhorar a compreensão dos mecanismos intracelulares e respostas celulares através de estudos de fusão de vesículas e células. A abordagem tem se mostrado complementar aos métodos existentes para ruptura de membranas, como lesões induzidas mecanicamente, quimicamente ou opticamente, e fornece um alto nível de controle ao infligir lesões extremamente localizadas. A extensão da lesão é limitada à vizinhança da nanopartícula esférica, e nenhum dano prejudicial ocorre ao longo do caminho do feixe, em oposição aos lasers pulsados usando diferentes comprimentos de onda. Apesar de certas limitações, como a formação de nanobolhas, o método termoplasmônico oferece uma ferramenta única para investigar respostas celulares no reparo da membrana plasmática em um ambiente quase nativo sem comprometer a viabilidade celular.
Quando integrado à microscopia confocal, o método de punção pode fornecer uma compreensão mecanística da dinâmica da membrana em sistemas de membrana modelo, bem como informações quantitativas sobre as respostas proteicas a danos na membrana, incluindo o recrutamento de proteínas e sua função biofísica. Em geral, a aplicação deste método a sistemas modelo reduzidos pode melhorar nossa compreensão da intrincada maquinaria de reparo da membrana plasmática em células vivas.
Introduction
A membrana celular, servindo tanto como barreira física quanto como plataforma de sinalização, é vital para a sobrevivência celular1. Durante todo o seu ciclo celular, a membrana plasmática (PM) está sujeita a danos, tais como lesões mecânicas 2,3,4,5 e químicas6 induzidas por estresse. Para manter a integridade da membrana e garantir a sobrevivência celular, a célula desenvolveu mecanismos robustos de reparo da membrana plasmática (PMR). Esses mecanismos dependem de várias estratégias, como reorganização do citoesqueleto, fusão de membranas e estratégias de substituição de membranas7,8,9,10,11, as quais dependem do recrutamento de proteínas específicas. Notavelmente, membros da família de proteínas anexinas têm sido identificados como proteínas-chave associadas aos processos de PMR 1,9,12,13,14,15,16. Após a lesão de PM, a célula experimenta um influxo de íons cálcio (Ca2+), o que representa uma ameaça imediata à sobrevivência da célula17. Em resposta ao influxo de Ca2+, as proteínas anexinas, predominantemente localizadas no citosol, ligam-se ao folheto interno da membrana plasmática lesada como parte das estratégias de RPM18. A anexina A2 (ANXA2) foi um dos primeiros membros da família das anexinas a ser associada à RPM na distrofia muscular deficiente em disferlina e foi sugerida para mediar o reparo pela fusão de vesículas intracelulares ao PM próximo ao local da lesão 5,19,20,21. Posteriormente, várias funções foram atribuídas às anexinas22, e seu papel na PMR ganhou maior atenção nos últimos 20 anos. No entanto, o papel exato das anexinas na RPM ainda não é totalmente compreendido 15,18,21,22.
Este artigo propõe um método para investigar a interação proteína-membrana e a dinâmica da membrana de forma controlada e altamente localizada, utilizando uma combinação de microscopia confocal, pinças ópticas e nanopartículas de ouro (AuNPs). Este método permite o estudo quantitativo de interações proteicas, lipídicas e de pequenas moléculas em resposta a danos na membrana e influxo de Ca2+ . Apesar da complexidade e multiplicidade de componentes envolvidos no processo de reparo da membrana, sistemas de membrana simplificados que mimetizam a membrana plasmática têm sido empregados para obter uma compreensão mecanicista mais profunda da dinâmica da membrana e da resposta das proteínas da anexina à ruptura da membrana16. Vesículas lipídicas unilamelares gigantes (GUVs) foram escolhidas como o sistema de membrana modelo com uma composição lipídica especificada. As GUVs foram geradas utilizando o método de hidratação assistida por gel, especificamente a hidratação em gel de álcool polivinílico, como descrito por Weinberger et al.23, o que permitiu um encapsulamento eficiente de anexinas em GUVs.
A utilização da irradiação com laser no infravermelho próximo (NIR) em nanopartículas metálicas (NPs) induz aquecimento significativo do NP, tornando-se um método eficaz para estabelecer uma fonte de calor local explorada em aplicações biomédicas24. O método foi inicialmente usado para medir diretamente a temperatura ao redor de uma única AuNP em ensaios biomiméticos 2D e 3D. Nestes ensaios25,26, as nanopartículas plasmônicas foram irradiadas em uma bicamada lipídica suportada ou aprisionadas opticamente próximas a GUVs submetidas a uma transição de fase térmica local após aquecimento local, permitindo a quantificação e o controle do perfil exato de temperatura ao redor da partícula. Este perfil de temperatura de referência tem sido utilizado na investigação ou manipulação de espécimes biológicos. Novos avanços no método facilitaram a indução de poros nanoscópicos nas membranas27, permitindo a fusão de vesículas e células28,29. Outros estudos investigaram o comportamento de proteínas de membrana periférica em GUVs29 e proteínas transmembrana30 por meio da criação de novas vesículas híbridas, enquanto a liberação de fármacos específicos para células também tem sido explorada para controlar e estudar respostas celulares ou expressão gênica 28,29,31,32,33. Recentemente, o método tem sido utilizado para investigar as respostas proteicas ao dano de membrana 32,34,35.
Existem vários métodos para romper a membrana plasmática para explorar as respostas celulares e o reparo da membrana. Estes incluem punções com microagulhas, agitação de microesferas e raspagem celular, que podem romper mecanicamente a membrana celular 14,36,37. Danos quimicamente induzidos podem ser obtidos pela adição de detergentes 5,38 ou toxinas bacterianas39,40 que desestabilizam a bicamada lipídica e geram poros de membrana através da membrana plasmática. Além disso, lesões opticamente induzidas por ondas contínuas e lasers pulsados têm sido utilizados para estudar componentes do PMR, como as proteínas da anexina 5,14,21,41, em combinação com nanopartículas plasmônicas 42,43,44,45. Apesar da eficiência dos lasers pulsados de alta potência, eles podem causar lesões significativas e danos ao interior da célula ao longo do caminho do feixe. Além disso, as mudanças detalhadas que ocorrem na matéria biológica após a irradiação com laser pulsado e se ela cria um poro bem definido ainda precisam ser mais investigadas. Um método alternativo é apresentado neste artigo, empregando termoplasmônicos para induzir orifícios nanoscópicos no MP de forma controlada34,35 sem causar danos significativos às estruturas internas. Isso é conseguido expondo NPs plasmônicos a um laser NIR altamente focado, resultando em um aumento de temperatura extremamente localizado que pode facilmente atingir temperaturas superiores a 200 °C, o que pode levar a pequenas explosões nanoscópicas 25,46,47. Esse processo pode ser controlado ajustando-se a intensidade do laser, bem como o tamanho, a forma e a composição dos NPs48. Ao empregar esta técnica, os pesquisadores podem explorar o papel das proteínas no reparo da PM em pilhas vivas, o que poderia ajudar a resolver algumas das perguntas não respondidas sobre o envolvimento das proteínas da anexina no reparo da membrana sem comprometer a viabilidade celular.
O aprisionamento óptico de nanopartículas plasmônicas foi bem estabelecido por estudos prévios 25,49,50,51,52; entretanto, informações adicionais sobre as propriedades termoplasmônicas das nanopartículas 53,54,55 podem ser obtidas nos materiais complementares (Arquivo Suplementar 1). O método termoplasmônico pode ser utilizado para criar orifícios nanoscópicos no MP com a finalidade de estudar a resposta celular e mecanismos de reparo. Mais precisamente, a punção pode ser obtida através do aquecimento óptico das AuNPs em estreita proximidade com a membrana, como mostram as Figuras 1A e B. Essa punção localizada permite o influxo de Ca2+, que foi verificado por um sensor de cálcio, ativando assim o maquinário PMR. Para experimentos com células vivas, AuNPs com diâmetro de 200 nm foram imobilizadas na superfície abaixo da célula para monitorar o papel de ANXA2 na RPM via microscopia confocal. O laser NIR (Figura 1A,B), com comprimento de onda de 1064 nm, irradia a AuNP, explorando suas propriedades plasmônicas (Figura 1C), resultando em substancial aquecimento local (Figura 1D) na janela de transparência biológica49 e causando danos mínimos à própria célula. A região de alta temperatura ao redor da AuNP diminui rapidamente em 30-40% a uma distância correspondente ao raio da NP, como ilustrado na Figura 1E, permitindo uma lesão extremamente confinada nas três dimensões.
Arquivo Suplementar 1. Clique aqui para baixar este arquivo.
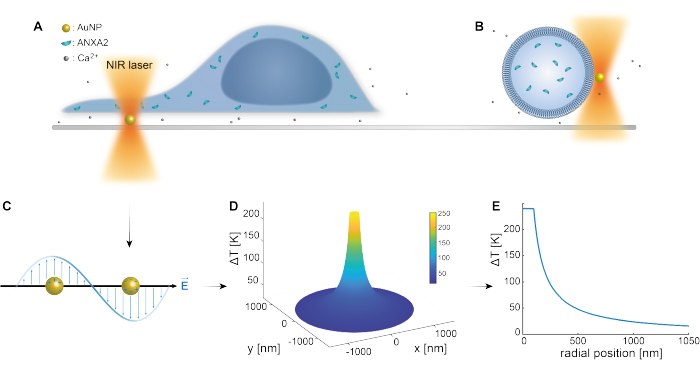
Figura 1: Esquema do método experimental. (A) células transfectadas por ANXA estão situadas sobre nanopartículas de ouro imobilizadas (AuNPs) na superfície, ou (B) vesículas unilamelares gigantes (GUVs) com ANXA encapsulado são suspensas em um meio contendo AuNPs. (C) Uma única AuNP é irradiada pela armadilha óptica NIR, onde a interação entre o campo eletromagnético de entrada e os elétrons de condução leva à oscilação coletiva dos elétrons dentro do NP. (D) Este processo resulta em um aumento altamente confinado, mas significativo da temperatura. Para estimar a temperatura na superfície NP, a teoria de Mie é empregada, e um perfil de temperatura (E) é calculado para uma AuNP com diâmetro de 200 nm e intensidade de laser I = 6,36 x 108 W/cm2. Clique aqui para ver uma versão maior desta figura.
Para minimizar o efeito térmico na membrana celular, as AuNPs são irradiadas apenas por ~1 segundo. Isso causa uma explosão transitória e local de aquecimento, o que reduz os danos às proteínas que normalmente exigem mais tempo para se desdobrar. Após a punção da membrana, as proteínas da anexina são recrutadas em uma fração de segundo e, em poucos segundos, um arcabouço semelhante a um anel de anexina é formado ao redor do local da lesão (Figura 2). Esta abordagem também tem sido aplicada para explorar o envolvimento de ANXA5 em células vivas e membranas modelo16 em um esforço para esclarecer o esquema completo dos processos de reparo. Embora o foco principal tenha sido o recrutamento correlacionado de várias proteínas de anexinas, os aspectos biofísicos do mecanismo de reparo ainda precisam ser elucidados.
Para implementar completamente o método proposto, três componentes principais são necessários: microscopia confocal, pinças ópticas e nanopartículas metálicas. Pinças ópticas são usadas para aprisionar AuNPs, e sua construção pode ser obtida seguindo o procedimento descrito por Neuman et al.49. No entanto, se a construção de uma pinça óptica se mostrar muito desafiadora, um laser NIR fortemente focado pode ser usado para irradiar AuNPs imobilizadas sob as células. Enquanto AuNPs esféricas foram escolhidas para este protocolo, uma variedade de partículas plasmônicas com espectros de absorção ajustáveis também pode ser utilizada para alcançar um gradiente de temperatura altamente localizado dentro da região NIR48.
A imagem por fluorescência é necessária para observar o papel das proteínas marcadas fluorescentemente e, portanto, a microscopia de reflexão interna total (TIRF)56 pode ser considerada uma alternativa à imagem confocal. No entanto, essa técnica permite apenas imagens de superfície e não seria compatível com os experimentos de vesículas de membrana modelo. Consequentemente, tanto a pinça óptica quanto o microscópio confocal são essenciais para a localização precisa da nanopartícula e investigação detalhada da área local ao redor da lesão celular. Para irradiar efetivamente a nanopartícula com um foco de laser limitado por difração, é necessário visualizar a nanopartícula. Isso pode ser obtido de forma otimizada pela microscopia de reflexão, que é um recurso de imagem padrão dos microscópios confocais Leica. No entanto, se a imagem de reflexão ou espalhamento não estiver disponível, métodos alternativos, como a marcação fluorescente de AuNP menos eficiente, podem ser considerados.
Em resumo, o método termoplasmônico altamente controlável e localizado apresentado neste estudo tem o potencial de servir como uma excelente plataforma para investigar os componentes moleculares envolvidos nas respostas celulares e mecanismos de reparo de MP em células vivas. Além de estudar a resposta proteica após danos de PM, essa abordagem também pode ser utilizada para puncionar vesículas localmente, permitindo assim uma investigação da resposta proteica tanto na dinâmica proteína-proteína quanto na proteína-membrana. Além disso, esse método permite uma análise quantitativa das interações entre proteínas, lipídios e pequenas moléculas quando as membranas são rompidas. Coletivamente, esses avanços têm o potencial de lançar luz sobre algumas das questões não resolvidas sobre a intrincada e complexa maquinaria de reparo da membrana plasmática.
Protocol
Representative Results
Discussion
O estudo destaca a abordagem termoplasmônica como uma técnica promissora para explorar respostas de proteínas em células vivas e membranas modelo após ruptura de membrana. Este método não só fornece extensa informação sobre o recrutamento de proteínas, mas também sobre a função biofísica de proteínas envolvidas na dinâmica proteína-membrana. Consequentemente, facilita a identificação de componentes moleculares responsáveis pelo reparo de superfície e avança na compreensão da complexa, mas vital maquinaria de reparo da membrana plasmática. Embora existam vários métodos para induzir ruptura de membrana, como mecânica, química e óptica, esses métodos sofrem limitações, como não serem específicos das células, gerar múltiplas lesões na membrana celular ou causar danos significativos à membrana e ablar material celular interno ao longo do trajeto do laser quando se utilizam lasers pulsados de alta potência. Embora a integração de microscopia confocal e pinça óptica ofereça as informações mais abrangentes, modalidades alternativas de imagem também podem ser usadas. Por exemplo, como a imagem da nanopartícula plasmônica é obtida usando microscopia de reflexão, um modo de imagem incorporado em microscópios confocais Leica, técnicas de imagem adicionais, como microscopia de campo escuro65,66, outros métodos de espalhamento como iSCAT 67,68, ou marcação fluorescente da nanopartícula, poderiam ser empregadas para visualização de AuNP, embora isso possa limitar a aplicabilidade do método.
O método apresentado é adicionalmente capaz de induzir orifícios nanoscópicos em membranas modelo, permitindo a investigação dos efeitos sinérgicos entre diferentes anexinas. Isso é conseguido encapsulando anexinas recombinantes marcadas de forma diferente, por exemplo, RFP e GFP, respectivamente, seguidas de punção termoplasmônica. Este sistema modelo fornece informações sobre como as anexinas interagem com membranas nas proximidades das bordas livres, como demonstrado na Figura 2D. No entanto, ao contrário das células, os orifícios infligidos aos GUVs continuam a se expandir, seguidos de desestabilização da vesícula. A obtenção de imagens da evolução do orifício usando microscopia confocal pode ser desafiadora devido à rápida expansão do diâmetro do furo, mas pode ser obtida capturando várias pilhas z ao longo do tempo. Um método alternativo seria usar um disco giratório confocal para imagens mais rápidas. Além disso, a abordagem termoplasmônica normalmente produz um número limitado de resultados ótimos por hora quando aplicada a células únicas ou experimentos de GUV, geralmente dois a três, em temperaturas de amostra entre 20 °C e 30 °C. Para obter a observação mais precisa da dinâmica proteína-membrana, recomenda-se manter as células em um tampão contendo HEPES e substituir a amostra a cada hora. Alternativamente, a janela experimental poderia ser estendida realizando-se os experimentos em uma câmara de incubação celular, ou seja, a uma temperatura constante de 37 °C com 5% de CO2. Além disso, a combinação dessa abordagem com outras técnicas de imagem, como a microscopia de reconstrução óptica estocástica (STORM), poderia fornecer uma compreensão mais profunda da função biofísica e da interação de proteínas-chave envolvidas no reparo de membrana em nível de molécula única. Isso poderia fornecer informações detalhadas sobre o local da lesão, incluindo a geometria da ferida e a localização das proteínas da anexina, bem como identificar outros atores-chave envolvidos no reparo da superfície da membrana.
Para alcançar a máxima eficácia e precisão na indução de lesão de membrana, é imperativo verificar a localização do foco do laser antes de cada experimento e garantir que a posição axial do foco do laser coincida com o foco confocal. Esse alinhamento otimiza a intensidade durante a aquisição de AuNP, o que leva a um aumento máximo da temperatura local e consequente lesão da membrana com menor potência do laser. Este processo é executado manualmente e, portanto, suscetível à variabilidade na eficiência de ruptura da membrana, pois o foco é traduzido manualmente para uma posição que coincide com a localização da partícula. Em microscópios que não possuem um modo de reflexão, como em alguns sistemas comerciais, a co-localização do foco do laser e da partícula pode ser um desafio. Nesses casos, modos de imagem alternativos (por exemplo, campo brilhante) podem ser empregados, e uma varredura raster lenta pode ser realizada em torno da posição esperada da partícula. Deve-se notar que a baixa potência do laser provavelmente induzirá apenas a permeabilização da membrana, enquanto a alta potência do laser pode gerar temperaturas ao redor do NP que excedem o ponto de ebulição da água, mesmo que a superfície do vidro tenha um efeito de resfriamento. Estima-se que a formação de nanobolhas ao redor dos NPs ocorra entre 200 °C e 300 °C25,48, onde o calor explosivo pode resultar tanto no deslocamento das partículas do foco do laser quanto na fragmentação das partículas. Além disso, a formação de nano ou microbolhas durante o aquecimento representa um desafio para este método. Como as interfaces de ar desumedecem as membranas e podem causar desestabilização proteica, o que é indesejável, é imperativo limitar o aquecimento ao investigar o reparo da membrana. Notavelmente, nanocascas de ouro não toleram altas temperaturas e se degradam nessas condições, como demonstrado por microscopia de alta resolução58.
Este artigo fornece um protocolo detalhado para o uso de termoplasmônicos para realizar punções altamente localizadas em membranas, que é aplicável tanto a células quanto a membranas modelo. Para reduzir ainda mais a extensão do aquecimento, nanopartículas menores ressonantes com luz NIR podem ser utilizadas, permitindo punções intracelulares em endossomos, no retículo endoplasmático e no envelope nuclear. Tais nanopartículas, incluindo bastões e nanomatryoshkas48, podem ser usadas para investigar o reparo do envelope nuclear visando nanopartículas de ouro endocitosadas que são prontamente absorvidas na superfície celular e trafegadas em direção ao núcleo69. De modo geral, essa técnica permite a identificação e o exame dos principais componentes moleculares envolvidos na RPM, elucidando sua função e papel biofísicos, preservando a viabilidade das células.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Gostaríamos de agradecer a Jesper Nylandsted por nos fornecer proteínas recombinantes de anexina e plasmídeos que codificam para anexinas. Este trabalho foi financiado pelo Conselho Dinamarquês de Pesquisa Independente, Ciências Naturais (DFF-4181-00196), pelo Programa de Sinergia Interdisciplinar da Fundação Novo Nordisk 2018 (NNF18OC0034936), pelo Comitê Científico da Sociedade Dinamarquesa de Câncer (R90-A5847-14-S2), pela Fundação Lundbeck (R218-2016-534) e pelo Centro de Excelência da Fundação Lundbeck (Biomembranas em Nanomedicina).
Materials
| 1064 nm trapping laser | Spectra Physics | N/A | Spectra Physics J201-BL-106C, Nd: YVO4 NIR laser |
| 160 nm Gold Nanoshells | NanoComposix | NCXGSIR150 | |
| 200 nm Gold Nanoparticles | BBI Solutions | EM.GC200/7 | |
| 35 mm glass surface MatTex microwell | MATTEK | P35G-1.5-14-C | |
| Amber-glass vials | Supelco Sigma Aldrich | 243438 | |
| Annexin A2 plasmids | N/A | N/A | Received from our collaborator at the Danish Cancer Research Center |
| Annexin A4 recombinant-protein | N/A | N/A | N-terminal GFP tagged ANXA4 received from our collaborator at the Danish Cancer Research Center |
| Annexin A5 recombinant-protein | N/A | N/A | N-terminal GFP tagged ANXA5 received from our collaborator at the Danish Cancer Research Center |
| beta-casein | Sigma Life Science | C6905-1G | |
| CaCl2 | Suprlco (sigma Aldrich) | 10035-04-8 | |
| Centrifuge 5702 | Eppendorf | 5702 | |
| Chloroform | VWR Chemicals | 67-66-3 | |
| Culture dish (Nunclon Delta Surface) | Thermo scientific | 150460 | |
| DID cell-labelling Solution | Invitrogen | 7757 | |
| Distilled water | Gibco | 15230-089 | |
| DOPC | Avanti Polar Lipids | 850375C | Dissolved in chloroform |
| DOPS | Avanti Polar Lipids | 840035C | Dissolved in chloroform |
| Dulbecco's Modified Eage's Medium | Thermo Fisher Scientific | 11995065 | |
| FIJI ImageJ distribution | ImageJ2 | N/A | |
| GCaMP6s-CAAX | N/A | Received from our collaborator at the Danish Cancer Research Center | |
| Gibco Fetal Bovine Serum | Fisher Scientific | 11573397 | 10% of the culture medium |
| Glucose | PROLABO | 24 374.297 | |
| Hamilton syringes | Hamilton Company | N/A | 50 and 500 microliters |
| Harrick Plasma Cleaner PDG-002 | Harrick Plasma | N/A | |
| HEK293T cells | N/A | Received from our collaborator at the Danish Cancer Research Center | |
| Leica Acousto-Optical Beam Splitter (AOBS) | Leica | N/A | |
| Leica PL APO 63x water immersion objective, NA = 1.2 | Leica | N/A | |
| Leica SP5 confocal scanning microscope | Leica | N/A | |
| Lipofectamine | Fisher Scientific | 15338030 | |
| MatLab | The Mathworks, Inc., Natick, Massachusetts, United States | N/A | |
| NaCl | VWR Chemicals | 7647-14-5 | |
| Opti-MEM Reduced-Serum Medium | Thermo Fisher Scientific | 11058021 | |
| Parafilm | Bemis | PM-992 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 1% of the culture medium |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | 10010023 | |
| Piezoelectric stage (PI 731.20) | Physik Instrumente (Germany) | N/A | |
| Poly-L-Lysine | Sigma-Aldrich | P8920-100ML | 0.01-0.1% for coating |
| Polyvinyl alcohol | Sigma-Aldrich | 363065-25G | |
| round glass slide 25 mm Ø | VWR | 631-1584 | |
| Sonicator Brandson 2800 | Brandson | N/A | |
| sucrose | Sigma Life Science | 57-50-1 | |
| T25 tissue culture flask | Falcon | 353108 | Blue Vented cap |
| Tris-HCl | Invitrogen | 15567-027 | |
| TrypLE | Thermo Fisher Scientific | A1285901 | |
| Trypsin-EDTA | Fisher Scientific | 11590626 | |
| VWR Mixer mini vortex 230V EU | VWR | 12620-84 | ECN: 444-2790, SN: 150713022 |
References
- Bendix, P. M., et al. Interdisciplinary synergy to reveal mechanisms of annexin-mediated plasma membrane shaping and repair. Cells. 9 (4), 1029 (2020).
- Gajic, O., Lee, J., Doerr, C. H., Berrios, J. C., Myers, J. L., Hubmayr, R. D. Ventilator-induced Cell Wounding and Repair in the Intact Lung. American Journal of Respiratory and Critical Care Medicine. 167, 1057-1063 (2003).
- McNeil, P. L., Khakee, R. Disruptions of muscle fiber plasma membranes. Role in exercise-induced damage. The American Journal of Pathology. 140 (5), 1097-1109 (1992).
- Yu, Q. C., McNeil, P. L. Transient disruptions of aortic endothelial cell plasma membranes. The American Journal of Pathology. 141 (6), 1349-1360 (1992).
- Boye, T. L., et al. Annexin A4 and A6 induce membrane curvature and constriction during cell membrane repair. Nature Communications. 8, 1623 (2017).
- Bischofberger, M., Gonzalez, M. R., van der Goot, F. G. Membrane injury by pore-forming proteins. Current Opinion in Cell Biology. 21, 589-595 (2009).
- Tang, S. K. Y., Marshall, W. F. Self-repairing cells. Science (New York, N.Y.). 356, 1022-1025 (2017).
- Abreu-Blanco, M. T., Verboon, J. M., Parkhurst, S. M. Single cell wound repair: Dealing with life’s little traumas. Bioarchitecture. 1, 114-121 (2011).
- Sønder, S. L., et al. Annexin A7 is required for ESCRT III-mediated plasma membrane repair. Scientific Reports. 9, 6726 (2019).
- Andrews, N. W., Almeida, P. E., Corrotte, M. Damage control: cellular mechanisms of plasma membrane repair. Trends in Cell Biology. 24 (12), 734-742 (2014).
- Idone, V., Tam, C., Goss, J. W., Toomre, D., Pypaert, M., Andrews, N. W. Repair of injured plasma membrane by rapid Ca2+-dependent endocytosis. The Journal of Cell Biology. 180 (5), 905-914 (2008).
- Lauritzen, S. P., Boye, T. L., Nylandsted, J. Annexins are instrumental for efficient plasma membrane repair in cancer cells. Seminars in Cell & Developmental Biology. 45, 32-38 (2015).
- Häger, S. C., Nylandsted, J. Annexins: players of single cell wound healing and regeneration. Communicative & Integrative Biology. 12 (1), 162-165 (2019).
- Jaiswal, J. K., et al. S100A11 is required for efficient plasma membrane repair and survival of invasive cancer cells. Nature Communications. 5, 3795 (2014).
- Draeger, A., Monastyrskaya, K., Babiychuk, E. B. Plasma membrane repair and cellular damage control: The annexin survival kit. Biochemical Pharmacology. 81 (6), 703-712 (2011).
- Moreno-Pescador, G. S., et al. Thermoplasmonic nano-rupture of cells reveals annexin V function in plasma membrane repair. Nanoscale. 14 (21), 7778-7787 (2022).
- Zhivotovsky, B., Orrenius, S. Calcium and cell death mechanisms: A perspective from the cell death community. Cell Calcium. 50 (3), 211-221 (2011).
- Gerke, V., Moss, S. E. Annexins: From structure to function. Physiological Reviews. 82 (2), 331-371 (2002).
- Idone, V., Tam, C., Andrews, N. W. Two-way traffic on the road to plasma membrane repair. Trends in Cell Biology. 18 (11), 552-559 (2008).
- Boye, T. L., et al. Annexins induce curvature on free-edge membranes displaying distinct morphologies. Scientific Reports. 8, 10309 (2018).
- Bouter, A., et al. Annexin-A5 assembled into two-dimensional arrays promotes cell membrane repair. Nature Communications. 2, 270 (2011).
- Boye, T. L., Nylandsted, J. Annexins in plasma membrane repair. Biological Chemistry. 397 (10), 961-969 (2016).
- Weinberger, A., et al. Gel-assisted formation of giant unilamellar vesicles. Biophysical Journal. 105 (1), 154-164 (2013).
- Numata, T., Tatsuta, H., Morita, Y., Otani, Y., Umeda, N. Localized thermal processing with a laser-trapped and heated metal nanoparticle. IEEJ Transactions on Electrical and Electronic Engineering. 2, 398-401 (2007).
- Bendix, P. M., Reihani, S. N. S., Oddershede, L. B. Direct measurements of heating by electromagnetically trapped gold nanoparticles on supported lipid bilayers. ACS Nano. 4 (4), 2256-2262 (2010).
- Kyrsting, A., Bendix, P. M., Stamou, D. G., Oddershede, L. B. Heat profiling of three-dimensionally optically trapped gold nanoparticles using vesicle cargo release. Nano Letters. 11 (2), 888-892 (2011).
- Andersen, T., Kyrsting, A., Bendix, P. M. Local and transient permeation events are associated with local melting of giant liposomes. Soft Matter. 10 (24), 4268-4274 (2014).
- Bahadori, A., Oddershede, L. B., Bendix, P. M. Hot-nanoparticle-mediated fusion of selected cells. Nano Research. 10, 2034-2045 (2017).
- Rørvig-Lund, A., Bahadori, A., Semsey, S., Bendix, P. M., Oddershede, L. B. Vesicle fusion triggered by optically heated gold nanoparticles. Nano Letters. 15 (6), 4183-4188 (2015).
- Moreno-Pescador, G., Arastoo, M. R., Ruhoff, V. T., Chiantia, S., Daniels, R., Bendix, P. M. Thermoplasmonic vesicle fusion reveals membrane phase segregation of influenza spike proteins. Nano Letters. 23 (8), 3377-3384 (2023).
- Bahadori, A., Lund, A. R., Semsey, S., Oddershede, L. B., Bendix, P. M. Controlled cellular fusion using optically trapped plasmonic nano-heaters. SPIE Proceedings. SPIE 9922, Optical Trapping and Optical Micromanipulation XIII. 992211, (2016).
- Bahadori, A., Moreno-Pescador, G., Oddershede, L. B., Bendix, P. M. Remotely controlled fusion of selected vesicles and living cells: a key issue review. Reports on Progress in Physics. 81 (3), 32602 (2018).
- Moreno-Pescador, G., Arastoo, M. R., Chiantia, S., Daniels, R., Bendix, P. M. Thermoplasmonic induced vesicle fusion for investigating membrane protein phase affinity. bioRxiv. , (2022).
- Pescador, G. S. M., et al. Investigating plasma-membrane repair employing thermoplasmonics. Biophysical Journal. 120 (3), 45A (2021).
- Moreno-Pescador, G. S., Qoqaj, I., Thusgaard Ruhoff, V., Iversen, J., Nylandsted, J., Bendix, P. M. Effect of local thermoplasmonic heating on biological membranes. SPIE 11083, Optical Trapping and Optical Micromanipulation XVI. 110830M, (2019).
- Bement, W. M., Mandato, C. A., Kirsch, M. N. Wound-induced assembly and closure of an actomyosin purse string in Xenopus oocytes. Current Biology. 9 (11), 579-587 (1999).
- Weisleder, N., et al. Recombinant MG53 protein modulates therapeutic cell membrane repair in treatment of muscular dystrophy. Science Translational Medicine. 4 (139), 139ra85 (2012).
- Sudji, I. R., Subburaj, Y., Frenkel, N., García-Sáez, A. J., Wink, M. Membrane disintegration caused by the steroid saponin digitonin is related to the presence of cholesterol. Molecules. 20 (11), 20146-20160 (2015).
- Babiychuk, E. B., Monastyrskaya, K., Potez, S., Draeger, A. Intracellular Ca2+ operates a switch between repair and lysis of streptolysin O-perforated cells. Cell Death & Differentiation. 16, 1126-1134 (2009).
- Nygård Skalman, L., Holst, M. R., Larsson, E., Lundmark, R. Plasma membrane damage caused by listeriolysin O is not repaired through endocytosis of the membrane pore. Biology Open. 7 (10), bio035287 (2018).
- Swaggart, K. A., et al. Annexin A6 modifies muscular dystrophy by mediating sarcolemmal repair. Proceedings of the National Academy of Sciences of the United States of America. 111, 6004-6009 (2014).
- Yeheskely-Hayon, D., Minai, L., Golan, L., Dann, E. J., Yelin, D. Optically induced cell fusion using bispecific nanoparticles. Small. 9 (22), 3771-3777 (2013).
- Minai, L., Yeheskely-Hayon, D., Golan, L., Bisker, G., Dann, E. J., Yelin, D. Optical nanomanipulations of malignant cells: Controlled cell damage and fusion. Small. 8 (11), 1732-1739 (2012).
- Lukianova-Hleb, E., et al. Plasmonic nanobubbles as transient vapor nanobubbles generated around plasmonic nanoparticles. ACS Nano. 4 (4), 2109-2123 (2010).
- Vogel, A., Noack, J., Hüttman, G., Paltauf, G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B. 81, 1015-1047 (2005).
- Baffou, G., Polleux, J., Rigneault, H., Monneret, S. Super-heating and micro-bubble generation around plasmonic nanoparticles under cw illumination. Journal of Physical Chemistry C. 118 (9), 4890-4898 (2014).
- Sasikumar, K., Liang, Z., Cahill, D. G., Keblinski, P. Curvature induced phase stability of an intensely heated liquid. Journal of Chemical Physics. 140 (23), 234506 (2014).
- Jauffred, L., Samadi, A., Klingberg, H., Bendix, P. M., Oddershede, L. B. Plasmonic heating of nanostructures. Chemical Reviews. 119 (13), 8087-8130 (2019).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nature Methods. 5 (6), 491-505 (2008).
- Bendix, P. M., Jauffred, L., Norregaard, K., Oddershede, L. B. Optical trapping of nanoparticles and quantum dots. IEEE Journal of Selected Topics in Quantum Electronics. 20, 15-26 (2014).
- Samadi, A., Bendix, P. M., Oddershede, L. B. Optical manipulation of individual strongly absorbing platinum nanoparticles. Nanoscale. 46, 18449-18455 (2017).
- Jørgensen, J. T., Norregaard, K., Tian, P., Bendix, P. M., Kjaer, A., Oddershede, L. B. Single particle and PET-based platform for identifying optimal plasmonic nano-heaters for photothermal cancer therapy. Scientific Reports. 6, 30076 (2016).
- Goldenberg, H., Tranter, C. J. Heat flow in an infinite medium heated by a sphere. British Journal of Applied Physics. 3 (9), 296-298 (1952).
- Eustis, S., El-Sayed, M. A. Why gold nanoparticles are more precious than pretty gold: Noble metal surface plasmon resonance and its enhancement of the radiative and nonradiative properties of nanocrystals of different shapes. Chemical Society Reviews. 35, 209-217 (2006).
- Landau, L. D., Lifshitz, E. M. . Fluid Mechanics: Landau and Lifshitz: Course of Theoretical Physics. 6, (2013).
- Niederauer, C., Seynen, M., Zomerdijk, J., Kamp, M., Ganzinger, K. A. The K2: Open-source simultaneous triple-color TIRF microscope for live-cell and single-molecule imaging. HardwareX. 13, e00404 (2023).
- Richardson, A. C., Reihani, N., Oddershede, L. B. Combining confocal microscopy with precise force-scope optical tweezers. SPIE Proceedings:SPIE 6326, Optical Trapping and Optical Micromanipulation III. 632628, (2006).
- Samadi, A., Klingberg, H., Jauffred, L., Kjær, A., Bendix, P. M., Oddershede, L. B. Platinum nanoparticles: a non-toxic, effective and thermally stable alternative plasmonic material for cancer therapy and bioengineering. Nanoscale. 10 (19), 9097-9107 (2018).
- . Available from: https://www.thermofisher.com/order/catalog/product/A7816 (2023)
- Kreibig, U., Vollmer, M. Theoretical considerations. In: Optical Properties of Metal Clusters. 25, (1995).
- Mie, G. Beiträge zur Optik trüber Medien, speziell kolloidaler Metallösungen. Annalen der Physik. 330 (3), 377-445 (1908).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Klenow, M. B., Heitmann, A. S. B., Nylandsted, J., Simonsen, A. C. Timescale of hole closure during plasma membrane repair estimated by calcium imaging and numerical modeling. Scientific Reports. 11, 4226 (2021).
- Li, T., Wu, X., Liu, F., Li, N. Analytical methods based on the light-scattering of plasmonic nanoparticles at the single particle level with dark-field microscopy imaging. Analyst. 142 (2), 248-256 (2017).
- Gibbs-Flournoy, E. A., Bromberg, P. A., Hofer, T. P. J., Samet, J. M., Zucker, R. M. Darkfield-Confocal Microscopy detection of nanoscale particle internalization by human lung cells. Particle and Fibre Toxicology. 8 (1), 2 (2011).
- Taylor, R. W., Sandoghdar, V. Interferometric scattering microscopy: Seeing single nanoparticles and molecules via Rayleigh scattering. Nano Letters. 19 (8), 4827-4835 (2019).
- Wu, Y., Ali, M. R. K., Chen, K., Fang, N., El-Sayed, M. A. Gold nanoparticles in biological optical imaging. Nano Today. 24, 120-140 (2019).
- Klingberg, H., Oddershede, L. B., Loeschner, K., Larsen, E. H., Loft, S., Møller, P. Uptake of gold nanoparticles in primary human endothelial cells. Toxicology Research. 4 (3), 566-666 (2015).

