Un enfoque termoplasmónico para investigar la reparación de la membrana plasmática en células vivas y membranas modelo
Summary
El método de punción termoplasmónica integra microscopía confocal, pinzas ópticas y nanopartículas de oro para estudiar las respuestas de las proteínas durante la reparación de la membrana plasmática en células y vesículas unilamelares gigantes. La técnica permite la punción rápida y localizada de la membrana, lo que permite la identificación de proteínas clave y sus funciones en la intrincada maquinaria de reparación de la membrana plasmática.
Abstract
La membrana celular es crucial para la supervivencia celular, y garantizar su integridad es esencial, ya que la célula experimenta lesiones a lo largo de todo su ciclo de vida. Para evitar daños en la membrana, las células han desarrollado mecanismos eficientes de reparación de la membrana plasmática. Estos mecanismos de reparación pueden estudiarse mediante la combinación de microscopía confocal y termoplasmónica a nanoescala para identificar e investigar el papel de proteínas clave, como las anexinas, implicadas en la reparación de la superficie en células vivas y sistemas modelo de membrana.
El método de punción emplea un láser para inducir un calentamiento altamente localizado tras la irradiación de nanopartículas. El uso de luz infrarroja cercana minimiza la fototoxicidad en la muestra biológica, mientras que la mayor parte de la absorción tiene lugar en la nanopartícula plasmónica resonante en el infrarrojo cercano. Este método termoplasmónico se ha utilizado para posibles investigaciones fototérmicas y biofísicas con el fin de mejorar la comprensión de los mecanismos intracelulares y las respuestas celulares a través de estudios de fusión celular y de vesículas. El enfoque ha demostrado ser complementario a los métodos existentes para la disrupción de la membrana, como las lesiones inducidas mecánica, química u ópticamente, y proporciona un alto nivel de control al infligir lesiones extremadamente localizadas. El alcance de la lesión se limita a la proximidad de la nanopartícula esférica, y no se produce ningún daño perjudicial a lo largo de la trayectoria del haz a diferencia de los láseres pulsados que utilizan diferentes longitudes de onda. A pesar de ciertas limitaciones, como la formación de nanoburbujas, el método termoplasmónico ofrece una herramienta única para investigar las respuestas celulares en la reparación de la membrana plasmática en un entorno casi nativo sin comprometer la viabilidad celular.
Cuando se integra con la microscopía confocal, el método de punción puede proporcionar una comprensión mecanicista de la dinámica de la membrana en sistemas de membrana modelo, así como información cuantitativa sobre las respuestas de las proteínas al daño de la membrana, incluido el reclutamiento de proteínas y su función biofísica. En general, la aplicación de este método a sistemas modelo reducidos puede mejorar nuestra comprensión de la intrincada maquinaria de reparación de la membrana plasmática en las células vivas.
Introduction
La membrana celular, que sirve como barrera física y plataforma de señalización, es vitalpara la supervivencia celular. A lo largo de todo su ciclo celular, la membrana plasmática (PM) está sometida a daños, como lesiones mecánicas 2,3,4,5 y químicas6 inducidas por estrés. Para mantener la integridad de la membrana y garantizar la supervivencia celular, la célula ha desarrollado mecanismos robustos de reparación de la membrana plasmática (PMR). Estos mecanismos dependen de diversas estrategias, como la reorganización del citoesqueleto, la fusión de membranas y las estrategias de reemplazo de membranas 7,8,9,10,11, todas ellas basadas en el reclutamiento de proteínas específicas. En particular, los miembros de la familia de proteínas de la anexina han sido identificados como proteínas clave asociadas con los procesos de PMR 1,9,12,13,14,15,16. Después de la lesión por PM, la célula experimenta una afluencia de iones de calcio (Ca2+), lo que representa una amenaza inmediata para la supervivencia de la célula17. En respuesta a la afluencia de Ca2+, las proteínas de anexina, que se encuentran predominantemente en el citosol, se unen a la valva interna de la membrana plasmática dañada como parte de las estrategias de PMR18. La anexina A2 (ANXA2) fue uno de los primeros miembros de la familia de las anexinas en asociarse con PMR en la distrofia muscular deficiente en disferlina y se sugirió que mediaba la reparación mediante la fusión de vesículas intracelulares a la PM cerca del sitio de la lesión 5,19,20,21. Posteriormente, se han atribuido varias funciones a las anexinas22, y su papel en la PMR ha atraído una mayor atención en los últimos 20 años. Sin embargo, el papel exacto de las anexinas en la PMR aún no se comprende completamente 15,18,21,22.
Este artículo propone un método para investigar la interacción proteína-membrana y la dinámica de la membrana de una manera controlada y altamente localizada, utilizando una combinación de microscopía confocal, pinzas ópticas y nanopartículas de oro (AuNPs). Este método permite el estudio cuantitativo de las interacciones entre proteínas, lípidos y moléculas pequeñas en respuesta al daño de la membrana y la afluencia de Ca2+ . A pesar de la complejidad y multiplicidad de componentes involucrados en el proceso de reparación de la membrana, se han empleado sistemas de membrana simplificados que imitan la membrana plasmática para obtener una comprensión mecanicista más profunda de la dinámica de la membrana y la respuesta de las proteínas de anexina a la disrupción de la membrana16. Se eligieron vesículas lipídicas unilamelares gigantes (GUV) como sistema modelo de membranas con una composición lipídica especificada. Los GUV se generaron utilizando el método de hidratación asistida por gel, específicamente la hidratación en gel de alcohol polivinílico, según lo descrito por Weinberger et al.23, lo que permitió la encapsulación eficiente de las anexinas en los GUV.
La utilización de la irradiación láser de infrarrojo cercano (NIR) sobre nanopartículas metálicas (NP) induce un calentamiento significativo de la NP, lo que la convierte en un método eficaz para establecer una fuente de calor local explotada en aplicaciones biomédicas24. El método se utilizó inicialmente para medir directamente la temperatura que rodea a un solo AuNP en ensayos biomiméticos 2D y 3D. En estos ensayos25,26, las nanopartículas plasmónicas se irradiaron sobre una bicapa lipídica soportada o se atraparon ópticamente cerca de los GUV que experimentan una transición de fase térmica local tras el calentamiento local, lo que permite cuantificar y controlar el perfil de temperatura exacto alrededor de la partícula. Este perfil de temperatura de referencia se ha utilizado cuando se investigan o manipulan muestras biológicas. Nuevos avances en el método han facilitado la inducción de poros nanoscópicos en las membranas27, lo que permite la fusión de vesículas y células28,29. Otros estudios han investigado el comportamiento de las proteínas de membrana periférica en GUVs29 y proteínas transmembrana30 mediante la creación de nuevas vesículas híbridas, mientras que la administración de fármacos específicos de células también se ha explorado para controlar y estudiar las respuestas celulares o la expresión génica 28,29,31,32,33. Recientemente, el método se ha utilizado para investigar las respuestas de las proteínas al daño de la membrana 32,34,35.
Existen varios métodos para interrumpir la membrana plasmática con el fin de explorar las respuestas celulares y la reparación de la membrana. Estos incluyen punciones con microagujas, agitación de microperlas y raspado celular, todos los cuales pueden alterar mecánicamente la membrana celular 14,36,37. El daño inducido químicamente se puede lograr mediante la adición de detergentes 5,38 o toxinas bacterianas39,40 que desestabilizan la bicapa lipídica y generan poros de membrana a través de la membrana plasmática. Además, las lesiones inducidas ópticamente por láseres de onda continua y pulsados se han utilizado para estudiar los componentes de PMR, como las proteínasde anexina 5,14,21,41, en combinación con nanopartículas plasmónicas 42,43,44,45. A pesar de la eficiencia de los láseres pulsados de alta potencia, pueden causar lesiones y daños significativos en el interior de la célula a lo largo de la trayectoria del haz. Además, los cambios detallados que se producen en la materia biológica tras la irradiación láser pulsada y si crea un poro bien definido aún no se han investigado. En este artículo se presenta un método alternativo que emplea termoplasmónica para inducir agujeros nanoscópicos en el PM de forma controlada34,35 sin causar daños significativos a las estructuras internas. Esto se logra mediante la exposición de NPs plasmónicas a un láser NIR altamente enfocado, lo que resulta en un aumento de temperatura extremadamente localizado que puede alcanzar fácilmente temperaturas superiores a 200 °C, lo que puede conducir a pequeñas explosiones nanoscópicas 25,46,47. Este proceso se puede controlar ajustando la intensidad del láser, así como el tamaño, la forma y la composición de los NP48. Al emplear esta técnica, los investigadores pueden explorar el papel de las proteínas en la reparación de PM en células vivas, lo que podría ayudar a abordar algunas de las preguntas sin respuesta sobre la participación de las proteínas de anexina en la reparación de la membrana sin comprometer la viabilidad celular.
El atrapamiento óptico de nanopartículas plasmónicas ha sido bien establecido por estudios previos 25,49,50,51,52; sin embargo, se pueden obtener conocimientos adicionales sobre las propiedades termoplasmónicas de las nanopartículas 53,54,55 en los materiales suplementarios (Archivo Suplementario 1). El método termoplasmónico se puede utilizar para crear agujeros nanoscópicos en el PM con el fin de estudiar la respuesta celular y los mecanismos de reparación. Más precisamente, la punción se puede lograr mediante el calentamiento óptico de AuNPs en las proximidades de la membrana, como se muestra en las Figuras 1A y B. Esta punción localizada permite la entrada de Ca2+, que fue verificada por un sensor de calcio, activando así la maquinaria PMR. Para los experimentos con células vivas, se inmovilizaron AuNPs con un diámetro de 200 nm en la superficie debajo de la célula para monitorizar el papel de ANXA2 en PMR a través de microscopía confocal. El láser NIR (Figura 1A, B), con una longitud de onda de 1064 nm, irradia el AuNP, explotando sus propiedades plasmónicas (Figura 1C), lo que resulta en un calentamiento local sustancial (Figura 1D) en la ventana de transparencia biológica49 mientras causa un daño mínimo a la propia célula. La región de alta temperatura que rodea el AuNP disminuye rápidamente en un 30-40% a una distancia correspondiente al radio del NP, como se muestra en la Figura 1E, lo que permite una lesión extremadamente confinada en las tres dimensiones.
Expediente Complementario 1. Haga clic aquí para descargar este archivo.
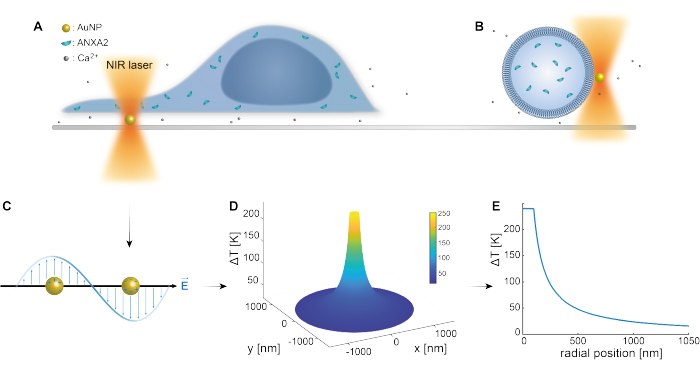
Figura 1: Esquema esquemático del método experimental. (A) las células transfectadas con ANXA están situadas encima de nanopartículas de oro inmovilizadas (AuNPs) en la superficie, o (B) vesículas unilamelares gigantes (GUVs) con ANXAs encapsuladas están suspendidas en un medio que contiene AuNPs. (C) Un solo AuNP es irradiado por la trampa óptica NIR, donde la interacción entre el campo electromagnético entrante y los electrones de conducción conduce a la oscilación colectiva de electrones dentro del NP. (D) Este proceso da como resultado un aumento de temperatura altamente confinado pero significativo. Para estimar la temperatura en la superficie del NP, se emplea la teoría de Mie, y se calcula un perfil de temperatura (E) para un AuNP con un diámetro de 200 nm y una intensidad láser I = 6,36 x 108 W/cm2. Haga clic aquí para ver una versión más grande de esta figura.
Para minimizar el efecto térmico sobre la membrana celular, las AuNP solo se irradian durante ~ 1 segundo. Esto provoca un estallido transitorio y local de calentamiento, lo que reduce el daño a las proteínas que normalmente requieren más tiempo para desplegarse. Tras la punción de la membrana, las proteínas de anexina se reclutan en una fracción de segundo y, en pocos segundos, se forma un andamio en forma de anillo de anexina alrededor del sitio de la lesión (Figura 2). Este enfoque también se ha aplicado para explorar la participación de ANXA5 tanto en células vivas como en membranas modelo16 en un esfuerzo por arrojar luz sobre el esquema completo de los procesos de reparación. Si bien el enfoque principal se ha centrado en el reclutamiento correlacionado de varias proteínas de anexina, los aspectos biofísicos del mecanismo de reparación aún no se han dilucidado.
Para implementar completamente el método propuesto, se requieren tres componentes clave: microscopía confocal, pinzas ópticas y nanopartículas metálicas. Las pinzas ópticas se utilizan para atrapar AuNPs, y su construcción se puede lograr siguiendo el procedimiento descrito por Neuman et al.49. Sin embargo, si la construcción de una pinza óptica resulta ser demasiado difícil, se puede utilizar un láser NIR bien enfocado para irradiar AuNPs inmovilizadas debajo de las células. Si bien se eligieron AuNP esféricas para este protocolo, también se pudo utilizar una variedad de partículas plasmónicas con espectros de absorción sintonizables para lograr un gradiente de temperatura altamente localizado dentro de la región NIR48.
La obtención de imágenes de fluorescencia es necesaria para observar el papel de las proteínas marcadas con fluorescencia y, por lo tanto, la microscopía de reflexión interna total (TIRF)56 podría considerarse como una alternativa a la obtención de imágenes confocal. Sin embargo, esta técnica solo permite obtener imágenes de superficie y no sería compatible con los experimentos de vesículas de membrana modelo. En consecuencia, tanto las pinzas ópticas como el microscopio confocal son esenciales para la localización precisa de la nanopartícula y la investigación detallada del área local que rodea la lesión celular. Para irradiar eficazmente la nanopartícula con un foco láser limitado por difracción, es necesario visualizar la nanopartícula. Esto se puede lograr de manera óptima mediante microscopía de reflexión, que es una característica de imagen estándar de los microscopios confocales Leica. Sin embargo, si no se dispone de imágenes de reflexión o dispersión, se pueden considerar métodos alternativos, como el marcaje fluorescente de AuNP menos eficiente.
En resumen, el método termoplasmónico altamente controlable y localizado presentado en este estudio tiene el potencial de servir como una excelente plataforma para investigar los componentes moleculares involucrados en las respuestas celulares y los mecanismos de reparación de PM en células vivas. Además de estudiar la respuesta de la proteína al daño por PM, este enfoque también se puede utilizar para perforar localmente vesículas, lo que permite una investigación de la respuesta de la proteína tanto en la dinámica proteína-proteína como en la proteína-membrana. Además, este método permite un análisis cuantitativo de las interacciones entre proteínas, lípidos y moléculas pequeñas cuando se rompen las membranas. En conjunto, estos avances tienen el potencial de arrojar luz sobre algunas de las preguntas no resueltas relacionadas con la intrincada y compleja maquinaria de reparación de membranas plasmáticas.
Protocol
Representative Results
Discussion
El estudio destaca el enfoque termoplasmónico como una técnica prometedora para explorar las respuestas de las proteínas en células vivas y modelar membranas después de la ruptura de la membrana. Este método no solo proporciona amplia información sobre el reclutamiento de proteínas, sino también sobre la función biofísica de las proteínas involucradas en la dinámica proteína-membrana. En consecuencia, facilita la identificación de los componentes moleculares responsables de la reparación de la superficie y avanza en la comprensión de la compleja pero vital maquinaria de la reparación de la membrana plasmática. Aunque existen varios métodos para inducir la disrupción de la membrana, como técnicas mecánicas, químicas y ópticas, estos métodos sufren de limitaciones, como no ser específicos de las células, generar múltiples lesiones en la membrana celular o causar un daño significativo a la membrana y ablar el material celular interno a lo largo de la trayectoria del láser cuando se utilizan láseres pulsados de alta potencia. Si bien la integración de la microscopía confocal y las pinzas ópticas ofrece la información más completa, también se podrían utilizar modalidades de imagen alternativas. Por ejemplo, dado que la obtención de imágenes de la nanopartícula plasmónica se consigue mediante microscopía de reflexión, un modo de imagen incorporado en los microscopios confocales Leica, se podrían emplear técnicas de imagen adicionales, como la microscopía de campo oscuro65,66, otros métodos de dispersión como iSCAT67,68 o el marcaje fluorescente de la nanopartícula, para la visualización de AuNP, aunque esto podría limitar la aplicabilidad del método.
El método presentado también es capaz de inducir agujeros nanoscópicos en membranas modelo, lo que permite investigar los efectos de sinergia entre diferentes anexinas. Esto se logra encapsulando anexinas recombinantes marcadas de manera diferente, por ejemplo, RFP y GFP, respectivamente, seguidas de punción termoplasmónica. Este sistema modelo proporciona información sobre cómo interactúan las anexinas con las membranas en las proximidades de los bordes libres, como se muestra en la Figura 2D. Sin embargo, a diferencia de lo que ocurre en las células, los agujeros infligidos a los GUV continúan expandiéndose, seguidos de la desestabilización de la vesícula. La obtención de imágenes de la evolución del agujero mediante microscopía confocal puede ser un reto debido a la rápida expansión del diámetro del agujero, pero puede lograrse capturando varias pilas z a lo largo del tiempo. Un método alternativo sería utilizar un disco giratorio confocal para obtener imágenes más rápidas. Además, el enfoque termoplasmónico suele producir un número limitado de resultados óptimos por hora cuando se aplica a células individuales o experimentos GUV, generalmente de dos a tres, a temperaturas de muestra entre 20 °C y 30 °C. Para obtener la observación más precisa de la dinámica proteína-membrana, se recomienda mantener las células en un tampón que contenga HEPES y reemplazar la muestra cada hora. Alternativamente, la ventana experimental podría ampliarse realizando los experimentos en una cámara de incubación celular, es decir, a una temperatura constante de 37 °C con 5% de CO2. Además, la combinación de este enfoque con otras técnicas de imagen, como la microscopía de reconstrucción óptica estocástica (STORM), podría proporcionar una comprensión más profunda de la función biofísica y la interacción de proteínas clave involucradas en la reparación de la membrana a nivel de una sola molécula. Esto podría proporcionar información detallada sobre el sitio de la lesión, incluida la geometría de la herida y la ubicación de las proteínas de anexina, así como identificar otros actores clave involucrados en la reparación de la superficie de la membrana.
Con el fin de lograr la máxima eficacia y precisión en la inducción de lesiones en la membrana, es imperativo verificar la ubicación del foco láser antes de cada experimento y asegurarse de que la posición axial del foco láser coincida con el foco confocal. Esta alineación optimiza la intensidad durante la obtención de imágenes de AuNP, lo que conduce a un aumento máximo de la temperatura local y la consiguiente lesión de la membrana a una potencia láser más baja. Este proceso se ejecuta manualmente y, por lo tanto, es susceptible a la variabilidad en la eficiencia de ruptura de la membrana, ya que el foco se traslada manualmente a una posición que coincide con la ubicación de la partícula. En los microscopios que carecen de un modo de reflexión, como en algunos sistemas comerciales, la colocalización del foco láser y la partícula puede ser un desafío. En tales casos, se pueden emplear modos de imagen alternativos (por ejemplo, campo claro) y se puede realizar un escaneo ráster lento alrededor de la posición esperada de la partícula. Cabe señalar que es probable que la baja potencia del láser induzca solo la permeabilización de la membrana, mientras que la alta potencia del láser puede generar temperaturas alrededor del NP que exceden el punto de ebullición del agua, incluso si la superficie del vidrio tiene un efecto de enfriamiento. Se estima que la formación de nanoburbujas alrededor de las NPs ocurre entre 200 °C y 300 °C25,48, donde el calor explosivo puede resultar en el desplazamiento de partículas del foco láser o en la fragmentación de partículas. Además, la formación de nano o microburbujas durante el calentamiento supone un reto para este método. Dado que las interfaces de aire deshumedecen las membranas y pueden causar la desestabilización de las proteínas, lo cual no es deseable, es imperativo limitar el calentamiento cuando se investiga la reparación de la membrana. En particular, las nanocapas de oro no toleran altas temperaturas y se degradarán en estas condiciones, como lo demuestra la microscopía de alta resolución58.
Este artículo proporciona un protocolo detallado para el uso de termoplasmónica para realizar punciones altamente localizadas en membranas, que es aplicable tanto a células como a membranas modelo. Para reducir aún más el grado de calentamiento, se pueden utilizar nanopartículas más pequeñas que resuenan con la luz NIR, lo que permite punciones intracelulares en los endosomas, el retículo endoplásmico y la envoltura nuclear. Estas nanopartículas, incluidos los bastones y las nanomatrioskas48, pueden utilizarse para investigar la reparación de la envoltura nuclear dirigiéndose a las nanopartículas de oro endocitadas que se absorben fácilmente en la superficie celular y se dirigen hacia el núcleo69. En general, esta técnica permite identificar y examinar los componentes moleculares clave implicados en la PMR, dilucidando su función biofísica y su papel, preservando al mismo tiempo la viabilidad de las células.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Queremos agradecer a Jesper Nylandsted por proporcionarnos proteínas de anexina recombinantes y plásmidos que codifican para las anexinas. Este trabajo fue financiado por el Consejo Danés para la Investigación Independiente, Ciencias Naturales (DFF-4181-00196), por el Programa de Sinergia Interdisciplinaria de la Fundación Novo Nordisk 2018 (NNF18OC0034936), el Comité Científico de la Sociedad Danesa del Cáncer (R90-A5847-14-S2), la Fundación Lundbeck (R218-2016-534) y por el Centro de Excelencia de la Fundación Lundbeck (Biomembranas en Nanomedicina).
Materials
| 1064 nm trapping laser | Spectra Physics | N/A | Spectra Physics J201-BL-106C, Nd: YVO4 NIR laser |
| 160 nm Gold Nanoshells | NanoComposix | NCXGSIR150 | |
| 200 nm Gold Nanoparticles | BBI Solutions | EM.GC200/7 | |
| 35 mm glass surface MatTex microwell | MATTEK | P35G-1.5-14-C | |
| Amber-glass vials | Supelco Sigma Aldrich | 243438 | |
| Annexin A2 plasmids | N/A | N/A | Received from our collaborator at the Danish Cancer Research Center |
| Annexin A4 recombinant-protein | N/A | N/A | N-terminal GFP tagged ANXA4 received from our collaborator at the Danish Cancer Research Center |
| Annexin A5 recombinant-protein | N/A | N/A | N-terminal GFP tagged ANXA5 received from our collaborator at the Danish Cancer Research Center |
| beta-casein | Sigma Life Science | C6905-1G | |
| CaCl2 | Suprlco (sigma Aldrich) | 10035-04-8 | |
| Centrifuge 5702 | Eppendorf | 5702 | |
| Chloroform | VWR Chemicals | 67-66-3 | |
| Culture dish (Nunclon Delta Surface) | Thermo scientific | 150460 | |
| DID cell-labelling Solution | Invitrogen | 7757 | |
| Distilled water | Gibco | 15230-089 | |
| DOPC | Avanti Polar Lipids | 850375C | Dissolved in chloroform |
| DOPS | Avanti Polar Lipids | 840035C | Dissolved in chloroform |
| Dulbecco's Modified Eage's Medium | Thermo Fisher Scientific | 11995065 | |
| FIJI ImageJ distribution | ImageJ2 | N/A | |
| GCaMP6s-CAAX | N/A | Received from our collaborator at the Danish Cancer Research Center | |
| Gibco Fetal Bovine Serum | Fisher Scientific | 11573397 | 10% of the culture medium |
| Glucose | PROLABO | 24 374.297 | |
| Hamilton syringes | Hamilton Company | N/A | 50 and 500 microliters |
| Harrick Plasma Cleaner PDG-002 | Harrick Plasma | N/A | |
| HEK293T cells | N/A | Received from our collaborator at the Danish Cancer Research Center | |
| Leica Acousto-Optical Beam Splitter (AOBS) | Leica | N/A | |
| Leica PL APO 63x water immersion objective, NA = 1.2 | Leica | N/A | |
| Leica SP5 confocal scanning microscope | Leica | N/A | |
| Lipofectamine | Fisher Scientific | 15338030 | |
| MatLab | The Mathworks, Inc., Natick, Massachusetts, United States | N/A | |
| NaCl | VWR Chemicals | 7647-14-5 | |
| Opti-MEM Reduced-Serum Medium | Thermo Fisher Scientific | 11058021 | |
| Parafilm | Bemis | PM-992 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 1% of the culture medium |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | 10010023 | |
| Piezoelectric stage (PI 731.20) | Physik Instrumente (Germany) | N/A | |
| Poly-L-Lysine | Sigma-Aldrich | P8920-100ML | 0.01-0.1% for coating |
| Polyvinyl alcohol | Sigma-Aldrich | 363065-25G | |
| round glass slide 25 mm Ø | VWR | 631-1584 | |
| Sonicator Brandson 2800 | Brandson | N/A | |
| sucrose | Sigma Life Science | 57-50-1 | |
| T25 tissue culture flask | Falcon | 353108 | Blue Vented cap |
| Tris-HCl | Invitrogen | 15567-027 | |
| TrypLE | Thermo Fisher Scientific | A1285901 | |
| Trypsin-EDTA | Fisher Scientific | 11590626 | |
| VWR Mixer mini vortex 230V EU | VWR | 12620-84 | ECN: 444-2790, SN: 150713022 |
References
- Bendix, P. M., et al. Interdisciplinary synergy to reveal mechanisms of annexin-mediated plasma membrane shaping and repair. Cells. 9 (4), 1029 (2020).
- Gajic, O., Lee, J., Doerr, C. H., Berrios, J. C., Myers, J. L., Hubmayr, R. D. Ventilator-induced Cell Wounding and Repair in the Intact Lung. American Journal of Respiratory and Critical Care Medicine. 167, 1057-1063 (2003).
- McNeil, P. L., Khakee, R. Disruptions of muscle fiber plasma membranes. Role in exercise-induced damage. The American Journal of Pathology. 140 (5), 1097-1109 (1992).
- Yu, Q. C., McNeil, P. L. Transient disruptions of aortic endothelial cell plasma membranes. The American Journal of Pathology. 141 (6), 1349-1360 (1992).
- Boye, T. L., et al. Annexin A4 and A6 induce membrane curvature and constriction during cell membrane repair. Nature Communications. 8, 1623 (2017).
- Bischofberger, M., Gonzalez, M. R., van der Goot, F. G. Membrane injury by pore-forming proteins. Current Opinion in Cell Biology. 21, 589-595 (2009).
- Tang, S. K. Y., Marshall, W. F. Self-repairing cells. Science (New York, N.Y.). 356, 1022-1025 (2017).
- Abreu-Blanco, M. T., Verboon, J. M., Parkhurst, S. M. Single cell wound repair: Dealing with life’s little traumas. Bioarchitecture. 1, 114-121 (2011).
- Sønder, S. L., et al. Annexin A7 is required for ESCRT III-mediated plasma membrane repair. Scientific Reports. 9, 6726 (2019).
- Andrews, N. W., Almeida, P. E., Corrotte, M. Damage control: cellular mechanisms of plasma membrane repair. Trends in Cell Biology. 24 (12), 734-742 (2014).
- Idone, V., Tam, C., Goss, J. W., Toomre, D., Pypaert, M., Andrews, N. W. Repair of injured plasma membrane by rapid Ca2+-dependent endocytosis. The Journal of Cell Biology. 180 (5), 905-914 (2008).
- Lauritzen, S. P., Boye, T. L., Nylandsted, J. Annexins are instrumental for efficient plasma membrane repair in cancer cells. Seminars in Cell & Developmental Biology. 45, 32-38 (2015).
- Häger, S. C., Nylandsted, J. Annexins: players of single cell wound healing and regeneration. Communicative & Integrative Biology. 12 (1), 162-165 (2019).
- Jaiswal, J. K., et al. S100A11 is required for efficient plasma membrane repair and survival of invasive cancer cells. Nature Communications. 5, 3795 (2014).
- Draeger, A., Monastyrskaya, K., Babiychuk, E. B. Plasma membrane repair and cellular damage control: The annexin survival kit. Biochemical Pharmacology. 81 (6), 703-712 (2011).
- Moreno-Pescador, G. S., et al. Thermoplasmonic nano-rupture of cells reveals annexin V function in plasma membrane repair. Nanoscale. 14 (21), 7778-7787 (2022).
- Zhivotovsky, B., Orrenius, S. Calcium and cell death mechanisms: A perspective from the cell death community. Cell Calcium. 50 (3), 211-221 (2011).
- Gerke, V., Moss, S. E. Annexins: From structure to function. Physiological Reviews. 82 (2), 331-371 (2002).
- Idone, V., Tam, C., Andrews, N. W. Two-way traffic on the road to plasma membrane repair. Trends in Cell Biology. 18 (11), 552-559 (2008).
- Boye, T. L., et al. Annexins induce curvature on free-edge membranes displaying distinct morphologies. Scientific Reports. 8, 10309 (2018).
- Bouter, A., et al. Annexin-A5 assembled into two-dimensional arrays promotes cell membrane repair. Nature Communications. 2, 270 (2011).
- Boye, T. L., Nylandsted, J. Annexins in plasma membrane repair. Biological Chemistry. 397 (10), 961-969 (2016).
- Weinberger, A., et al. Gel-assisted formation of giant unilamellar vesicles. Biophysical Journal. 105 (1), 154-164 (2013).
- Numata, T., Tatsuta, H., Morita, Y., Otani, Y., Umeda, N. Localized thermal processing with a laser-trapped and heated metal nanoparticle. IEEJ Transactions on Electrical and Electronic Engineering. 2, 398-401 (2007).
- Bendix, P. M., Reihani, S. N. S., Oddershede, L. B. Direct measurements of heating by electromagnetically trapped gold nanoparticles on supported lipid bilayers. ACS Nano. 4 (4), 2256-2262 (2010).
- Kyrsting, A., Bendix, P. M., Stamou, D. G., Oddershede, L. B. Heat profiling of three-dimensionally optically trapped gold nanoparticles using vesicle cargo release. Nano Letters. 11 (2), 888-892 (2011).
- Andersen, T., Kyrsting, A., Bendix, P. M. Local and transient permeation events are associated with local melting of giant liposomes. Soft Matter. 10 (24), 4268-4274 (2014).
- Bahadori, A., Oddershede, L. B., Bendix, P. M. Hot-nanoparticle-mediated fusion of selected cells. Nano Research. 10, 2034-2045 (2017).
- Rørvig-Lund, A., Bahadori, A., Semsey, S., Bendix, P. M., Oddershede, L. B. Vesicle fusion triggered by optically heated gold nanoparticles. Nano Letters. 15 (6), 4183-4188 (2015).
- Moreno-Pescador, G., Arastoo, M. R., Ruhoff, V. T., Chiantia, S., Daniels, R., Bendix, P. M. Thermoplasmonic vesicle fusion reveals membrane phase segregation of influenza spike proteins. Nano Letters. 23 (8), 3377-3384 (2023).
- Bahadori, A., Lund, A. R., Semsey, S., Oddershede, L. B., Bendix, P. M. Controlled cellular fusion using optically trapped plasmonic nano-heaters. SPIE Proceedings. SPIE 9922, Optical Trapping and Optical Micromanipulation XIII. 992211, (2016).
- Bahadori, A., Moreno-Pescador, G., Oddershede, L. B., Bendix, P. M. Remotely controlled fusion of selected vesicles and living cells: a key issue review. Reports on Progress in Physics. 81 (3), 32602 (2018).
- Moreno-Pescador, G., Arastoo, M. R., Chiantia, S., Daniels, R., Bendix, P. M. Thermoplasmonic induced vesicle fusion for investigating membrane protein phase affinity. bioRxiv. , (2022).
- Pescador, G. S. M., et al. Investigating plasma-membrane repair employing thermoplasmonics. Biophysical Journal. 120 (3), 45A (2021).
- Moreno-Pescador, G. S., Qoqaj, I., Thusgaard Ruhoff, V., Iversen, J., Nylandsted, J., Bendix, P. M. Effect of local thermoplasmonic heating on biological membranes. SPIE 11083, Optical Trapping and Optical Micromanipulation XVI. 110830M, (2019).
- Bement, W. M., Mandato, C. A., Kirsch, M. N. Wound-induced assembly and closure of an actomyosin purse string in Xenopus oocytes. Current Biology. 9 (11), 579-587 (1999).
- Weisleder, N., et al. Recombinant MG53 protein modulates therapeutic cell membrane repair in treatment of muscular dystrophy. Science Translational Medicine. 4 (139), 139ra85 (2012).
- Sudji, I. R., Subburaj, Y., Frenkel, N., García-Sáez, A. J., Wink, M. Membrane disintegration caused by the steroid saponin digitonin is related to the presence of cholesterol. Molecules. 20 (11), 20146-20160 (2015).
- Babiychuk, E. B., Monastyrskaya, K., Potez, S., Draeger, A. Intracellular Ca2+ operates a switch between repair and lysis of streptolysin O-perforated cells. Cell Death & Differentiation. 16, 1126-1134 (2009).
- Nygård Skalman, L., Holst, M. R., Larsson, E., Lundmark, R. Plasma membrane damage caused by listeriolysin O is not repaired through endocytosis of the membrane pore. Biology Open. 7 (10), bio035287 (2018).
- Swaggart, K. A., et al. Annexin A6 modifies muscular dystrophy by mediating sarcolemmal repair. Proceedings of the National Academy of Sciences of the United States of America. 111, 6004-6009 (2014).
- Yeheskely-Hayon, D., Minai, L., Golan, L., Dann, E. J., Yelin, D. Optically induced cell fusion using bispecific nanoparticles. Small. 9 (22), 3771-3777 (2013).
- Minai, L., Yeheskely-Hayon, D., Golan, L., Bisker, G., Dann, E. J., Yelin, D. Optical nanomanipulations of malignant cells: Controlled cell damage and fusion. Small. 8 (11), 1732-1739 (2012).
- Lukianova-Hleb, E., et al. Plasmonic nanobubbles as transient vapor nanobubbles generated around plasmonic nanoparticles. ACS Nano. 4 (4), 2109-2123 (2010).
- Vogel, A., Noack, J., Hüttman, G., Paltauf, G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B. 81, 1015-1047 (2005).
- Baffou, G., Polleux, J., Rigneault, H., Monneret, S. Super-heating and micro-bubble generation around plasmonic nanoparticles under cw illumination. Journal of Physical Chemistry C. 118 (9), 4890-4898 (2014).
- Sasikumar, K., Liang, Z., Cahill, D. G., Keblinski, P. Curvature induced phase stability of an intensely heated liquid. Journal of Chemical Physics. 140 (23), 234506 (2014).
- Jauffred, L., Samadi, A., Klingberg, H., Bendix, P. M., Oddershede, L. B. Plasmonic heating of nanostructures. Chemical Reviews. 119 (13), 8087-8130 (2019).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nature Methods. 5 (6), 491-505 (2008).
- Bendix, P. M., Jauffred, L., Norregaard, K., Oddershede, L. B. Optical trapping of nanoparticles and quantum dots. IEEE Journal of Selected Topics in Quantum Electronics. 20, 15-26 (2014).
- Samadi, A., Bendix, P. M., Oddershede, L. B. Optical manipulation of individual strongly absorbing platinum nanoparticles. Nanoscale. 46, 18449-18455 (2017).
- Jørgensen, J. T., Norregaard, K., Tian, P., Bendix, P. M., Kjaer, A., Oddershede, L. B. Single particle and PET-based platform for identifying optimal plasmonic nano-heaters for photothermal cancer therapy. Scientific Reports. 6, 30076 (2016).
- Goldenberg, H., Tranter, C. J. Heat flow in an infinite medium heated by a sphere. British Journal of Applied Physics. 3 (9), 296-298 (1952).
- Eustis, S., El-Sayed, M. A. Why gold nanoparticles are more precious than pretty gold: Noble metal surface plasmon resonance and its enhancement of the radiative and nonradiative properties of nanocrystals of different shapes. Chemical Society Reviews. 35, 209-217 (2006).
- Landau, L. D., Lifshitz, E. M. . Fluid Mechanics: Landau and Lifshitz: Course of Theoretical Physics. 6, (2013).
- Niederauer, C., Seynen, M., Zomerdijk, J., Kamp, M., Ganzinger, K. A. The K2: Open-source simultaneous triple-color TIRF microscope for live-cell and single-molecule imaging. HardwareX. 13, e00404 (2023).
- Richardson, A. C., Reihani, N., Oddershede, L. B. Combining confocal microscopy with precise force-scope optical tweezers. SPIE Proceedings:SPIE 6326, Optical Trapping and Optical Micromanipulation III. 632628, (2006).
- Samadi, A., Klingberg, H., Jauffred, L., Kjær, A., Bendix, P. M., Oddershede, L. B. Platinum nanoparticles: a non-toxic, effective and thermally stable alternative plasmonic material for cancer therapy and bioengineering. Nanoscale. 10 (19), 9097-9107 (2018).
- . Available from: https://www.thermofisher.com/order/catalog/product/A7816 (2023)
- Kreibig, U., Vollmer, M. Theoretical considerations. In: Optical Properties of Metal Clusters. 25, (1995).
- Mie, G. Beiträge zur Optik trüber Medien, speziell kolloidaler Metallösungen. Annalen der Physik. 330 (3), 377-445 (1908).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Klenow, M. B., Heitmann, A. S. B., Nylandsted, J., Simonsen, A. C. Timescale of hole closure during plasma membrane repair estimated by calcium imaging and numerical modeling. Scientific Reports. 11, 4226 (2021).
- Li, T., Wu, X., Liu, F., Li, N. Analytical methods based on the light-scattering of plasmonic nanoparticles at the single particle level with dark-field microscopy imaging. Analyst. 142 (2), 248-256 (2017).
- Gibbs-Flournoy, E. A., Bromberg, P. A., Hofer, T. P. J., Samet, J. M., Zucker, R. M. Darkfield-Confocal Microscopy detection of nanoscale particle internalization by human lung cells. Particle and Fibre Toxicology. 8 (1), 2 (2011).
- Taylor, R. W., Sandoghdar, V. Interferometric scattering microscopy: Seeing single nanoparticles and molecules via Rayleigh scattering. Nano Letters. 19 (8), 4827-4835 (2019).
- Wu, Y., Ali, M. R. K., Chen, K., Fang, N., El-Sayed, M. A. Gold nanoparticles in biological optical imaging. Nano Today. 24, 120-140 (2019).
- Klingberg, H., Oddershede, L. B., Loeschner, K., Larsen, E. H., Loft, S., Møller, P. Uptake of gold nanoparticles in primary human endothelial cells. Toxicology Research. 4 (3), 566-666 (2015).

