Een thermoplasmonische benadering voor het onderzoeken van plasmamembraanherstel in levende cellen en modelmembranen
Summary
De thermoplasmonische punctiemethode integreert confocale microscopie, optische pincetten en gouden nanodeeltjes om eiwitreacties te bestuderen tijdens plasmamembraanherstel in cellen en gigantische unilamellaire blaasjes. De techniek maakt een snelle en gelokaliseerde membraanpunctie mogelijk, waardoor de belangrijkste eiwitten en hun functionele rol in de ingewikkelde plasmamembraanreparatiemachines kunnen worden geïdentificeerd.
Abstract
Het celmembraan is cruciaal voor het overleven van de cel, en het waarborgen van de integriteit ervan is essentieel omdat de cel gedurende zijn hele levenscyclus verwondingen oploopt. Om schade aan het membraan te voorkomen, hebben cellen efficiënte plasmamembraanreparatiemechanismen ontwikkeld. Deze reparatiemechanismen kunnen worden bestudeerd door confocale microscopie en thermoplasmonics op nanoschaal te combineren om de rol van sleuteleiwitten, zoals bijlagen, die betrokken zijn bij oppervlakteherstel in levende cellen en membraanmodelsystemen, te identificeren en te onderzoeken.
De punctuurmethode maakt gebruik van een laser om zeer plaatselijke verwarming te induceren bij bestraling van nanodeeltjes. Het gebruik van nabij-infrarood licht minimaliseert de fototoxiciteit in het biologische monster, terwijl het grootste deel van de absorptie plaatsvindt in het nabij-infrarood resonante plasmonische nanodeeltje. Deze thermoplasmonische methode is gebruikt voor potentieel fotothermisch en biofysisch onderzoek om het begrip van intracellulaire mechanismen en cellulaire reacties te vergroten door middel van blaasjes- en celfusiestudies. De aanpak is complementair gebleken aan bestaande methoden voor membraanverstoring, zoals mechanisch, chemisch of optisch geïnduceerd letsel, en biedt een hoge mate van controle door het toebrengen van extreem gelokaliseerde verwondingen. De omvang van de verwonding is beperkt tot de nabijheid van het bolvormige nanodeeltje en er treedt geen nadelige schade op langs het straalpad in tegenstelling tot gepulseerde lasers die verschillende golflengten gebruiken. Ondanks bepaalde beperkingen, zoals de vorming van nanobellen, biedt de thermoplasmonische methode een uniek hulpmiddel voor het onderzoeken van cellulaire reacties bij plasmamembraanherstel in een bijna oorspronkelijke omgeving zonder de levensvatbaarheid van de cel in gevaar te brengen.
Wanneer de punctiemethode wordt geïntegreerd met confocale microscopie, kan deze een mechanistisch inzicht verschaffen in de membraandynamica in modelmembraansystemen, evenals kwantitatieve informatie over eiwitreacties op membraanschade, inclusief eiwitrekrutering en hun biofysische functie. Over het algemeen kan de toepassing van deze methode op gereduceerde modelsystemen ons begrip van de ingewikkelde plasmamembraanreparatiemachines in levende cellen vergroten.
Introduction
Het celmembraan, dat zowel als fysieke barrière als als signaalplatform dient, is van vitaal belang voor het overleven vancellen1. Gedurende de gehele celcyclus wordt het plasmamembraan (PM) blootgesteld aan schade, zoals mechanische 2,3,4,5 en chemische6 stress-geïnduceerde verwondingen. Om de integriteit van het membraan te behouden en de overleving van de cel te garanderen, heeft de cel robuuste mechanismen voor plasmamembraanreparatie (PMR) ontwikkeld. Deze mechanismen zijn afhankelijk van verschillende strategieën, zoals reorganisatie van het cytoskelet, membraanfusie en membraanvervangingsstrategieën 7,8,9,10,11, die allemaal afhankelijk zijn van de rekrutering van specifieke eiwitten. Met name leden van de annexine-eiwitfamilie zijn geïdentificeerd als sleuteleiwitten die geassocieerd zijn met de processen van PMR 1,9,12,13,14,15,16. Na PM-letsel ervaart de cel een instroom van calciumionen (Ca2+), wat een onmiddellijke bedreiging vormt voor het voortbestaan van de cel17. Als reactie op de instroom van Ca2+ binden annexine-eiwitten, die zich voornamelijk in het cytosol bevinden, zich aan het binnenste blaadje van het beschadigde plasmamembraan als onderdeel van de PMR-strategieën18. Annexine A2 (ANXA2) was een van de eerste leden van de annexinefamilie die in verband werd gebracht met PMR bij dysferline-deficiënte spierdystrofie en er werd gesuggereerd dat het herstel bemiddelde door intracellulaire blaasjes te fuseren met de PM in de buurt van de plaats van de verwonding 5,19,20,21. Vervolgens zijn verschillende functies toegeschreven aan annexins22, en hun rol in PMR heeft de afgelopen 20 jaar steeds meer aandacht gekregen. De exacte rol van annexinen in PMR wordt echter nog niet volledig begrepen 15,18,21,22.
Dit artikel stelt een methode voor om eiwit-membraaninteractie en membraandynamica op een gecontroleerde en sterk gelokaliseerde manier te onderzoeken, met behulp van een combinatie van confocale microscopie, optisch pincet en gouden nanodeeltjes (AuNP’s). Deze methode maakt de kwantitatieve studie mogelijk van eiwit-, lipide- en kleine molecuulinteracties als reactie op membraanbeschadiging en Ca2+ instroom. Ondanks de complexiteit en veelheid aan componenten die betrokken zijn bij het proces van membraanreparatie, zijn vereenvoudigde membraansystemen die het plasmamembraan nabootsen gebruikt om een dieper mechanistisch begrip te krijgen van de membraandynamica en de reactie van annexine-eiwitten op membraanverstoring16. Gigantische unilamellaire lipideblaasjes (GUV’s) werden gekozen als het modelmembraansysteem met een gespecificeerde lipidesamenstelling. De GUV’s werden gegenereerd met behulp van de gel-ondersteunde hydratatiemethode, met name polyvinylalcoholgelhydratatie, zoals beschreven door Weinberger et al.23, die een efficiënte inkapseling van annexines in GUV’s mogelijk maakte.
Het gebruik van nabij-infrarood (NIR) laserbestraling op metalen nanodeeltjes (NP’s) induceert een aanzienlijke opwarming van de NP, waardoor het een effectieve methode is om een lokale warmtebron tot stand te brengen die wordt geëxploiteerd in biomedische toepassingen24. De methode werd aanvankelijk gebruikt om de temperatuur rond een enkele AuNP direct te meten in zowel 2D- als 3D-biomimetische tests. In deze assays 25,26 werden de plasmonische nanodeeltjes bestraald op een ondersteunde lipide dubbellaag of optisch gevangen in de buurt van GUV’s die een lokale thermische faseovergang ondergingen bij lokale verhitting, waardoor kwantificering en controle van het exacte temperatuurprofiel rond het deeltje mogelijk werd. Dit referentietemperatuurprofiel is gebruikt bij het onderzoeken of manipuleren van biologische monsters. Verdere vooruitgang in de methode heeft de inductie van nanoscopische poriën in membranenvergemakkelijkt 27, waardoor blaasjes- en celfusie mogelijk is28,29. Andere studies hebben het gedrag van perifere membraaneiwitten in GUV’s29 en transmembraaneiwitten30 onderzocht door nieuwe hybride blaasjes te creëren, terwijl celspecifieke medicijnafgifte ook is onderzocht om cellulaire reacties of genexpressie te controleren en te bestuderen 28,29,31,32,33. Onlangs is de methode gebruikt om eiwitreacties op membraanbeschadiging te onderzoeken 32,34,35.
Er bestaan verschillende methoden om het plasmamembraan te verstoren om cellulaire reacties en membraanherstel te onderzoeken. Deze omvatten micronaaldpuncties, het schudden van microbeads en celschrapen, die allemaal het celmembraan mechanisch kunnen verstoren 14,36,37. Chemisch geïnduceerde schade kan worden bereikt door wasmiddelen 5,38 of bacteriële toxines39,40 toe te voegen die de lipidedubbellaag destabiliseren en membraanporiën over het plasmamembraan genereren. Bovendien zijn optisch geïnduceerde verwondingen door continue golf en gepulseerde lasers gebruikt om PMR-componenten te bestuderen, zoals annexine-eiwitten 5,14,21,41, in combinatie met plasmonische nanodeeltjes 42,43,44,45. Ondanks de efficiëntie van krachtige gepulseerde lasers, kunnen ze aanzienlijke verwondingen en schade aan het inwendige van de cel veroorzaken langs het straalpad. Bovendien moeten de gedetailleerde veranderingen die optreden in de biologische materie bij gepulseerde laserbestraling en of het een goed gedefinieerde porie creëert, nog verder worden onderzocht. In dit artikel wordt een alternatieve methode gepresenteerd, waarbij gebruik wordt gemaakt van thermoplasmonica om op een gecontroleerde manier nanoscopische gaatjes in de PM te induceren34,35 zonder significante schade aan de interne structuren te veroorzaken. Dit wordt bereikt door plasmonische NP’s bloot te stellen aan een zeer gefocuste NIR-laser, wat resulteert in een extreem gelokaliseerde temperatuurstijging die gemakkelijk temperaturen van meer dan 200 °C kan bereiken, wat kan leiden tot kleine nanoscopische explosies 25,46,47. Dit proces kan worden gecontroleerd door de laserintensiteit en de grootte, vorm en samenstelling van de NP’s48 aan te passen. Door deze techniek te gebruiken, kunnen onderzoekers de rol van eiwitten in PM-reparatie in levende cellen onderzoeken, wat zou kunnen helpen bij het beantwoorden van enkele van de onbeantwoorde vragen over de betrokkenheid van annexine-eiwitten bij membraanherstel zonder de levensvatbaarheid van de cel in gevaar te brengen.
De optische vangst van plasmonische nanodeeltjes is goed vastgesteld door eerdere studies 25,49,50,51,52; Aanvullende inzichten met betrekking tot de thermoplasmonische eigenschappen van de nanodeeltjes 53,54,55 kunnen echter worden verkregen in de aanvullende materialen (Aanvullend Dossier 1). De thermoplasmonische methode kan worden gebruikt om nanoscopisch kleine gaatjes in de PM te maken met het oog op het bestuderen van de cellulaire respons- en reparatiemechanismen. Om precies te zijn, de punctie kan worden bereikt door de optische verwarming van AuNP’s in de nabijheid van het membraan, zoals weergegeven in figuren 1A en B. Deze gelokaliseerde punctie zorgt voor een instroom van Ca2+, die werd geverifieerd door een calciumsensor, waardoor de PMR-machinerie werd geactiveerd. Voor experimenten met levende cellen werden AuNP’s met een diameter van 200 nm geïmmobiliseerd op het oppervlak onder de cel om de rol van ANXA2 in PMR te volgen via confocale microscopie. De NIR-laser (Figuur 1A,B), met een golflengte van 1064 nm, bestraalt de AuNP en maakt gebruik van zijn plasmonische eigenschappen (Figuur 1C), wat resulteert in substantiële lokale verwarming (Figuur 1D) in het biologische transparantievenster49 terwijl de cel zelf minimale schade wordt toegebracht. Het gebied met hoge temperaturen rond de AuNP neemt snel af met 30-40% op een afstand die overeenkomt met de straal van de NP, zoals weergegeven in figuur 1E, waardoor een extreem beperkt letsel in alle drie de dimensies mogelijk is.
Aanvullend dossier 1. Klik hier om dit bestand te downloaden.
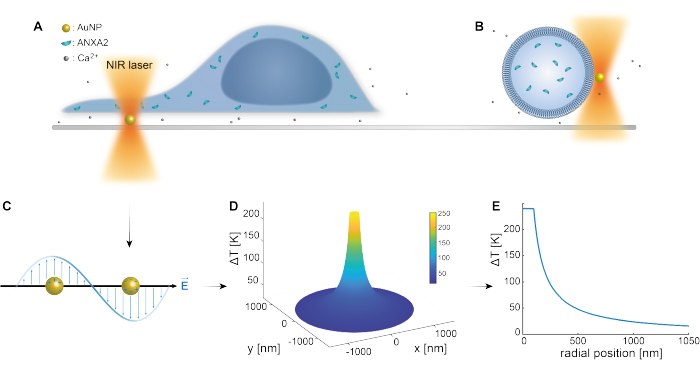
Figuur 1: Schematische schets van de experimentele methode. (A) ANXA-getransfecteerde cellen bevinden zich bovenop geïmmobiliseerde gouden nanodeeltjes (AuNP’s) op het oppervlak, of (B) gigantische unilamellaire blaasjes (GUV’s) met ingekapselde ANXA zijn gesuspendeerd in een medium dat AuNP’s bevat. (C) Een enkele AuNP wordt bestraald door de optische NIR-val, waarbij de interactie tussen het inkomende elektromagnetische veld en de geleidingselektronen leidt tot de collectieve oscillatie van elektronen binnen de NP. (D) Dit proces resulteert in een zeer beperkte, maar significante temperatuurstijging. Om de temperatuur aan het NP-oppervlak te schatten, wordt de Mie-theorie gebruikt en wordt een (E) temperatuurprofiel berekend voor een AuNP met een diameter van 200 nm en laserintensiteit I = 6,36 x 108 W/cm2. Klik hier om een grotere versie van deze figuur te bekijken.
Om het thermische effect op het celmembraan te minimaliseren, worden de AuNP’s slechts ~1 seconde bestraald. Dit veroorzaakt een voorbijgaande en lokale uitbarsting van verhitting, waardoor de schade aan eiwitten die doorgaans meer tijd nodig hebben om zich te ontvouwen, wordt verminderd. Bij het doorboren van het membraan worden annexine-eiwitten in een fractie van een seconde gerekruteerd en binnen enkele seconden wordt een annexineringachtige steiger gevormd rond de plaats van verwonding (Figuur 2). Deze benadering is ook toegepast om de betrokkenheid van ANXA5 in zowel levende cellen als modelmembranen16 te onderzoeken in een poging licht te werpen op het volledige schema van de reparatieprocessen. Hoewel de primaire focus lag op de correlerende rekrutering van verschillende annexine-eiwitten, moeten de biofysische aspecten van het reparatiemechanisme nog worden opgehelderd.
Om de voorgestelde methode volledig te implementeren, zijn drie belangrijke componenten nodig: confocale microscopie, optisch pincet en metalen nanodeeltjes. Optische pincetten worden gebruikt om AuNP’s op te vangen en hun constructie kan worden bereikt door de procedure te volgen die is beschreven door Neuman et al.49. Als het bouwen van een optisch pincet echter te uitdagend blijkt te zijn, kan een strak gefocusseerde NIR-laser worden gebruikt om AuNP’s te bestralen die onder de cellen zijn geïmmobiliseerd. Hoewel voor dit protocol sferische AuNP’s werden gekozen, kon een verscheidenheid aan plasmonische deeltjes met afstembare absorptiespectra ook worden gebruikt om een sterk gelokaliseerde temperatuurgradiënt binnen het NIR-gebied48 te bereiken.
Fluorescentiebeeldvorming is noodzakelijk voor het observeren van de rol van de fluorescerend gelabelde eiwitten, en daarom kan totale interne reflectiemicroscopie (TIRF)56 worden beschouwd als een alternatief voor confocale beeldvorming. Deze techniek maakt echter alleen beeldvorming van het oppervlak mogelijk en zou niet compatibel zijn met de experimenten met modelmembraanblaasjes. Bijgevolg zijn zowel het optische pincet als de confocale microscoop essentieel voor de nauwkeurige lokalisatie van het nanodeeltje en gedetailleerd onderzoek van het lokale gebied rond de celbeschadiging. Om het nanodeeltje effectief te bestralen met een diffractiebeperkte laserfocus, is het noodzakelijk om het nanodeeltje te visualiseren. Dit kan optimaal worden bereikt door reflectiemicroscopie, een standaard beeldvormingsfunctie van Leica confocale microscopen. Als reflectie- of verstrooiingsbeeldvorming echter niet beschikbaar is, kunnen alternatieve methoden, zoals de minder efficiënte fluorescerende AuNP-etikettering, worden overwogen.
Samenvattend heeft de zeer controleerbare en gelokaliseerde thermoplasmonische methode die in deze studie wordt gepresenteerd, het potentieel om te dienen als een uitstekend platform voor het onderzoeken van de moleculaire componenten die betrokken zijn bij cellulaire reacties en PM-herstelmechanismen in levende cellen. Naast het bestuderen van de eiwitrespons op PM-schade, kan deze benadering ook worden gebruikt voor het lokaal doorboren van blaasjes, waardoor een onderzoek van de eiwitrespons in zowel eiwit-eiwit- als eiwit-membraandynamiek mogelijk wordt. Bovendien maakt deze methode een kwantitatieve analyse mogelijk van de interacties tussen eiwitten, lipiden en kleine moleculen wanneer membranen worden verstoord. Gezamenlijk hebben deze vorderingen het potentieel om licht te werpen op enkele van de onopgeloste vragen met betrekking tot de ingewikkelde en complexe plasmamembraanreparatiemachines.
Protocol
Representative Results
Discussion
De studie benadrukt de thermoplasmonische benadering als een veelbelovende techniek voor het onderzoeken van eiwitreacties in levende cellen en modelmembranen na membraanverstoring. Deze methode levert niet alleen uitgebreide informatie op over eiwitrekrutering, maar ook over de biofysische functie van eiwitten die betrokken zijn bij de dynamiek van eiwitten en membranen. Bijgevolg vergemakkelijkt het de identificatie van moleculaire componenten die verantwoordelijk zijn voor oppervlakteherstel en bevordert het het begrip van de complexe maar vitale machinerie van plasmamembraanreparatie. Hoewel er verschillende methoden bestaan voor het induceren van membraanverstoring, zoals mechanische, chemische en optische technieken, hebben deze methoden te lijden aan beperkingen, zoals niet-specifiek zijn voor cellen, het veroorzaken van meerdere verwondingen aan het celmembraan of het veroorzaken van aanzienlijke schade aan het membraan en het ablateren van intern cellulair materiaal langs het laserpad bij gebruik van krachtige gepulseerde lasers. Hoewel de integratie van confocale microscopie en een optisch pincet de meest uitgebreide informatie biedt, kunnen ook alternatieve beeldvormingsmodaliteiten worden gebruikt. Bijvoorbeeld, aangezien de beeldvorming van het plasmonische nanodeeltje wordt bereikt met behulp van reflectiemicroscopie, een ingebouwde beeldvormingsmodus in Leica confocale microscopen, kunnen aanvullende beeldvormingstechnieken, zoals donkerveldmicroscopie65,66, andere verstrooiingsmethoden zoals iSCAT67,68, of fluorescerende etikettering van het nanodeeltje, worden gebruikt voor AuNP-visualisatie, hoewel dit de toepasbaarheid van de methode zou kunnen beperken.
De gepresenteerde methode is bovendien in staat om nanoscopisch kleine gaatjes in modelmembranen te induceren, waardoor de synergie-effecten tussen verschillende annexines kunnen worden onderzocht. Dit wordt bereikt door verschillend gelabelde recombinante annexines in te kapselen, bijvoorbeeld RFP en GFP, respectievelijk, gevolgd door thermoplasmonische punctie. Dit modelsysteem geeft inzicht in de interactie tussen annexines en membranen in de buurt van vrije randen, zoals te zien is in figuur 2D. In tegenstelling tot in cellen blijven de gaten die aan GUV’s worden toegebracht echter uitzetten, gevolgd door destabilisatie van het blaasje. Het in beeld brengen van de evolutie van het gat met behulp van confocale microscopie kan een uitdaging zijn vanwege de snelle uitbreiding van de gatdiameter, maar kan worden bereikt door in de loop van de tijd verschillende z-stapels vast te leggen. Een alternatieve methode zou zijn om een draaiende schijf confocaal te gebruiken voor snellere beeldvorming. Bovendien levert de thermoplasmonische benadering doorgaans een beperkt aantal optimale resultaten per uur op wanneer deze wordt toegepast op afzonderlijke cellen of GUV-experimenten, meestal twee tot drie, bij monstertemperaturen tussen 20 °C en 30 °C. Om de meest nauwkeurige waarneming van de dynamiek van eiwitten en membranen te verkrijgen, wordt aanbevolen om de cellen in een HEPES-bevattende buffer te houden en het monster elk uur te vervangen. Als alternatief kan het experimentele venster worden verlengd door de experimenten uit te voeren in een celincubatiekamer, d.w.z. bij een constante temperatuur van 37 °C met 5% CO2 . Bovendien zou het combineren van deze benadering met andere beeldvormingstechnieken, zoals stochastische optische reconstructiemicroscopie (STORM), een dieper begrip kunnen opleveren van de biofysische functie en interactie van belangrijke eiwitten die betrokken zijn bij membraanherstel op het niveau van één molecuul. Dit zou gedetailleerde informatie kunnen opleveren over de plaats van de verwonding, inclusief de wondgeometrie en locatie van annexine-eiwitten, en andere belangrijke spelers kunnen identificeren die betrokken zijn bij het repareren van het membraanoppervlak.
Om maximale effectiviteit en precisie te bereiken bij het induceren van membraanletsel, is het absoluut noodzakelijk om voorafgaand aan elk experiment de locatie van de laserfocus te verifiëren en ervoor te zorgen dat de axiale positie van de laserfocus samenvalt met de confocale focus. Deze uitlijning optimaliseert de intensiteit tijdens AuNP-beeldvorming, wat leidt tot een maximale lokale temperatuurstijging en daaruit voortvloeiend membraanletsel bij een lager laservermogen. Dit proces wordt handmatig uitgevoerd en is daarom gevoelig voor variabiliteit in de efficiëntie van membraanbreuken, aangezien de focus handmatig wordt vertaald naar een positie die samenvalt met de locatie van het deeltje. In microscopen die geen reflectiemodus hebben, zoals in sommige commerciële systemen, kan co-lokalisatie van de laserfocus en het deeltje een uitdaging zijn. In dergelijke gevallen kunnen alternatieve beeldvormingsmodi (bijv. helder veld) worden gebruikt en kan een langzame rasterscan worden uitgevoerd rond de verwachte deeltjespositie. Opgemerkt moet worden dat een laag laservermogen waarschijnlijk alleen membraanpermeabilisatie induceert, terwijl een hoog laservermogen temperaturen rond de NP kan genereren die het kookpunt van water overschrijden, zelfs als het glasoppervlak een koelend effect heeft. Geschat wordt dat de vorming van nanobellen rond de NP’s plaatsvindt tussen 200 °C en 300 °C25,48, waarbij de explosieve hitte kan leiden tot verplaatsing van deeltjes van de laserfocus of deeltjesfragmentatie. Bovendien vormt de vorming van nano- of microbellen tijdens verhitting een uitdaging voor deze methode. Aangezien luchtinterfaces membranen ontnat maken en eiwitdestabilisatie kunnen veroorzaken, wat ongewenst is, is het absoluut noodzakelijk om de verwarming te beperken bij het onderzoeken van membraanreparatie. Met name gouden nanoschelpen verdragen geen hoge temperaturen en zullen onder deze omstandigheden degraderen, zoals aangetoond door microscopie met hoge resolutie58.
Dit artikel biedt een gedetailleerd protocol voor het gebruik van thermoplasmonics om sterk gelokaliseerde puncties in membranen uit te voeren, dat van toepassing is op zowel cellen als modelmembranen. Om de mate van verhitting verder te verminderen, kunnen kleinere nanodeeltjes die resoneren met NIR-licht worden gebruikt, waardoor intracellulaire puncties in endosomen, het endoplasmatisch reticulum en de nucleaire envelop mogelijk worden. Dergelijke nanodeeltjes, met inbegrip van staafjes en nanomatroesjka’s48, kunnen worden gebruikt om het herstel van de nucleaire envelop te onderzoeken door zich te richten op endocytose gouden nanodeeltjes die gemakkelijk aan het celoppervlak worden opgenomen en naar de kern69 worden getransporteerd. Over het algemeen maakt deze techniek de identificatie en het onderzoek mogelijk van de belangrijkste moleculaire componenten die betrokken zijn bij PMR, waardoor hun biofysische functie en rol wordt opgehelderd met behoud van de levensvatbaarheid van de cellen.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We willen Jesper Nylandsted bedanken voor het leveren van recombinante annexine-eiwitten en plasmiden die coderen voor annexines. Dit werk werd financieel ondersteund door de Deense Raad voor Onafhankelijk Onderzoek, Natuurwetenschappen (DFF-4181-00196), door het Interdisciplinair Synergyprogramma 2018 van de Novo Nordisk Foundation (NNF18OC0034936), het Wetenschappelijk Comité Danish Cancer Society (R90-A5847-14-S2), de Lundbeck Foundation (R218-2016-534) en door het Lundbeck Foundation Center of Excellence (Biomembranes in Nanomedicine).
Materials
| 1064 nm trapping laser | Spectra Physics | N/A | Spectra Physics J201-BL-106C, Nd: YVO4 NIR laser |
| 160 nm Gold Nanoshells | NanoComposix | NCXGSIR150 | |
| 200 nm Gold Nanoparticles | BBI Solutions | EM.GC200/7 | |
| 35 mm glass surface MatTex microwell | MATTEK | P35G-1.5-14-C | |
| Amber-glass vials | Supelco Sigma Aldrich | 243438 | |
| Annexin A2 plasmids | N/A | N/A | Received from our collaborator at the Danish Cancer Research Center |
| Annexin A4 recombinant-protein | N/A | N/A | N-terminal GFP tagged ANXA4 received from our collaborator at the Danish Cancer Research Center |
| Annexin A5 recombinant-protein | N/A | N/A | N-terminal GFP tagged ANXA5 received from our collaborator at the Danish Cancer Research Center |
| beta-casein | Sigma Life Science | C6905-1G | |
| CaCl2 | Suprlco (sigma Aldrich) | 10035-04-8 | |
| Centrifuge 5702 | Eppendorf | 5702 | |
| Chloroform | VWR Chemicals | 67-66-3 | |
| Culture dish (Nunclon Delta Surface) | Thermo scientific | 150460 | |
| DID cell-labelling Solution | Invitrogen | 7757 | |
| Distilled water | Gibco | 15230-089 | |
| DOPC | Avanti Polar Lipids | 850375C | Dissolved in chloroform |
| DOPS | Avanti Polar Lipids | 840035C | Dissolved in chloroform |
| Dulbecco's Modified Eage's Medium | Thermo Fisher Scientific | 11995065 | |
| FIJI ImageJ distribution | ImageJ2 | N/A | |
| GCaMP6s-CAAX | N/A | Received from our collaborator at the Danish Cancer Research Center | |
| Gibco Fetal Bovine Serum | Fisher Scientific | 11573397 | 10% of the culture medium |
| Glucose | PROLABO | 24 374.297 | |
| Hamilton syringes | Hamilton Company | N/A | 50 and 500 microliters |
| Harrick Plasma Cleaner PDG-002 | Harrick Plasma | N/A | |
| HEK293T cells | N/A | Received from our collaborator at the Danish Cancer Research Center | |
| Leica Acousto-Optical Beam Splitter (AOBS) | Leica | N/A | |
| Leica PL APO 63x water immersion objective, NA = 1.2 | Leica | N/A | |
| Leica SP5 confocal scanning microscope | Leica | N/A | |
| Lipofectamine | Fisher Scientific | 15338030 | |
| MatLab | The Mathworks, Inc., Natick, Massachusetts, United States | N/A | |
| NaCl | VWR Chemicals | 7647-14-5 | |
| Opti-MEM Reduced-Serum Medium | Thermo Fisher Scientific | 11058021 | |
| Parafilm | Bemis | PM-992 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 1% of the culture medium |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | 10010023 | |
| Piezoelectric stage (PI 731.20) | Physik Instrumente (Germany) | N/A | |
| Poly-L-Lysine | Sigma-Aldrich | P8920-100ML | 0.01-0.1% for coating |
| Polyvinyl alcohol | Sigma-Aldrich | 363065-25G | |
| round glass slide 25 mm Ø | VWR | 631-1584 | |
| Sonicator Brandson 2800 | Brandson | N/A | |
| sucrose | Sigma Life Science | 57-50-1 | |
| T25 tissue culture flask | Falcon | 353108 | Blue Vented cap |
| Tris-HCl | Invitrogen | 15567-027 | |
| TrypLE | Thermo Fisher Scientific | A1285901 | |
| Trypsin-EDTA | Fisher Scientific | 11590626 | |
| VWR Mixer mini vortex 230V EU | VWR | 12620-84 | ECN: 444-2790, SN: 150713022 |
References
- Bendix, P. M., et al. Interdisciplinary synergy to reveal mechanisms of annexin-mediated plasma membrane shaping and repair. Cells. 9 (4), 1029 (2020).
- Gajic, O., Lee, J., Doerr, C. H., Berrios, J. C., Myers, J. L., Hubmayr, R. D. Ventilator-induced Cell Wounding and Repair in the Intact Lung. American Journal of Respiratory and Critical Care Medicine. 167, 1057-1063 (2003).
- McNeil, P. L., Khakee, R. Disruptions of muscle fiber plasma membranes. Role in exercise-induced damage. The American Journal of Pathology. 140 (5), 1097-1109 (1992).
- Yu, Q. C., McNeil, P. L. Transient disruptions of aortic endothelial cell plasma membranes. The American Journal of Pathology. 141 (6), 1349-1360 (1992).
- Boye, T. L., et al. Annexin A4 and A6 induce membrane curvature and constriction during cell membrane repair. Nature Communications. 8, 1623 (2017).
- Bischofberger, M., Gonzalez, M. R., van der Goot, F. G. Membrane injury by pore-forming proteins. Current Opinion in Cell Biology. 21, 589-595 (2009).
- Tang, S. K. Y., Marshall, W. F. Self-repairing cells. Science (New York, N.Y.). 356, 1022-1025 (2017).
- Abreu-Blanco, M. T., Verboon, J. M., Parkhurst, S. M. Single cell wound repair: Dealing with life’s little traumas. Bioarchitecture. 1, 114-121 (2011).
- Sønder, S. L., et al. Annexin A7 is required for ESCRT III-mediated plasma membrane repair. Scientific Reports. 9, 6726 (2019).
- Andrews, N. W., Almeida, P. E., Corrotte, M. Damage control: cellular mechanisms of plasma membrane repair. Trends in Cell Biology. 24 (12), 734-742 (2014).
- Idone, V., Tam, C., Goss, J. W., Toomre, D., Pypaert, M., Andrews, N. W. Repair of injured plasma membrane by rapid Ca2+-dependent endocytosis. The Journal of Cell Biology. 180 (5), 905-914 (2008).
- Lauritzen, S. P., Boye, T. L., Nylandsted, J. Annexins are instrumental for efficient plasma membrane repair in cancer cells. Seminars in Cell & Developmental Biology. 45, 32-38 (2015).
- Häger, S. C., Nylandsted, J. Annexins: players of single cell wound healing and regeneration. Communicative & Integrative Biology. 12 (1), 162-165 (2019).
- Jaiswal, J. K., et al. S100A11 is required for efficient plasma membrane repair and survival of invasive cancer cells. Nature Communications. 5, 3795 (2014).
- Draeger, A., Monastyrskaya, K., Babiychuk, E. B. Plasma membrane repair and cellular damage control: The annexin survival kit. Biochemical Pharmacology. 81 (6), 703-712 (2011).
- Moreno-Pescador, G. S., et al. Thermoplasmonic nano-rupture of cells reveals annexin V function in plasma membrane repair. Nanoscale. 14 (21), 7778-7787 (2022).
- Zhivotovsky, B., Orrenius, S. Calcium and cell death mechanisms: A perspective from the cell death community. Cell Calcium. 50 (3), 211-221 (2011).
- Gerke, V., Moss, S. E. Annexins: From structure to function. Physiological Reviews. 82 (2), 331-371 (2002).
- Idone, V., Tam, C., Andrews, N. W. Two-way traffic on the road to plasma membrane repair. Trends in Cell Biology. 18 (11), 552-559 (2008).
- Boye, T. L., et al. Annexins induce curvature on free-edge membranes displaying distinct morphologies. Scientific Reports. 8, 10309 (2018).
- Bouter, A., et al. Annexin-A5 assembled into two-dimensional arrays promotes cell membrane repair. Nature Communications. 2, 270 (2011).
- Boye, T. L., Nylandsted, J. Annexins in plasma membrane repair. Biological Chemistry. 397 (10), 961-969 (2016).
- Weinberger, A., et al. Gel-assisted formation of giant unilamellar vesicles. Biophysical Journal. 105 (1), 154-164 (2013).
- Numata, T., Tatsuta, H., Morita, Y., Otani, Y., Umeda, N. Localized thermal processing with a laser-trapped and heated metal nanoparticle. IEEJ Transactions on Electrical and Electronic Engineering. 2, 398-401 (2007).
- Bendix, P. M., Reihani, S. N. S., Oddershede, L. B. Direct measurements of heating by electromagnetically trapped gold nanoparticles on supported lipid bilayers. ACS Nano. 4 (4), 2256-2262 (2010).
- Kyrsting, A., Bendix, P. M., Stamou, D. G., Oddershede, L. B. Heat profiling of three-dimensionally optically trapped gold nanoparticles using vesicle cargo release. Nano Letters. 11 (2), 888-892 (2011).
- Andersen, T., Kyrsting, A., Bendix, P. M. Local and transient permeation events are associated with local melting of giant liposomes. Soft Matter. 10 (24), 4268-4274 (2014).
- Bahadori, A., Oddershede, L. B., Bendix, P. M. Hot-nanoparticle-mediated fusion of selected cells. Nano Research. 10, 2034-2045 (2017).
- Rørvig-Lund, A., Bahadori, A., Semsey, S., Bendix, P. M., Oddershede, L. B. Vesicle fusion triggered by optically heated gold nanoparticles. Nano Letters. 15 (6), 4183-4188 (2015).
- Moreno-Pescador, G., Arastoo, M. R., Ruhoff, V. T., Chiantia, S., Daniels, R., Bendix, P. M. Thermoplasmonic vesicle fusion reveals membrane phase segregation of influenza spike proteins. Nano Letters. 23 (8), 3377-3384 (2023).
- Bahadori, A., Lund, A. R., Semsey, S., Oddershede, L. B., Bendix, P. M. Controlled cellular fusion using optically trapped plasmonic nano-heaters. SPIE Proceedings. SPIE 9922, Optical Trapping and Optical Micromanipulation XIII. 992211, (2016).
- Bahadori, A., Moreno-Pescador, G., Oddershede, L. B., Bendix, P. M. Remotely controlled fusion of selected vesicles and living cells: a key issue review. Reports on Progress in Physics. 81 (3), 32602 (2018).
- Moreno-Pescador, G., Arastoo, M. R., Chiantia, S., Daniels, R., Bendix, P. M. Thermoplasmonic induced vesicle fusion for investigating membrane protein phase affinity. bioRxiv. , (2022).
- Pescador, G. S. M., et al. Investigating plasma-membrane repair employing thermoplasmonics. Biophysical Journal. 120 (3), 45A (2021).
- Moreno-Pescador, G. S., Qoqaj, I., Thusgaard Ruhoff, V., Iversen, J., Nylandsted, J., Bendix, P. M. Effect of local thermoplasmonic heating on biological membranes. SPIE 11083, Optical Trapping and Optical Micromanipulation XVI. 110830M, (2019).
- Bement, W. M., Mandato, C. A., Kirsch, M. N. Wound-induced assembly and closure of an actomyosin purse string in Xenopus oocytes. Current Biology. 9 (11), 579-587 (1999).
- Weisleder, N., et al. Recombinant MG53 protein modulates therapeutic cell membrane repair in treatment of muscular dystrophy. Science Translational Medicine. 4 (139), 139ra85 (2012).
- Sudji, I. R., Subburaj, Y., Frenkel, N., García-Sáez, A. J., Wink, M. Membrane disintegration caused by the steroid saponin digitonin is related to the presence of cholesterol. Molecules. 20 (11), 20146-20160 (2015).
- Babiychuk, E. B., Monastyrskaya, K., Potez, S., Draeger, A. Intracellular Ca2+ operates a switch between repair and lysis of streptolysin O-perforated cells. Cell Death & Differentiation. 16, 1126-1134 (2009).
- Nygård Skalman, L., Holst, M. R., Larsson, E., Lundmark, R. Plasma membrane damage caused by listeriolysin O is not repaired through endocytosis of the membrane pore. Biology Open. 7 (10), bio035287 (2018).
- Swaggart, K. A., et al. Annexin A6 modifies muscular dystrophy by mediating sarcolemmal repair. Proceedings of the National Academy of Sciences of the United States of America. 111, 6004-6009 (2014).
- Yeheskely-Hayon, D., Minai, L., Golan, L., Dann, E. J., Yelin, D. Optically induced cell fusion using bispecific nanoparticles. Small. 9 (22), 3771-3777 (2013).
- Minai, L., Yeheskely-Hayon, D., Golan, L., Bisker, G., Dann, E. J., Yelin, D. Optical nanomanipulations of malignant cells: Controlled cell damage and fusion. Small. 8 (11), 1732-1739 (2012).
- Lukianova-Hleb, E., et al. Plasmonic nanobubbles as transient vapor nanobubbles generated around plasmonic nanoparticles. ACS Nano. 4 (4), 2109-2123 (2010).
- Vogel, A., Noack, J., Hüttman, G., Paltauf, G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B. 81, 1015-1047 (2005).
- Baffou, G., Polleux, J., Rigneault, H., Monneret, S. Super-heating and micro-bubble generation around plasmonic nanoparticles under cw illumination. Journal of Physical Chemistry C. 118 (9), 4890-4898 (2014).
- Sasikumar, K., Liang, Z., Cahill, D. G., Keblinski, P. Curvature induced phase stability of an intensely heated liquid. Journal of Chemical Physics. 140 (23), 234506 (2014).
- Jauffred, L., Samadi, A., Klingberg, H., Bendix, P. M., Oddershede, L. B. Plasmonic heating of nanostructures. Chemical Reviews. 119 (13), 8087-8130 (2019).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nature Methods. 5 (6), 491-505 (2008).
- Bendix, P. M., Jauffred, L., Norregaard, K., Oddershede, L. B. Optical trapping of nanoparticles and quantum dots. IEEE Journal of Selected Topics in Quantum Electronics. 20, 15-26 (2014).
- Samadi, A., Bendix, P. M., Oddershede, L. B. Optical manipulation of individual strongly absorbing platinum nanoparticles. Nanoscale. 46, 18449-18455 (2017).
- Jørgensen, J. T., Norregaard, K., Tian, P., Bendix, P. M., Kjaer, A., Oddershede, L. B. Single particle and PET-based platform for identifying optimal plasmonic nano-heaters for photothermal cancer therapy. Scientific Reports. 6, 30076 (2016).
- Goldenberg, H., Tranter, C. J. Heat flow in an infinite medium heated by a sphere. British Journal of Applied Physics. 3 (9), 296-298 (1952).
- Eustis, S., El-Sayed, M. A. Why gold nanoparticles are more precious than pretty gold: Noble metal surface plasmon resonance and its enhancement of the radiative and nonradiative properties of nanocrystals of different shapes. Chemical Society Reviews. 35, 209-217 (2006).
- Landau, L. D., Lifshitz, E. M. . Fluid Mechanics: Landau and Lifshitz: Course of Theoretical Physics. 6, (2013).
- Niederauer, C., Seynen, M., Zomerdijk, J., Kamp, M., Ganzinger, K. A. The K2: Open-source simultaneous triple-color TIRF microscope for live-cell and single-molecule imaging. HardwareX. 13, e00404 (2023).
- Richardson, A. C., Reihani, N., Oddershede, L. B. Combining confocal microscopy with precise force-scope optical tweezers. SPIE Proceedings:SPIE 6326, Optical Trapping and Optical Micromanipulation III. 632628, (2006).
- Samadi, A., Klingberg, H., Jauffred, L., Kjær, A., Bendix, P. M., Oddershede, L. B. Platinum nanoparticles: a non-toxic, effective and thermally stable alternative plasmonic material for cancer therapy and bioengineering. Nanoscale. 10 (19), 9097-9107 (2018).
- . Available from: https://www.thermofisher.com/order/catalog/product/A7816 (2023)
- Kreibig, U., Vollmer, M. Theoretical considerations. In: Optical Properties of Metal Clusters. 25, (1995).
- Mie, G. Beiträge zur Optik trüber Medien, speziell kolloidaler Metallösungen. Annalen der Physik. 330 (3), 377-445 (1908).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Klenow, M. B., Heitmann, A. S. B., Nylandsted, J., Simonsen, A. C. Timescale of hole closure during plasma membrane repair estimated by calcium imaging and numerical modeling. Scientific Reports. 11, 4226 (2021).
- Li, T., Wu, X., Liu, F., Li, N. Analytical methods based on the light-scattering of plasmonic nanoparticles at the single particle level with dark-field microscopy imaging. Analyst. 142 (2), 248-256 (2017).
- Gibbs-Flournoy, E. A., Bromberg, P. A., Hofer, T. P. J., Samet, J. M., Zucker, R. M. Darkfield-Confocal Microscopy detection of nanoscale particle internalization by human lung cells. Particle and Fibre Toxicology. 8 (1), 2 (2011).
- Taylor, R. W., Sandoghdar, V. Interferometric scattering microscopy: Seeing single nanoparticles and molecules via Rayleigh scattering. Nano Letters. 19 (8), 4827-4835 (2019).
- Wu, Y., Ali, M. R. K., Chen, K., Fang, N., El-Sayed, M. A. Gold nanoparticles in biological optical imaging. Nano Today. 24, 120-140 (2019).
- Klingberg, H., Oddershede, L. B., Loeschner, K., Larsen, E. H., Loft, S., Møller, P. Uptake of gold nanoparticles in primary human endothelial cells. Toxicology Research. 4 (3), 566-666 (2015).

