הדפסה ביולוגית תלת-ממדית של תרביות נוירון-אסטרוציטים אנושיות שמקורן ב-iPSC עבור יישומי סינון
Summary
כאן, אנו מציגים פרוטוקול לייצור תרביות משולבות בהדפסה ביולוגית תלת-ממדית של נוירונים ואסטרוציטים שמקורם ב-iPSC. מודל קוקולטורה זה, שנוצר בתוך פיגום הידרוג’ל בפורמטים של 96 או 384 בארות, מדגים כדאיות גבוהה לאחר ההדפסה וצמיחת עצבים תוך 7 ימים ומראה את הביטוי של סמני בשלות עבור שני סוגי התאים.
Abstract
כדי שמודל תאי יהיה בר-קיימא לבדיקת תרופות, המערכת חייבת לעמוד בדרישות התפוקה וההומוגניות לצד זמן פיתוח יעיל. עם זאת, מודלים תלת-ממדיים רבים שפורסמו אינם עומדים בקריטריונים אלה. לכן, זה מגביל את התועלת שלהם ביישומים מוקדמים לגילוי תרופות. הדפסה ביולוגית תלת-ממדית (3D) היא טכנולוגיה חדשנית שניתן ליישם בפיתוח מודלים תלת-ממדיים כדי לזרז את זמן הפיתוח, להגדיל את הסטנדרטיזציה ולהגדיל את התפוקה. כאן, אנו מציגים פרוטוקול לפיתוח מודלים תלת-ממדיים של חקלאות משותפת מודפסת ביולוגית של תאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (iPSC) שמקורם בתאי גזע גלוטמטרגיים ואסטרוציטים. תרבויות קו-תאיות אלה מוטמעות בתוך מטריצת הידרוג’ל של פפטידים ביו-אקטיביים, חלבוני מטריצה חוץ-תאית באורך מלא (ECM), ועם קשיחות פיזיולוגית של 1.1 kPa. ניתן לבסס את המודל במהירות בפורמטים של 96 בארות ו-384 בארות והוא מייצר כדאיות ממוצעת לאחר הדפסה של 72%. יחס אסטרוציטים לנוירונים במודל זה מוצג כ-1:1.5, הנמצא בטווח הפיזיולוגי של המוח האנושי. אוכלוסיות תאים אלה המודפסות ביולוגית בתלת-ממד מראות גם ביטוי של סמנים בוגרים מסוג תאים עצביים וצמיחה של תחזיות נוירוריט ואסטרוציטים תוך 7 ימים מהתרבית. כתוצאה מכך, מודל זה מתאים לניתוח באמצעות צבעי תאים וטכניקות אימונוסטיין לצד בדיקות צמיחת עצבים. היכולת לייצר מודלים פיזיולוגיים מייצגים אלה בקנה מידה גדול הופכת אותם לאידיאליים לשימוש במבחני סינון בתפוקה בינונית עד גבוהה עבור מטרות במדעי המוח.
Introduction
המחקר על מחלות מערכת העצבים המרכזית (CNS) בתעשיית גילוי התרופות מתרחב1. עם זאת, מחלות CNS נפוצות רבות כגון אפילפסיה, סכיזופרניה ואלצהיימר עדיין אין טיפולים מרפאים 2,3,4. היעדר טיפולים יעילים במחלות CNS יכול, לפחות בחלקו, להיות מיוחס לחוסר מודלים מדויקים במבחנה של המוח5. זה הביא לפער תרגומי בין מודלים נוכחיים במבחנה לבין נתוני in vivo וצוואר בקבוק עוקב במאמצי המחקר.
מונע על ידי פער תרגומי זה, חלה עלייה משמעותית בפיתוח מודלים חדשניים של תאים תלת-ממדיים בשנים האחרונות, כולל אורגנואידים עצביים, נוירוספרואידים ומודלים מבוססי פיגומים6. המבנה התלת-ממדי של מודלים אלה מסייע בשחזור המיקרו-סביבה העצבית, כולל לחצים ביומכניים, מגעים בין תאים ומטריצה חוץ-תאית במוח (ECM)7. ECM המוח הוא אלמנט דינמי של נוירופיזיולוגיה התופס את החלל בין סוגי תאים עצביים, כולל נוירונים, אסטרוציטים, אוליגודנדרוציטים, והיחידה הנוירו-וסקולרית7. רקפיטולציה של המוח ECM הוכחה כמשפיעה על מורפולוגיה עצבית וירי עצבי, ומודלים תלת-ממדיים מורכבים רבים של המוח הדגימו שקיעת חלבוני ECM על ידי סוגי תאים עצביים 8,9,10,11. מודלים מבוססי פיגומים מורכבים מתרבויות עצביות בוגרות המרחפות במטריצת הידרוג’ל סינתטית או ביולוגית נקבובית המייצגת את המוח ECM12. שלא כמו מערכות אורגנואידים וכדורואידים, מודלים תלת-ממדיים מבוססי פיגומים מאפשרים התאמה אישית של חלבוני ECM הקיימים ויש להם יתרון נוסף של כוונון קשיחות הידרוג’ל כדי לחקות לחצים ביומכניים13,14.
למרות שרוב מכריע של מודלים עצביים תלת-ממדיים מדגימים שחזור מוגבר של מיקרו-סביבה במוח, לא כל המודלים מתאימים היטב ליישום יישומי גילוי תרופות15. כדי שמודל תלת ממדי יוטמע בתהליכים תעשייתיים, המערכת חייבת לעמוד בדרישות התפוקה לסינון יישומים ולהיות בעלת זמן פיתוח קצר יחסית16. הדפסה ביולוגית תלת-ממדית היא טכנולוגיה חדשנית המציעה פוטנציאל ליצירת מודלים עצביים מבוססי פיגומים תלת-ממדיים עם זמן פיתוח מהיר, תפוקה מוגברת ורמות גבוהות יותר של בקרה מדויקת, לצד הסרת השונות הנגרמת כתוצאה מטעויות אנוש17. פרוטוקול זה מציג מודל קו-קולטורה תלת-ממדי של נוירונים ואסטרוציטים גלוטמטרגיים אנושיים שמקורם ב-iPSC בפיגום הידרוג’ל. פיגום הידרוג’ל זה מכיל פפטידים ביו-אקטיביים מייצגים פיזיולוגית (RGD, IKVAV, YIGSR) וחלבוני ECM בתוך קשיחות ביומכנית מימטית. חלבוני ECM באורך מלא אלה כוללים למינין-211 באורך מלא וחומצה היאלורונית, המצויים בשפע בקליפת המוח האנושית, עם קשיחות של 1.1 kPa בהתאם למדידות in vivo 18. מודל זה מתוכנן באופן מעשי לגילוי תרופות, ונוצר באמצעות מדפסת ביולוגית תלת-ממדית בפורמט צלחת של 96 בארות או 384 בארות המתאים לניתוח סינון באמצעות טכניקות הדמיה עם צבעי תאים ונוגדנים, לצד מבחני צמיחה של נוירוטים. תאים מראים ביטוי של סמנים מסוג תא עצבי וצמיחה של תחזיות נוירוריט ואסטרוציטים תוך 7 ימים מהתרבית. לפיכך, פרוטוקול זה יציג את המתודולוגיה לפיתוח מודל קוקולטורה עצבית תלת-ממדית בתפוקה גבוהה לשימוש ביישומי גילוי תרופות.
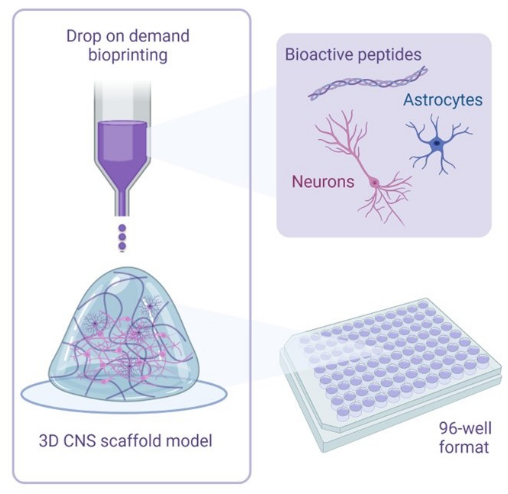
איור 1: סקירה כללית להמחשה של מתודולוגיה המשמשת להדפסה ביולוגית תלת-ממדית של תרבויות משותפות. תאי עצב ואסטרוציטים אנושיים שמקורם בתאי גזע פלוריפוטנטיים משולבים עם תמיסות אקטיבטור וביודיו המכילות פפטידים ביו-אקטיביים ומודפסים ביולוגית על פיגומי הידרוג’ל בפורמטים של 96 בארות או 384 בארות באמצעות טכנולוגיית הדפסה ביולוגית לפי דרישה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
Representative Results
Discussion
הצורך במודלים מדויקים של מערכת העצבים המרכזית מעולם לא היה גבוה יותר, והמגבלות של מודלים דו-ממדיים מסורתיים (2D) של תרביות תאים הניעו דור של מודלים מורכבים של מערכת העצבים המרכזית בשניםהאחרונות 19. עם זאת, מודלים תלת-ממדיים מורכבים רבים המייצגים אינטראקציות בין סוגי תאים עצביים לבין ECM יש מגבלות שימנעו את היישום של מודלים אלה בתהליכים תעשייתיים 6,20,21. בפרוטוקול זה, אנו מפתחים מודל קוקולטורה תלת-ממדית של נוירונים ואסטרוציטים אנושיים שמקורם ב-iPSC, שמטרתו לפתור חלק מהמגבלות הללו באמצעות טכנולוגיית הדפסה ביולוגית תלת-ממדית כדי ליצור פיגום הידרוג’ל ביו-אקטיבי בפורמטים של 96 בארות ו-384 בארות.
המתודולוגיה לפיתוח מודלים אלה פשטה באמצעות תוכנת עיצוב מפת הלוחות, פרוטוקולי הדפסה שנוצרו באופן אוטומטי ותהליך הדפסה מודרך מהמדפסת הביולוגית. עם זאת, בשל האופי הרגיש של סוגי התאים הרגישים שמקורם ב-iPSC המשמשים בפרוטוקול זה, יש לנקוט בזהירות עם השלבים הקריטיים הבאים בהפשרה ובתרבית. ראשית, להכללת מעכב ROCK (ROCKi) יש מספר יתרונות לאורך תהליך ההדפסה הביולוגית ובמהלך התרבות המוקדמת. הפשרת תאים היא נקודה קריטית שבה תאי העצב יכולים לחוות תגובת דחק, ופרוטוקולי הפשרה לא נכונים יכולים להקטין את סיכויי ההישרדות22. בדרך כלל מומלץ להפשיר תאים, להוסיף מדיה ולהעלות את התאים לטמפרטורת האינקובטור בצורה יעילה ככל האפשר23. עם זאת, במהלך תהליך ההדפסה הביולוגית המתואר בפרוטוקול זה, יש צורך שתאי עצב ואסטרוציטים יושהו מחדש בתמיסת אקטיבטור ולא במדיה, ותאים לא יתרוממו מעל טמפרטורת החדר עד סוף ריצת ההדפסה (עד 30 דקות לאחר ההפשרה). לפיכך, הוספת ROCKi למדיה מיד לאחר ההפשרה והכללתה במהלך שני שלבי הצנטריפוגה (שלבים 2.1–2.7 ו-1.3.15-1.3.20) הכרחית כדי לעכב מסלולי לחץ תאי, מה שיביא לרמות כדאיות נמוכות יותר24. יתר על כן, הוכח כי ROCKi מקדם צמיחה של נוירוטים ומשפר את ההתבגרות העצבית25. לפיכך, תוספת ROCKi נמשכת במשך 48 שעות לאחר הדפסה ביולוגית. עם זאת, זה הכרחי להסיר תוספת ROCKi לאחר 48 שעות כדי להבטיח שטיפה מלאה במהלך שינויי המדיה הבאים לפני התאים משמשים לבדיקה.
צעד נוסף הדורש תשומת לב קריטית הוא במהלך הוספת מדיה לאחר הדפסה ושינויים במדיה (שלבים 2.8-2.13). פיגום ההידרוג’ל המודפס ביולוגית הוא בעל קשיחות ביומכנית שוות ערך של 1.1 kPa בלבד, שווה ערך לחומר אפור. כפי שמתואר בשלב 2.10, קריטי לחדור בעדינות לצד הבאר במהלך חיבור המדיה ושאיפה למניעת הפרעה. זה רלוונטי במיוחד לצלחות 384 באר, שם רמת הג’ל תופסת שיעור גבוה יותר מנפח הבאר הכולל. שיטה זו צריכה לשמש גם בארות בקרה דו-ממדיות כדי למנוע הרמת קצה של תאים וגזירה של גידולי עצבים. המחברים רוצים גם להדגיש את החשיבות של טכניקה סטרילית בתוך המדפסת הביולוגית, אשר יש להתייחס אליה בזהירות שווה לזו של ארון בטיחות ביולוגית המשמש לתרביות תאים שמקורם ב- iPSC. זה כולל סינון סטרילי 70% EtOH ו-dH2O המשמש בתהליכי התאורה הירוקה וההדפסה, שמירה על מכסים על המחסניות והלוחות בעת העברת ידיים פנימה והחוצה מהמדפסת הביולוגית, וחיטוי משטחים בתוך המדפסת הביולוגית עם מגבוני אתנול 70% לפני ואחרי ההדפסה.
פיגום ההידרוג’ל המודפס ביולוגית, הנוצר מפתרונות ביו-דיו ואקטיבטור, שנבחר לפיתוח מודל זה, נבחר מתוך מגוון פתרונות ביו-דיו ואקטיבטור שפותחו על ידי Inventia Life Science לשימוש במדפסת הביולוגית RASטרום. למינין וחומצה היאלורונית זוהו כמולקולות רלוונטיות להבשלה עצבית הנגזרת מ- iPSC בשל תפקידן בהנחיה אקסונלית, היווצרות סינפסות ויצירת הרשת הפרינוירונלית26,27. יתר על כן, נבחרה קשיחות ביומכנית של 1.1 kPa, שכן הידרוג’לים בצפיפות נמוכה יותר הוכחו כמאפשרים צמיחה טובה יותר של נוירונים12. אם נעשים שינויים בפרוטוקול באמצעות נוירונים ואסטרוציטים שהובחנו בתוך החברה או מספק מסחרי אחר, מומלץ לבצע בדיקת בחירת מטריצה כדי לקבוע את פיגום ההידרוג’להתומך ביותר 15. יתר על כן, ייתכן שיהיה צורך למטב את צפיפות התאים אם נעשים שינויים במקורות התא כדי להבטיח כדאיות אופטימלית ולמנוע צפיפות הידרוג’ל. עבור כל השינויים ופתרון הבעיות הקשורים לפונקציית המדפסת הביולוגית, המחברים ממליצים לפנות ליצרנים ולהפנות לפרוטוקולי יצרן.
מערכת העצבים המרכזית מכילה מגוון רחב של תת-סוגים עצביים ותאי גלייה, שכולם קיימים בגומחות מוח שונות ויש להם תפקידים ספציפיים התורמים לתפקוד העצבי28. בהקשר של טווח רחב זה, מודל זה מייצג רק את שני סוגי התאים הנפוצים ביותר (אסטרוציטים ונוירונים גלוטמטרגיים מעוררים). סוגי תאים חשובים כגון מיקרוגליה, אוליגודנדרוציטים ותאי אנדותל יוצרי מחסום דם-מוח מושמטים ממערכת זו. הכללת מיקרוגליה יכולה להיות רלוונטית בהתמקדות באינטראקציות נוירואימוניות, ואוליגודנדרוציטים יכולים להיות בעלי עניין במחלות המשפיעות על מיאלינציה מרכזית. בנוסף לתפקידם בפתולוגיה, תאים כגון תאי אנדותל יוצרי מחסום דם-מוח מפרישים אנזימים לחילוף חומרים של תרופות, מה שעשוי להשפיע על השימוש במודל זה לבדיקות פרמקוקינטיות29. מגבלה נוספת של המודל עשויה להיות היחס בין אסטרוציטים לנוירונים; היחס בין אסטרוציטים לנוירונים משתנה מאוד בין אזורי המוח, עם ערכים מוצעים של בין 1:1 ל-1:330,31. מודל זה יש יחס משוער של 1:1.5 אסטרוציטים לנוירונים; לכן, ייתכן שהמודל הזה לא יהיה רלוונטי למודלים של אזורים במוח שבהם אסטרוציטים נפוצים יותר, כמו למשל באזורי החומר הלבן30.
פרוטוקולים אחרים לפיתוח מודלים של חקלאות ביולוגית מודפסת בתלת ממד פורסמו בשנים האחרונות. פרסום של Sullivan et al., 2021, הציג מודל עצבי מודפס ביולוגית תלת-ממדית באמצעות תאי אב עצביים שמקורם ב-iPSC, אשר מדגים כדאיות גבוהה לאחר הדפסה ושיפור התפקוד העצבי בהשוואה לתרביות דו-ממדיות32. עם זאת, בפרוטוקול זה, תאי אב עצביים שימשו כמקור תא ונשמרו בתרבית במשך 4 שבועות. בפרוטוקול זה נעשה שימוש מסחרי בנוירונים גלוטמטרגיים ובאסטרוציטים שמקורם ב-iPSC. זה מאפשר רשת תלת ממדית של תאים בתרבית משותפת כדי לקום בתוך 7 ימים בלבד; כפי שהודגם על ידי ניתוח צמיחת נוירוטים, צמיחת נוירויט מתחילה תוך 24 שעות וממשיכה באופן ליניארי לאורך 156 השעות שעבורן נוטרה צמיחת תאים. את ההקמה המהירה של רשתות אלה ניתן לייחס בחלקה לשימוש בנוירונים גלוטמטרגיים המשתמשים בביטוי גנים אופטימלי של NGN2 המושרה על ידי דוקסיציקלין, אשר מראה ביטוי של סמנים תת-עצביים בוגרים בתוך 7 ימים, אפילו בתרבית דו-ממדית33. קיצור תקופת צמיחה זו באמצעות טכניקה זו חשוב ליישום מודלים בתעשיית הביו-פרמצבטיקה, שכן פיתוח בדיקות דורש תפנית ופיתוח מהירים של מודלים תאיים15.
לסיכום, מודל זה מראה פוטנציאל למודל תלת ממדי של נוירונים ואסטרוציטים, אשר נקבע במהירות ובנוחות למטרות סינון. יישומים עתידיים עבור סוג מודל זה יכולים להיות עבור מאמצי גילוי תרופות על פני מחלות CNS שונות, עם הזדמנות להתרחב למחלות שונות באמצעות חולים או מחלות ערוכות גנטית iPSC. יתר על כן, השימוש בתאי עצב גלוטמטרגיים המופקים מ-iPSC בביטוי NGN2 המושרה על ידי דוקסיציקלין מאפשר לתאים להגיע לבגרות בפחות זמן, אשר ניתן לנצל לפיתוח מודלים של המוח המזדקן לחקר ניוון עצבי. מערכת זו יכולה להתרחב גם באמצעות שימוש בסוגי תאים נוספים בחקלאות משותפת, כולל מיקרוגליה ואוליגודנדרוציטים.
Disclosures
The authors have nothing to disclose.
Acknowledgements
המחברים מבקשים להודות לאלכס וולקרלינג, מרטין אנגל ורייצ’ל אקונומיק על עזרתם בפיתוח הפרוטוקול והמשוב על כתב היד.
Materials
| 2-mercaptoethanol | Thermofisher | 31350010 | |
| 384-well plate | PerkinElmer | 6057300 | |
| 96-well plate | PerkinElmer | 6055300 | |
| Activator fluid F299 | Inventia Life Science | N/A | |
| Activator fluid F3 | Inventia Life Science | N/A | |
| B27 (50x) minus Vit A | Thermofisher | 12587010 | |
| Bioink fluid F261 | Inventia Life Science | N/A | |
| Bioink fluid F32 | Inventia Life Science | N/A | |
| Doxycycline hyclate | Sigma Aldrich | D5207 | |
| GlutaMAX (100x) | Thermofisher | 35050061 | |
| Goat anti-mouse IgG H&L Alexa Fluor 647 | Abcam | ab150115 | |
| Goat anti-rabbit IgG H&L Alexa Fluor 488 | Abcam | ab150077 | |
| Hoechst | Abcam | ab228551 | |
| Human BDNF Recombinant Protein | Thermofisher | PHC7074 | |
| Human NT3 Recombinant Protein | Thermofisher | PHC7036 | |
| iCell Astrocytes | Fujifilm CDI | 1434 | |
| INCell Analyser 6500HS | Molecular Devices | N/A | high content imaging system |
| Incucyte S3 | Sartorius | N/A | |
| ioGlutamatergic Neurons (Large vial) | Bit.bio | e001 | |
| Laminin (1 mg/mL) | Sigma Aldrich | L2020 | |
| Live/dead kit (Calcein-AM, Ethidium homo-dimer-1) | Invitrogen | L3224 | |
| Mouse anti-BIII tubulin NL637 conjugated | R&D systems | SC024 | |
| Neurobasal media | Thermofisher | 21103049 | |
| Normal Donkey Serum | Abcam | ab7475 | |
| NucBlue Live (Hoechst 33342) | Thermofisher | R37605 | |
| Opti-MEM | Thermofisher | 11058021 | |
| Paraformaldehyde | Sigma Aldrich | P6148 | |
| PEI 50% in H2O | Sigma Aldrich | 181978 | |
| Pierce Borate Buffer 20x | Thermofisher | 28341 | |
| Prism | GraphPad | Data analysis software | |
| Rabbit anti-ionotropic glutamatre receptor 2 (GluR2) | Abcam | ab206293 | |
| RASTRUM(TM) Bioprinter | Inventia Life Science | N/A | Bioprinter |
| RASTRUM(TM) Bioprinter Cartridges | Inventia Life Science | N/A | Bioprinter Cartridges |
| RASTRUM(TM) Targeting plate | Inventia Life Science | N/A | Targeting plate |
| Rho kinase (ROCK) inhibitor | Abcam | ab120129 | |
| Sheep anti-GFAP NL493 conjugated | R&D systems | SC024 | |
| Signals Image Artist | PerkinElmer | N/A | Image analysis platform |
| Triton X-100 | Thermofisher | HFH10 | |
| Zeiss Axio Observer | Zeiss | N/A | Inverted microscope platform |
References
- Jung, Y. L., Hwang, J., Yoo, H. S. Disease burden metrics the innovations of leading pharmaceutical companies: a global and regional comparative study. Globalization and Health. 16 (1), 80-80 (2020).
- Potkin, S. G., et al. The neurobiology of treatment-resistant schizophrenia: paths to antipsychotic resistance and a roadmap for future research. npj Schizophrenia. 6, 1 (2020).
- Zahra, W., et al., Keswani, C., et al. The Global Economic Impact of Neurodegenerative Diseases: Opportunities and Challenges. Bioeconomy for Sustainable Development. , (2019).
- Perucca, E. The pharmacological treatment of epilepsy: recent advances and future perspectives. Acta Epileptologica. 3 (1), 22 (2021).
- Nikolakopoulou, P., et al. Recent progress in translational engineered in vitro models of the central nervous system. Brain. 143 (11), 3181-3213 (2020).
- Whitehouse, C., Corbett, N., Brownlees, J. 3D models of neurodegeneration: implementation in drug discovery. Trends in Pharmacological Sciences. 44 (4), 208-221 (2023).
- Rauti, R., Renous, N., Maoz, B. M. Mimicking the brain extracellular matrix in vitro: A review of current methodologies and challenges. Israel Journal of Chemistry. 60 (12), 1141-1151 (2020).
- Fawcett, J. W., Oohashi, T., Pizzorusso, T. The roles of perineuronal nets and the perinodal extracellular matrix in neuronal function. Nature Reviews Neuroscience. 20 (8), 451-465 (2019).
- Lam, D., et al. Tissue-specific extracellular matrix accelerates the formation of neural networks and communities in a neuron-glia co-culture on a multi-electrode array. Scientific Reports. 9, 4159 (2019).
- Roll, L., Lessmann, K., Brüstle, O., Faissner, A. Cerebral organoids maintain the expression of neural stem cell-associated glycoepitopes and extracellular matrix. Cells. 11 (5), 760 (2022).
- Yan, Y., Bejoy, J., Marzano, M., Li, Y. The use of pluripotent stem cell-derived organoids to study extracellular matrix development during neural degeneration. Cells. 8 (3), 242 (2019).
- Ma, L., et al. 3D bioprinted hyaluronic acid-based cell-laden scaffold for brain microenvironment simulation. Bio-Design and Manufacturing. 3 (3), 164-174 (2020).
- Liaw, C. -. Y., Ji, S., Guvendiren, M. Engineering 3D hydrogels for personalized in vitro human tissue models. Advanced Healthcare Materials. 7 (4), 1701165 (2018).
- Ma, J., Huang, C. Composition and mechanism of three-dimensional hydrogel system in regulating stem cell fate. Tissue Engineering Part B: Reviews. 26 (6), 498-518 (2020).
- Belfiore, L., et al. Generation and analysis of 3D cell culture models for drug discovery. European Journal of Pharmaceutical Sciences. 163, 105876 (2021).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6 (2018).
- Engel, M., Belfiore, L., Aghaei, B., Sutija, M. Enabling high throughput drug discovery in 3D cell cultures through a novel bioprinting workflow. SLAS Technology. 27 (1), 32-38 (2022).
- Takamura, T., et al. Influence of age on global and regional brain stiffness in young and middle-aged adults. Journal of Magnetic Resonance Imaging. 51 (3), 727-733 (2020).
- Slanzi, A., Iannoto, G., Rossi, B., Zenaro, E., Constantin, G. In vitro models of neurodegenerative diseases. Frontiers in Cell and Developmental Biology. 8, 328 (2020).
- de Souza, N. Organoid variability examined. Nature Methods. 14 (7), 655-655 (2017).
- Hernández, D., et al. Culture variabilities of human iPSC-derived cerebral organoids are a major issue for the modelling of phenotypes observed in Alzheimer’s disease. Stem Cell Review and Reports. 18 (2), 718-731 (2022).
- Li, R., et al. Differentiation of human iPS cells into sensory neurons exhibits developmental stage-specific cryopreservation challenges. Frontiers in Cell and Developmental Biology. 9, 796960 (2021).
- Nishiyama, Y., et al. Safe and efficient method for cryopreservation of human induced pluripotent stem cell-derived neural stem and progenitor cells by a programmed freezer with a magnetic field. Neuroscience Research. 107, 20-29 (2016).
- Uhrig, M., Ezquer, F., Ezquer, M. Improving cell recovery: Freezing and thawing optimization of induced pluripotent stem cells. Cells. 11 (5), 799 (2022).
- Harbom, L. J., et al. The effect of rho kinase inhibition on morphological and electrophysiological maturity in iPSC-derived neurons. Cell and Tissue Research. 375 (3), 641-654 (2019).
- Koh, H. S., Yong, T., Chan, C. K., Ramakrishna, S. Enhancement of neurite outgrowth using nano-structured scaffolds coupled with laminin. Biomaterials. 29 (26), 3574-3582 (2008).
- Tarus, D., et al. Design of hyaluronic acid hydrogels to promote neurite outgrowth in three dimensions. ACS Applied Materials & Interfaces. 8 (38), 25051-25059 (2016).
- Brain Initiative Cell Census Network (BICCN). Initiative Cell Census Network (BICCN). A multimodal cell census and atlas of the mammalian primary motor cortex. Nature. 598 (7879), 86-102 (2021).
- Dauchy, S., et al. Expression and transcriptional regulation of ABC transporters and cytochromes P450 in hCMEC/D3 human cerebral microvascular endothelial cells. Biochemical Pharmacology. 77 (5), 897-909 (2009).
- Herculano-Houzel, S. The glia/neuron ratio: How it varies uniformly across brain structures and species and what that means for brain physiology and evolution. Glia. 62 (9), 1377-1391 (2014).
- von Bartheld, C. S., Bahney, J., Herculano-Houzel, S. The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting. The Journal of Comparative Neurology. 524 (18), 3865-3895 (2016).
- Sullivan, M. A., et al. 3D bioprinting of stem cell-derived central nervous system cells enables astrocyte growth, vasculogenesis and enhances neural differentiation/function. bioRxiv. , (2022).
- Pawlowski, M., et al. Inducible and deterministic forward programming of human pluripotent stem cells into neurons, skeletal myocytes, and oligodendrocytes. Stem Cell Reports. 8 (4), 803-812 (2017).

