스크리닝 응용 분야를 위한 인간 iPSC 유래 뉴런-성상세포 공동 배양의 3차원 바이오프린팅
Summary
여기서는 iPSC 유래 뉴런 및 성상세포의 3D 바이오프린팅 공동 배양을 생산하기 위한 프로토콜을 제시합니다. 하이드로겔 스캐폴드 내에서 96웰 또는 384웰 형식으로 생성된 이 공동 배양 모델은 7일 이내에 높은 인쇄 후 생존율과 신경돌기 성장을 입증하고 두 세포 유형 모두에 대한 성숙 마커의 발현을 보여줍니다.
Abstract
세포 모델이 약물 스크리닝에 적합하려면 시스템이 효율적인 개발 시간과 함께 처리량 및 균질성 요구 사항을 충족해야 합니다. 그러나 게시된 많은 3D 모델은 이러한 기준을 충족하지 않습니다. 따라서 이는 초기 약물 발견 응용 분야에서 유용성을 제한합니다. 3차원(3D) 바이오프린팅은 3D 모델 개발에 적용하여 개발 시간을 단축하고 표준화를 높이며 처리량을 늘릴 수 있는 새로운 기술입니다. 여기에서는 인간 유도 만능 줄기 세포(iPSC) 유래 글루타마테르성 뉴런 및 성상교세포의 3D 바이오프린팅 공동 배양 모델을 개발하기 위한 프로토콜을 제시합니다. 이러한 공동 배양은 생체 활성 펩타이드, 전장 세포외 기질(ECM) 단백질의 하이드로겔 매트릭스 내에 내장되어 있으며 생리학적 강성은 1.1kPa입니다. 이 모델은 96웰 및 384웰 형식으로 신속하게 확립할 수 있으며 평균 72%의 인쇄 후 생존율을 생성합니다. 이 모델에서 성상세포(astrocyte) 대 뉴런(neuron)의 비율은 1:1.5로 나타났으며, 이는 인간 뇌의 생리학적 범위 내에 있습니다. 이러한 3D 바이오프린팅 세포 집단은 또한 배양 후 7일 이내에 성숙한 신경 세포 유형 마커의 발현과 신경돌기 및 성상세포 돌기의 성장을 보여줍니다. 결과적으로 이 모델은 신경돌기 성장 분석과 함께 세포 염료 및 면역염색 기법을 사용한 분석에 적합합니다. 이러한 생리학적으로 대표되는 모델을 대규모로 생성할 수 있는 능력은 신경 과학 표적에 대한 중간에서 높은 처리량의 스크리닝 분석에 사용하기에 이상적입니다.
Introduction
신약 개발 산업에서 중추신경계(CNS) 질환에 대한 연구가 확대되고 있습니다1. 그러나 간질, 정신분열증, 알츠하이머병과 같은 많은 중추신경계 질환은 여전히 완치법이 없다 2,3,4. 중추신경계 질환 전반에 걸쳐 효과적인 치료법이 부족한 것은 적어도 부분적으로는 정확한 뇌 체외 모델이 부족하기 때문이라고 할 수 있다5. 이로 인해 현재 in vitro 모델과 in vivo 데이터 간의 중개 격차가 발생하고 연구 노력에 병목 현상이 발생했습니다.
이러한 중개 격차로 인해 최근 몇 년 동안 신경 오가노이드, 신경 스페로이드 및 스캐폴드 기반 모델을 포함한 새로운 3D 세포 모델의 개발이 크게 증가했습니다6. 이러한 모델의 3D 구조는 생체역학적 스트레스, 세포 간 접촉 및 뇌 세포외 기질(ECM)을 포함한 신경 미세환경을 재현하는 데 도움이 됩니다7. 뇌 ECM은 신경 세포, 성상 교세포, 희소돌기아교세포 및 신경 혈관 단위7을 포함한 신경 세포 유형 사이의 공간을 차지하는 신경 생리학의 동적 요소입니다. 뇌 ECM의 재현은 신경 형태 및 신경 세포 발화에 영향을 미치는 것으로 나타났으며, 뇌의 많은 복잡한 3D 모델은 신경 세포 유형 8,9,10,11에 의한 ECM 단백질의 침착을 입증했습니다. 스캐폴드 기반 모델은 뇌 ECM(12)을 나타내는 다공성 합성 또는 생물학적 하이드로겔 매트릭스에 현탁된 성숙한 신경 공배양으로 구성됩니다. 오가노이드 및 스페로이드 시스템과 달리 스캐폴드 기반 3D 모델을 사용하면 존재하는 ECM 단백질을 맞춤화할 수 있으며 생체역학적 응력을 모방하기 위해 하이드로겔 강성을 조정할 수 있는 추가 이점이 있습니다13,14.
압도적 다수의 3D 신경 모델이 뇌 미세환경의 재현이 증가했음을 보여주지만, 모든 모델이 신약 개발 애플리케이션을 구현하는 데 적합한 것은 아니다15. 3D 모델이 산업 공정에 구현되려면 시스템이 스크리닝 응용 분야에 대한 처리량 요구 사항을 충족하고 개발 시간이 비교적 짧아야 합니다16. 3D 바이오프린팅은 인적 오류로 인한 변동성 제거와 함께 빠른 개발 시간, 처리량 증가, 더 높은 수준의 정밀 제어를 통해 3D 스캐폴드 기반 신경 모델을 생성할 수 있는 잠재력을 제공하는 새로운 기술입니다17. 이 프로토콜은 하이드로겔 스캐폴드에서 인간 iPSC 유래 글루타민성 뉴런 및 성상세포의 3D 공동 배양 모델을 제시합니다. 이 하이드로겔 스캐폴드는 생리학적으로 대표적인 생체 활성 펩타이드(RGD, IKVAV, YIGSR)와 ECM 단백질을 모방 생체역학적 강성 내에 함유하고 있습니다. 이러한 전장 ECM 단백질은 전장 라미닌-211과 히알루론산을 포함하며, 이는 인간 피질에 풍부하며, 생체 내 측정치에 따라 1.1kPa의 강성을 갖는다18. 이 모델은 신약 개발을 위해 실용적으로 설계되었으며, 신경돌기 돌출 분석과 함께 세포 염료 및 항체와 함께 이미징 기술을 사용한 스크리닝 분석에 적합한 96웰 또는 384웰 플레이트 형식의 3D 바이오프린터를 사용하여 생성됩니다. 세포는 배양 후 7일 이내에 신경 세포 유형 마커의 발현과 신경돌기 및 성상세포 돌기의 성장을 보여줍니다. 따라서 이 프로토콜은 약물 발견 응용 분야에 사용하기 위한 고처리량 3D 신경 공동 배양 모델을 개발하는 방법론을 제시합니다.
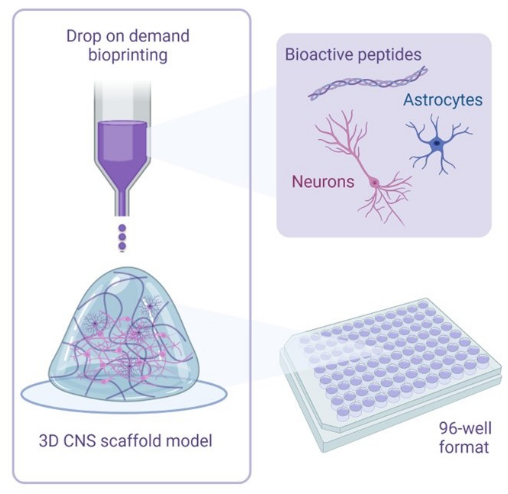
그림 1: 3D 바이오프린팅 공동 배양에 사용되는 방법론의 예시적 개요. 인간 iPSC 유래 뉴런 및 성상세포는 생체 활성 펩타이드를 함유한 활성제 및 바이오잉크 용액과 결합되며 드롭온디맨드 바이오프린팅 기술을 사용하여 96웰 또는 384웰 형식으로 하이드로겔 스캐폴드에 바이오프린팅됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
CNS의 정확한 모델에 대한 필요성이 그 어느 때보다 높아졌으며, 2차원(2D) 기존 세포 배양 모델의 한계로 인해 최근 몇 년 동안 복잡한 CNS 모델이 생성되었습니다19. 그러나 신경 세포 유형과 ECM 간의 상호 작용을 나타내는 많은 복잡한 3D 모델은 산업 공정에서 이러한 모델의 적용을 방해하는 한계가 있습니다 6,20,21. 이 프로토콜에서는 인간 iPSC 유래 뉴런 및 성상교세포의 3D 공동 배양 모델을 개발하며, 3D 바이오프린팅 기술을 사용하여 96웰 및 384웰 형식의 생체 활성 하이드로겔 스캐폴드를 만드는 것을 목표로 이러한 한계 중 일부를 해결하는 것을 목표로 합니다.
이러한 모델을 개발하기 위한 방법론은 플레이트 맵 설계 소프트웨어, 자동 생성된 인쇄 프로토콜 및 바이오프린터의 안내된 인쇄 프로세스를 통해 단순화되었습니다. 그러나 이 프로토콜에 사용된 민감한 iPSC 유래 세포 유형의 민감한 특성으로 인해 해동 및 배양에서 다음과 같은 중요한 단계를 거쳐야 합니다. 첫째, ROCK 억제제(ROCKi)의 포함은 바이오프린팅 과정과 초기 배양 전반에 걸쳐 여러 가지 이점이 있습니다. 세포 해동은 뉴런이 스트레스 반응을 경험할 수 있는 임계점이며, 부적절한 해동 프로토콜은 생존 가능성을 낮출 수 있다22. 일반적으로 세포를 해동하고, 배지를 추가하고, 세포를 가능한 한 효율적으로 인큐베이터 온도로 올리는 것이 좋습니다23. 그러나, 본 프로토콜에 기술된 바이오프린팅 공정 동안, 뉴런 및 성상교세포는 배지가 아닌 활성제 용액에 재현탁될 필요가 있으며, 세포는 프린트 실행이 끝날 때까지(해동 후 최대 30분까지) 실온 이상으로 상승되지 않을 것이다. 따라서, 해동 직후 배지에 ROCKi를 첨가하고 두 개의 원심분리 단계(단계 2.1–2.7 및 1.3.15-1.3.20 단계) 동안 이를 포함하는 것은 세포 스트레스 경로를 억제하는 데 필수적이며, 이는 생존도 수준을 낮추는 결과를 초래할 것이다24. 또한, ROCKi는 신경돌기 성장을 촉진하고 신경 세포 성숙을 개선하는 것으로 나타났습니다25. 따라서 ROCKi 보충은 바이오프린팅 후 48시간 동안 계속됩니다. 그러나 세포를 분석에 사용하기 전에 후속 배지 교체 중에 완전히 씻어낼 수 있도록 48시간 후에 ROCKi 보충제를 제거하는 것이 필수적입니다.
중요한 주의가 필요한 추가 단계는 인쇄 후 미디어 추가 및 미디어 변경 중입니다(2.8-2.13단계). 바이오프린팅된 하이드로겔 스캐폴드는 회백질에 해당하는 1.1kPa에 불과한 생체역학적 강성을 가지고 있습니다. 2.10단계에서 설명한 바와 같이, 교란을 방지하기 위해 배지 추가 및 흡인 중에 웰 측면에 피펫팅을 부드럽게 하는 것이 중요합니다. 이는 겔 레벨이 전체 웰 부피에서 더 높은 비율을 차지하는 384웰 플레이트와 특히 관련이 있습니다. 이 방법은 세포의 가장자리 리프팅 및 신경돌기 돌출물의 전단을 방지하기 위해 2D 제어 웰에서도 사용해야 합니다. 저자는 또한 iPSC 유래 세포 배양에 사용되는 생물 안전 캐비닛과 동등한 주의를 기울여 취급해야 하는 바이오프린터 내 멸균 기술의 중요성을 강조하고자 합니다. 여기에는 그린라이팅 및 인쇄 절차에 사용되는 70% EtOH 및 dH2O의 멸균 필터링, 바이오프린터 안팎으로 손을 움직이는 동안 카트리지 및 플레이트의 뚜껑 유지, 인쇄 전후에 70% 에탄올 와이프로 바이오프린터 내부 표면의 오염 제거가 포함됩니다.
이 모델을 개발하기 위해 선택된 바이오잉크 및 활성제 용액으로 형성된 바이오프린팅 하이드로겔 스캐폴드는 RASTRUM 바이오프린터 내에서 사용하기 위해 Inventia Life Science에서 개발한 다양한 바이오잉크 및 활성제 솔루션 중에서 선택됩니다. 라미닌과 히알루론산은 축삭 유도, 시냅스 형성 및 신경 주위 그물 형성에 대한 역할로 인해 iPSC 유래 신경 세포 성숙과 관련된 분자로 확인되었습니다26,27. 또한, 1.1kPa의 생체역학적 강성이 선택되었는데, 이는 저밀도 하이드로겔이 뉴런12로부터 더 나은 신경돌기 성장을 가능하게 하는 것으로 나타났기 때문이다. 사내에서 또는 다른 상업적 공급자로부터 분화된 뉴런 및 성상교세포를 사용하여 프로토콜을 수정하는 경우, 가장 지지력이 높은 하이드로겔 스캐폴드(15)를 결정하기 위해 매트릭스 선택 테스트를 수행하는 것이 권장될 것이다. 또한, 최적의 생존력을 보장하고 하이드로겔 과밀화를 방지하기 위해 세포 공급원을 변경하는 경우 세포 밀도를 최적화해야 할 수도 있습니다. 바이오프린터 기능과 관련된 모든 수정 및 문제 해결에 대해 저자는 제조업체에 문의하고 제조업체 프로토콜을 참조할 것을 권장합니다.
중추신경계(CNS)는 광범위한 신경 아형(neuronal subtype)과 신경교세포(glial cell)를 포함하고 있으며, 이들 모두는 서로 다른 뇌 틈새에 존재하며 신경 기능에 기여하는 특정한 역할을 한다28. 이 광범위한 범위의 맥락에서 이 모델은 가장 풍부한 두 가지 세포 유형(성상교세포와 흥분성 글루타민성 뉴런)만을 나타냅니다. 미세아교세포(microglia), 희소돌기아교세포(oligodendrocyte) 및 혈액뇌장벽(blood-brain barrier-form) 내피세포와 같은 중요한 세포 유형은 이 시스템에서 생략됩니다. 미세아교세포의 포함은 신경면역 상호작용에 초점을 맞추는 것과 관련이 있을 수 있으며, 희소돌기아교세포는 중추 수초화에 영향을 미치는 질병에 관심이 있을 수 있습니다. 병리학에서의 역할 외에도 혈액-뇌 장벽 형성 내피 세포와 같은 세포는 약물 대사 효소를 분비하며, 이는 약동학 분석을 위한 이 모델의 사용에 영향을 미칠 수 있습니다29. 모델의 또 다른 한계는 성상교세포(astrocyte)와 뉴런(neuron)의 비율일 수 있다. 성상교세포(astrocyte)와 뉴런(neuron)의 비율은 뇌 부위에 따라 크게 다르며, 1:1에서 1:3 사이의 값이 제안된다30,31. 이 모델은 대략 1:1.5 성상교세포와 뉴런의 비율을 가지고 있습니다. 따라서, 이 모델은 성상교세포(astrocyte)가 더 풍부한 뇌 영역(예: 백질 영역(30))을 모델링하는 것과는 관련이 없을 수 있다.
최근 몇 년 동안 3D 바이오프린팅 공동 배양 모델을 개발하기 위한 다른 프로토콜이 발표되었습니다. Sullivan et al., 2021의 간행물에서는 iPSC 유래 신경 전구 세포를 사용하여 3D 바이오프린팅 신경 모델을 제시했으며, 이는 2D 배양에 비해 높은 인쇄 후 생존력과 신경 기능 향상을 보여줍니다32. 그러나, 이 프로토콜에서는 신경 전구 세포를 세포 공급원으로 사용하였고 4주 동안 배양하였다. 이 프로토콜에서는 상업적으로 이용 가능한 iPSC 유래 글루타민성 뉴런 및 성상세포를 사용했습니다. 이를 통해 공동 배양 세포의 3D 네트워크를 7일 이내에 구축할 수 있습니다. 신경돌기 성장 분석에서 입증된 바와 같이, 신경돌기 성장은 24시간 이내에 시작되어 세포 성장을 모니터링한 156시간 동안 선형 방식으로 계속됩니다. 이러한 네트워크의 빠른 구축은 부분적으로 NGN2의 최적화된 독시사이클린 유도 유전자 발현을 사용하는 글루타민성 뉴런의 사용에 기인할 수 있으며, 이는 2D 배양에서도 7일 이내에 성숙한 뉴런 아형 마커의 발현을 보여줍니다33. 이 기술을 사용하여 이러한 성장 기간을 단축하는 것은 분석 개발이 세포 모델15의 신속한 턴어라운드와 개발을 필요로 하기 때문에 바이오 제약 산업 내에서 모델을 구현하는 데 중요합니다.
결론적으로, 이 모델은 스크리닝 목적으로 빠르고 편리하게 확립된 뉴런 및 성상교세포의 3D 모델에 대한 가능성을 보여줍니다. 이 모델 유형의 향후 응용 분야는 환자 또는 유전자 편집 질환 iPSC 라인을 사용하여 다양한 질병으로 확장할 수 있는 기회와 함께 다양한 CNS 질환에 대한 약물 발견 노력에 사용될 수 있습니다. 또한, 독시사이클린 유도 NGN2 발현 iPSC 유래 글루타마테르성 뉴런을 사용하면 세포가 더 짧은 시간에 성숙할 수 있으며, 이는 신경 퇴행 연구를 위한 노화 뇌 모델 개발에 활용될 수 있습니다. 이 시스템은 또한 미세아교세포(microglia)와 희소돌기아교세포(oligodendrocyte)를 포함한 공동 배양에서 추가 세포 유형을 사용하여 확장될 수 있습니다.
Disclosures
The authors have nothing to disclose.
Acknowledgements
저자는 프로토콜 개발과 원고에 대한 피드백에 도움을 준 Alex Volkerling, Martin Engel 및 Rachel Bleach에게 감사의 뜻을 전합니다.
Materials
| 2-mercaptoethanol | Thermofisher | 31350010 | |
| 384-well plate | PerkinElmer | 6057300 | |
| 96-well plate | PerkinElmer | 6055300 | |
| Activator fluid F299 | Inventia Life Science | N/A | |
| Activator fluid F3 | Inventia Life Science | N/A | |
| B27 (50x) minus Vit A | Thermofisher | 12587010 | |
| Bioink fluid F261 | Inventia Life Science | N/A | |
| Bioink fluid F32 | Inventia Life Science | N/A | |
| Doxycycline hyclate | Sigma Aldrich | D5207 | |
| GlutaMAX (100x) | Thermofisher | 35050061 | |
| Goat anti-mouse IgG H&L Alexa Fluor 647 | Abcam | ab150115 | |
| Goat anti-rabbit IgG H&L Alexa Fluor 488 | Abcam | ab150077 | |
| Hoechst | Abcam | ab228551 | |
| Human BDNF Recombinant Protein | Thermofisher | PHC7074 | |
| Human NT3 Recombinant Protein | Thermofisher | PHC7036 | |
| iCell Astrocytes | Fujifilm CDI | 1434 | |
| INCell Analyser 6500HS | Molecular Devices | N/A | high content imaging system |
| Incucyte S3 | Sartorius | N/A | |
| ioGlutamatergic Neurons (Large vial) | Bit.bio | e001 | |
| Laminin (1 mg/mL) | Sigma Aldrich | L2020 | |
| Live/dead kit (Calcein-AM, Ethidium homo-dimer-1) | Invitrogen | L3224 | |
| Mouse anti-BIII tubulin NL637 conjugated | R&D systems | SC024 | |
| Neurobasal media | Thermofisher | 21103049 | |
| Normal Donkey Serum | Abcam | ab7475 | |
| NucBlue Live (Hoechst 33342) | Thermofisher | R37605 | |
| Opti-MEM | Thermofisher | 11058021 | |
| Paraformaldehyde | Sigma Aldrich | P6148 | |
| PEI 50% in H2O | Sigma Aldrich | 181978 | |
| Pierce Borate Buffer 20x | Thermofisher | 28341 | |
| Prism | GraphPad | Data analysis software | |
| Rabbit anti-ionotropic glutamatre receptor 2 (GluR2) | Abcam | ab206293 | |
| RASTRUM(TM) Bioprinter | Inventia Life Science | N/A | Bioprinter |
| RASTRUM(TM) Bioprinter Cartridges | Inventia Life Science | N/A | Bioprinter Cartridges |
| RASTRUM(TM) Targeting plate | Inventia Life Science | N/A | Targeting plate |
| Rho kinase (ROCK) inhibitor | Abcam | ab120129 | |
| Sheep anti-GFAP NL493 conjugated | R&D systems | SC024 | |
| Signals Image Artist | PerkinElmer | N/A | Image analysis platform |
| Triton X-100 | Thermofisher | HFH10 | |
| Zeiss Axio Observer | Zeiss | N/A | Inverted microscope platform |
References
- Jung, Y. L., Hwang, J., Yoo, H. S. Disease burden metrics the innovations of leading pharmaceutical companies: a global and regional comparative study. Globalization and Health. 16 (1), 80-80 (2020).
- Potkin, S. G., et al. The neurobiology of treatment-resistant schizophrenia: paths to antipsychotic resistance and a roadmap for future research. npj Schizophrenia. 6, 1 (2020).
- Zahra, W., et al., Keswani, C., et al. The Global Economic Impact of Neurodegenerative Diseases: Opportunities and Challenges. Bioeconomy for Sustainable Development. , (2019).
- Perucca, E. The pharmacological treatment of epilepsy: recent advances and future perspectives. Acta Epileptologica. 3 (1), 22 (2021).
- Nikolakopoulou, P., et al. Recent progress in translational engineered in vitro models of the central nervous system. Brain. 143 (11), 3181-3213 (2020).
- Whitehouse, C., Corbett, N., Brownlees, J. 3D models of neurodegeneration: implementation in drug discovery. Trends in Pharmacological Sciences. 44 (4), 208-221 (2023).
- Rauti, R., Renous, N., Maoz, B. M. Mimicking the brain extracellular matrix in vitro: A review of current methodologies and challenges. Israel Journal of Chemistry. 60 (12), 1141-1151 (2020).
- Fawcett, J. W., Oohashi, T., Pizzorusso, T. The roles of perineuronal nets and the perinodal extracellular matrix in neuronal function. Nature Reviews Neuroscience. 20 (8), 451-465 (2019).
- Lam, D., et al. Tissue-specific extracellular matrix accelerates the formation of neural networks and communities in a neuron-glia co-culture on a multi-electrode array. Scientific Reports. 9, 4159 (2019).
- Roll, L., Lessmann, K., Brüstle, O., Faissner, A. Cerebral organoids maintain the expression of neural stem cell-associated glycoepitopes and extracellular matrix. Cells. 11 (5), 760 (2022).
- Yan, Y., Bejoy, J., Marzano, M., Li, Y. The use of pluripotent stem cell-derived organoids to study extracellular matrix development during neural degeneration. Cells. 8 (3), 242 (2019).
- Ma, L., et al. 3D bioprinted hyaluronic acid-based cell-laden scaffold for brain microenvironment simulation. Bio-Design and Manufacturing. 3 (3), 164-174 (2020).
- Liaw, C. -. Y., Ji, S., Guvendiren, M. Engineering 3D hydrogels for personalized in vitro human tissue models. Advanced Healthcare Materials. 7 (4), 1701165 (2018).
- Ma, J., Huang, C. Composition and mechanism of three-dimensional hydrogel system in regulating stem cell fate. Tissue Engineering Part B: Reviews. 26 (6), 498-518 (2020).
- Belfiore, L., et al. Generation and analysis of 3D cell culture models for drug discovery. European Journal of Pharmaceutical Sciences. 163, 105876 (2021).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6 (2018).
- Engel, M., Belfiore, L., Aghaei, B., Sutija, M. Enabling high throughput drug discovery in 3D cell cultures through a novel bioprinting workflow. SLAS Technology. 27 (1), 32-38 (2022).
- Takamura, T., et al. Influence of age on global and regional brain stiffness in young and middle-aged adults. Journal of Magnetic Resonance Imaging. 51 (3), 727-733 (2020).
- Slanzi, A., Iannoto, G., Rossi, B., Zenaro, E., Constantin, G. In vitro models of neurodegenerative diseases. Frontiers in Cell and Developmental Biology. 8, 328 (2020).
- de Souza, N. Organoid variability examined. Nature Methods. 14 (7), 655-655 (2017).
- Hernández, D., et al. Culture variabilities of human iPSC-derived cerebral organoids are a major issue for the modelling of phenotypes observed in Alzheimer’s disease. Stem Cell Review and Reports. 18 (2), 718-731 (2022).
- Li, R., et al. Differentiation of human iPS cells into sensory neurons exhibits developmental stage-specific cryopreservation challenges. Frontiers in Cell and Developmental Biology. 9, 796960 (2021).
- Nishiyama, Y., et al. Safe and efficient method for cryopreservation of human induced pluripotent stem cell-derived neural stem and progenitor cells by a programmed freezer with a magnetic field. Neuroscience Research. 107, 20-29 (2016).
- Uhrig, M., Ezquer, F., Ezquer, M. Improving cell recovery: Freezing and thawing optimization of induced pluripotent stem cells. Cells. 11 (5), 799 (2022).
- Harbom, L. J., et al. The effect of rho kinase inhibition on morphological and electrophysiological maturity in iPSC-derived neurons. Cell and Tissue Research. 375 (3), 641-654 (2019).
- Koh, H. S., Yong, T., Chan, C. K., Ramakrishna, S. Enhancement of neurite outgrowth using nano-structured scaffolds coupled with laminin. Biomaterials. 29 (26), 3574-3582 (2008).
- Tarus, D., et al. Design of hyaluronic acid hydrogels to promote neurite outgrowth in three dimensions. ACS Applied Materials & Interfaces. 8 (38), 25051-25059 (2016).
- Brain Initiative Cell Census Network (BICCN). Initiative Cell Census Network (BICCN). A multimodal cell census and atlas of the mammalian primary motor cortex. Nature. 598 (7879), 86-102 (2021).
- Dauchy, S., et al. Expression and transcriptional regulation of ABC transporters and cytochromes P450 in hCMEC/D3 human cerebral microvascular endothelial cells. Biochemical Pharmacology. 77 (5), 897-909 (2009).
- Herculano-Houzel, S. The glia/neuron ratio: How it varies uniformly across brain structures and species and what that means for brain physiology and evolution. Glia. 62 (9), 1377-1391 (2014).
- von Bartheld, C. S., Bahney, J., Herculano-Houzel, S. The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting. The Journal of Comparative Neurology. 524 (18), 3865-3895 (2016).
- Sullivan, M. A., et al. 3D bioprinting of stem cell-derived central nervous system cells enables astrocyte growth, vasculogenesis and enhances neural differentiation/function. bioRxiv. , (2022).
- Pawlowski, M., et al. Inducible and deterministic forward programming of human pluripotent stem cells into neurons, skeletal myocytes, and oligodendrocytes. Stem Cell Reports. 8 (4), 803-812 (2017).

