Kvantificering af antistofafhængig cellulær cytotoksicitet i en tumorsfæroidmodel: ansøgning om lægemiddelopdagelse
Summary
Her præsenterer vi en metode til at identificere forbindelser, der modulerer ADCC-mekanismen, en vigtig kræftcelledræbende mekanisme af antitumorantistoffer. Den cytotoksiske virkning af NK-celler måles i brystkræftcellesfæroider ved tilstedeværelse af Trastuzumab. Billedanalyse identificerer levende og døde dræber- og målceller i sfæroider.
Abstract
Monoklonal antistofbaseret immunterapi rettet mod tumorantigener er nu en grundpille i kræftbehandling. En af antistoffernes klinisk relevante virkningsmekanismer er antistofafhængig cellulær cytotoksicitet (ADCC), hvor antistoffet binder sig til kræftcellerne og engagerer immunsystemets cellulære komponent, fx naturlige dræberceller (NK), for at dræbe tumorcellerne. Effektiviteten af disse terapier kan forbedres ved at identificere adjuvansforbindelser, der øger kræftcellernes følsomhed eller immuncellernes styrke. Derudover kan uopdagede lægemiddelinteraktioner hos kræftpatienter, der er co-medicineret for tidligere tilstande eller kræftassocierede symptomer, bestemme succesen med antistofbehandlingen; Derfor skal sådanne uønskede lægemiddelinteraktioner elimineres. Med disse mål i tankerne skabte vi en kræft-ADCC-model og beskriver her en simpel protokol til at finde ADCC-modulerende lægemidler. Da 3D-modeller såsom kræftcellesfæroider er bedre end 2D-kulturer til at forudsige in vivo-reaktioner fra tumorer til kræftbehandlinger, sfæroid-cokulturer af EGFP-ekspressive HER2 + JIMT-1 brystkræftceller og NK92. CD16-cellelinjer blev oprettet og induceret med Trastuzumab, et monoklonalt antistof, der er klinisk godkendt mod HER2-positiv brystkræft. JIMT-1 sfæroider fik lov til at danne sig i celleafvisende U-bund 96-brøndplader. På dag 3 blev NK-celler og Trastuzumab tilsat. Sfæroiderne blev derefter farvet med Annexin V-Alexa 647 for at måle apoptotisk celledød, som blev kvantificeret i sfæroidernes perifere zone med et automatiseret mikroskop. Anvendeligheden af vores analyse til at identificere ADCC-modulerende molekyler demonstreres ved at vise, at Sunitinib, en receptortyrosinkinasehæmmer, der er godkendt af FDA mod metastatisk kræft, næsten helt afskaffer ADCC. Genereringen af sfæroider og billedoptagelses- og analyserørledninger er kompatible med screening med høj kapacitet for ADCC-modulerende forbindelser i kræftcellesfæroider.
Introduction
Multicellulære tumorsfæroider (MCTS) er almindeligt anvendte tredimensionelle (3D) modeller, der dannes på grund af vedhængende cellers tendens til at aggregere og repræsenterer et vigtigt redskab til at opnå mekanistisk indsigt i kræftcellebiologi. De kan genereres fra en bred vifte af celletyper ved hjælp af adskillige teknikker, såsom væskebaserede og stilladsbaserede 3D-kulturer1. Deres største fordel i forhold til monolag 2D-modeller er, at de rekapitulerer hovedtræk ved in vivo-tumorer , nemlig strukturel organisation og hypoxi, ved at efterligne tumorcellernes biologiske opførsel, især de mekanismer, der fører til terapeutisk flugt og lægemiddelresistens2. Da MCTS således kan forbedre forudsigeligheden af toksicitet og lægemiddelfølsomhed, anvendes de i vid udstrækning til at studere kræft i 3D og kan forbedre udviklingen af effektive lægemidler til forskellige typer kræft3.
For at studere enhver sygdom er der et kritisk behov for relevante og bekvemme modeller. Opsætning af modeller til kræftimmunologiske undersøgelser er udfordrende, fordi immunsystemet består af flere celletyper. Hver celletype har flere undertyper og et bredt spektrum af aktiveringstilstande. Disse forskellige immuncelletyper interagerer med kræftceller og andre tumorkomponenter, hvilket i sidste ende påvirker resultatet af sygdommen. 2D in vitro-cellekulturmetoder kan ikke rekapitulere disse komplekse cellulære interaktioner, da de mangler oversættelighed og ikke er i stand til at forudsige virkningen af et lægemiddel på systemniveau (f.eks. i væv)4,5. Desuden har musemodeller også alvorlige begrænsninger på grund af de grundlæggende forskelle mellem det menneskelige og murinske immunsystem. 3D-kultursystemer kan derfor udfylde de nuværende huller i tilgængelige modeller, give en alternativ metode og forbedre vores forståelse af kræftimmunologi6. Specifikt kan sfæroidmodeller anvendes til test af immunterapier, hovedsageligt for at vurdere effektiviteten af lægemiddelscreening og terapeutiske antistoffer til forbedring af immuncelleinfiltration og antitumorale virkninger mod sfæroidmålene7. Endvidere er potentialet i MCTS, der består af celler i forskellige metaboliske og proliferative tilstande, til at undersøge interaktionerne mellem stromaceller (f.eks. lymfocytter, makrofager, fibroblaster) og kræftceller og til udvikling af nye kræftbekæmpelsesstrategier blevet rigeligt påvist8. Derfor er der et vitalt behov for at bekræfte prædiktive og nøjagtige platforme for at øge lægemiddeltestprocessen under hensyntagen til patofysiologien i tumormikromiljøet.
Brystkræft (BC) er den hyppigste kræftform, der diagnosticeres på verdensplan hos kvinder. Den kliniske klassificering af denne heterogene sygdom er baseret på tilstedeværelsen af transmembranreceptorer, fx østrogen (ER) og progesteron (PR) receptorer (samlet kaldet hormonreceptorer, HR) sammen med overekspression eller amplifikation af det humane epidermale vækstfaktorreceptor 2 (HER2) protein / onkogen. Baseret på den immunhistokemiske ekspression af disse receptorer genkendes fire undertyper almindeligvis: luminal A (HR+/HER2-), luminal B (HR+/HER2+), HER2-positiv (HR-/HER2+) og triple-negativ brystkræft (HR-/HER2-). HER2+ gruppen udgør 10-15% af BC tilfældene og er kendetegnet ved høj HER2 ekspression med fravær af ER og PR, har en dårligere prognose sammenlignet med luminale tumorer, og kræver specifikke lægemidler rettet mod HER2/neu proteinet9.
BC-udvikling er en proces i flere trin, og en tidlig diagnose er afgørende for en vellykket behandling af sygdommen10. På trods af nyligt fremkomne personlige BC-behandlingsmuligheder (f.eks. Endokrine og anti-HER2-antistofterapier) fortsætter BC med at udfordre onkologer. Ligesom kirurgi, kemoterapi og strålebehandling kan disse personlige terapier også have alvorlige bivirkninger, og patienter kan udvikle resistens over for disse midler, hvilket gør det til en langsigtet udfordring at bestemme den bedste strategi11,12. Derfor er forbedret forståelse af samspillet mellem tumoren og dens mikromiljø afgørende og forventes at give nye retninger for udviklingen af nye behandlinger, der tager hensyn til de særlige forhold i de forskellige BC-undertyper13. En ny bølge af immunterapier, såsom antistoflægemiddelkonjugater, adoptive T-celleterapier, vacciner og nye HER2-rettede monoklonale antistoffer (mAbs) undersøges i en bred population af patienter med HER2-ekspressive tumorer14.
Trastuzumab repræsenterer for eksempel en effektiv behandlingsmodalitet for HER2+ BC. Som en del af sin virkningsmekanisme medierer Trastuzumab fragmentkrystalliserbare gammareceptor (FcγR)-afhængige aktiviteter. FcγR’er kendetegnes ved deres affinitet for Fc-fragmentet og det immunrespons, de initierer. Aktivering af FcγRIIIa (CD16A) på naturlige dræberceller (NK) er afgørende for formidling af antistofafhængig cellulær cytotoksicitet (ADCC), mens udløsning af FcγRIIa (CD32A) og FcγRIIIa på makrofager inducerer antistofafhængig cellulær fagocytose (ADCP)15. Undersøgelser af dyremodeller viste, at mus, der manglede FcγRI (CD64) og FcγRIII (CD16) receptorer, ikke var i stand til at indlede beskyttende immunresponser mod tumorspecifikke antigener, hvilket afslørede, at ADCC sandsynligvis er en vigtig virkningsmekanisme for mAb Trastuzumab16.
Da NK-celler tyr til tumorcellebundet Abs til kræftcelledrab af ADCC, er ekspression af Fc-receptorer afgørende for en effektiv behandling med Trastuzumab17 (figur 1). Desuden afbalanceres deres virkning effektivt af en stimulering af aktiverende og hæmmende receptorer, fx dræbercelleimmunoglobulinlignende (KIR) receptorer18.
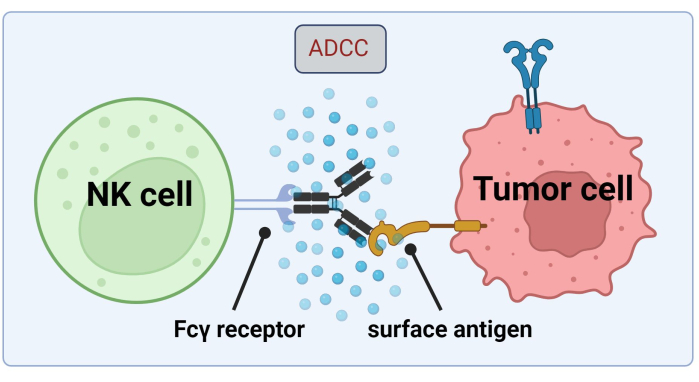
Figur 1. Mekanisme af ADCC i forbindelse med en antitumorrespons. Fcγ-receptoren i en naturlig dræbercelle (NK) genkender Fc-regionen af et antistof, som tidligere havde bundet sig til et overfladeantigen på en kræftcelle. Denne immunologiske synaps fører til degranulering af NK-cellen, som frigiver cytotoksiske mediatorer såsom granzymer og perforin. Disse molekyler bidrager til poredannelse i cellemembranen og aktiverer apoptotiske veje, der forårsager programmeret celledød i målcellen (billede oprettet med Biorender.com). Klik her for at se en større version af denne figur.
Udvikling af immunterapi til HER2+ BC repræsenterer et felt i udvikling. I dette tilfælde bør man overveje interaktioner mellem forskellige komponenter i immunsystemet. Desuden har tidligere publikationer grundigt testet kombinationsterapier, der involverer alle typer traditionelle, immun- eller celleterapier for at identificere synergiserende kombinationer19.
Flere 3D-modeller af HER2+ BC har tidligere været brugt til lægemiddelforskning. For eksempel brugte Balalaeva et al. SKBR-3-sfæroider, der overudtrykte HER2, til at vurdere cytotoksiciteten af det HER2-målrettede immunotoksin 4D5scFv-PE4020. I en anden undersøgelse blev der etableret et 3D Matrigel-baseret HER2+ BC-kultursystem til måling af cellevækst som reaktion på Trastuzumab og endokrine midler21. Disse undersøgelser fremhæver vigtigheden af tumorsfæroidmodeller af HER2, der overudtrykker kræftceller for at repræsentere en effektiv strategi til klinisk forbedring af terapeutiske reaktioner22.
Vores gruppe identificerede tidligere Sunitinib, en multimålrettet tyrosinkinasehæmmer, som en hæmmer af Trastuzumab-afhængig ADCC i JIMT-1 HER2 + BC-celler i et 2D-kulturassay. Undersøgelsen afslørede, at Sunitinib inducerer autofagi og forringer NK-cellers dræbende funktion, nedregulerer HER2-ekspression og forbedrer overfladebinding af JIMT-1-celler17.
Her etablerede vi en ny 3D, sfærisk ADCC-model (NK.92.CD16+Trastuzumab+JIMT-1-EGFP-kræftceller), der skulle bruges til screeningsapplikationer med høj kapacitet, og for at validere ovennævnte resultater blev Sunitinib anvendt som modelforbindelse. Først genererede vi EGFP, der udtrykte JIMT-1-celler17 og dyrkede sfæroider fra disse celler. ADCC blev induceret af NK-celler sammen med Trastuzumab, og sfæroider blev holdt i kultur i tilstedeværelse eller fravær af teststoffer i 24 timer (figur 2). Kvantificering af ADCC er baseret på påvisning af apoptotisk kræftcelledød (Annexin V-farvning) ved hjælp af et højindholdsanalysesystem.
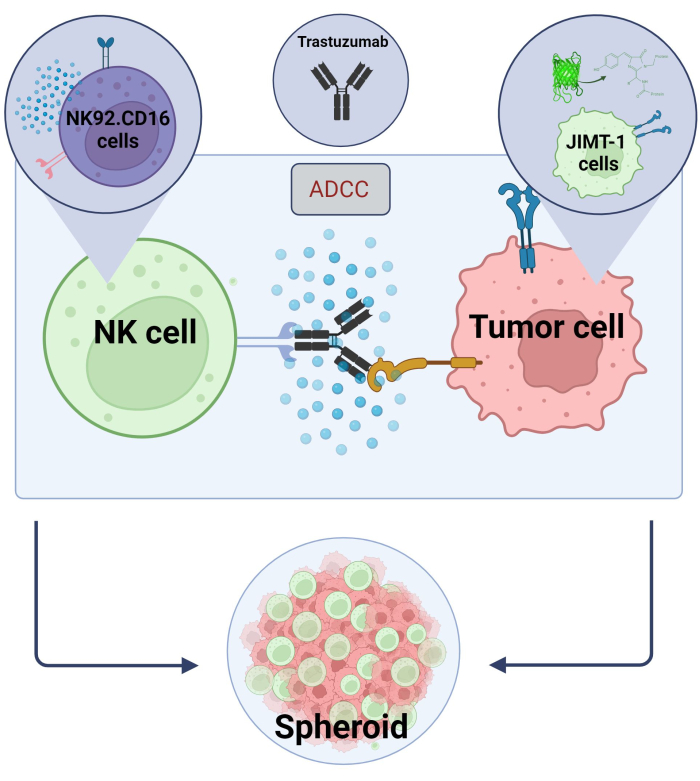
Figur 2. ADCC i et 3D sfærisk co-kultur system. Vores eksperimentelle indstillinger er baseret på et 3D-sfærisk system, der mere præcist kan modellere in vivo-mikromiljøet sammenlignet med 2D-modeller. JIMT-1 EGFP brystkræftceller blev podet på en konkav celleafvisende bund for at danne en rundformet cellulær klynge, kaldet sfæroide. ADCC blev derefter indledt ved at tilføje NK92. CD16 naturlige dræberceller (E:T-forhold = 20:1) og et anti-HER2 monoklonalt antistof, Trastuzumab. Den eksperimentelle model har vist sig effektiv og let anvendelig til identifikation af ADCC-modificerende testforbindelser (billede oprettet med Biorender.com). Klik her for at se en større version af denne figur.
Vi demonstrerede, at indsamling af data på denne måde kan gøres i realtid og er statistisk robust til brug i screening med højt indhold i kræftlægemiddelopdagelse. Det er vigtigt, at denne model giver mulighed for en udvidet validering af et større sæt forbindelser, og den kan anvendes på flere analyser af interesse.
Protocol
Representative Results
Discussion
På trods af betydelige forbedringer i behandlingen af BC i løbet af de sidste årtier udvikler patienter stadig regelmæssigt medicinresistens eller oplever negative bivirkninger24. Den høje sygelighed og dødelighed, der er forbundet med BC, kræver en fortsat undersøgelse af de underliggende molekylære mekanismer, ligesom robuste screeningsplatforme til at identificere nye molekyler, der kan handles på til terapeutisk udvikling25. Disse strategier kræver cellekultu…
Disclosures
The authors have nothing to disclose.
Acknowledgements
LV modtog støtte fra National Research, Development and Innovation Office grants GINOP-2.3.2-15-2016-00010 TUMORDNS”, GINOP-2.3.2-15-2016-00048-STAYALIVE, OTKA K132193 og K147482. Dette projekt har modtaget støtte fra HUN-REN Hungarian Research Network. CD16.176V.NK-92 celler blev opnået fra Dr. Kerry S. Campbell (Fox Chase Center, Philadelphia, PA, på vegne af Brink Biologics, lnc. San Diego, CA), er beskyttet af patenter over hele verden og blev licenseret af Nantkwest, lnc. (www.nantkwest.com). Forfatterne er taknemmelige over for György Vereb og Árpád Szöőr for deres hjælp med brugen af NK-92-cellelinjen og TR-F(ab’)2 og for teknisk rådgivning.
Materials
| 96-well glass bottom Cell Carrier Ultra microplates | PerkinElmer, Waltham, MA, USA | LLC 6055302 | for spheroids measurements |
| 96-well tissue culture plates | TPP | 92096 | for cell seeding |
| α-MEM medium | Sigma | M8042 | in NK medium |
| Agarose | Sigma | A9539 | for spheroids seeding |
| Annexin V-Alexa Fluo 647 conjugate | Invitrogen-ThermoFisher Scientific | A23204 | for apoptosis measurement with HCS |
| CD16.176 V.NK-92 cells | Dr. Kerry S. Campbell (the Fox Chase Cancer Center, Philadelphia, PA on behalf of Brink Biologics, Inc. San Diego, CA) | ATCC CRL-2407 | for cell culture |
| Cell Tracker Blue | Invitrogen-Thermo Scientific, Waltham, MA, USA) | C2110 | for staining of NK cells |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT1-EGFP medium |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | for coating HCS plate before transfering the spheroids |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1-EGFP and NK medium |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| GraphPad Prism 8.0.1 | GraphPad Software Inc., San Diego, CA, USA | for statistical analysis | |
| Harmony software | PerkinElmer, Waltham, MA, USA | for HCA | |
| IL-2 | Proleukin, Novartis Hungária Kft., Budapest, Hungary | PHC0026 | in NK medium |
| Insulin (Humulin R) | Eli Lilly | HI0219 | JIMT-1-EGFP medium |
| JIMT-1 breast cancer cells | for cell culture | ||
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Opera Phenix High-Content Analysis equipment | PerkinElmer, Waltham, MA, USA | HH14001000 | for HCA |
| PBS (Posphate buffered saline) | Lonza | BE17-517Q | for washing the cells |
| Penicillin-Streptomycin | Biosera | LM-A4118 | JIMT-1-EGFP and NK medium |
| pLP-1, pLP-2, pLP-VSV-G, pWOXEGFP | Invitrogen, (Prof. József T zsér, University of Debrecen) zsér, University of Debrecen) |
for JIMT-1-EGFP cell line | |
| Pluronic-F127 | Sigma | P2443 | for coating HCS plate before transfering the spheroids |
| Sunitinib malate | SigmaAldrich | PZ0012 | for treatments |
| Trastuzumab Ab (humanized anti-HER2 monoclonal antibody) | Herzuma®, EGIS Pharmaceuticals, Budapest, Hungary | NDC-63459-303-43 | for treatments |
| Trastuzumab-F(ab')2 | Gift from Prof. György Vereb and Árpád Szö r r |
Department of Biophysics and Cell Biology, University of Debrecen | for treatments |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Trypsin-EDTA 1X in PBS | Biosera | LM-T1706 | for cells detachment |
References
- Jubelin, C., et al. Three-dimensional in vitro culture models in oncology research. Cell Biosci. 12 (1), 155 (2022).
- Mittler, F., et al. High-content monitoring of drug effects in a 3D spheroid model. Front Oncol. 7, 293 (2017).
- Badr-Eldin, S. M., Aldawsari, H. M., Kotta, S., Deb, P. K., Venugopala, K. N. Three-dimensional in vitro cell culture models for efficient drug discovery: Progress so far and future prospects. Pharmaceuticals (Basel). 15 (8), 926 (2022).
- Brancato, V., Oliveira, J. M., Correlo, V. M., Reis, R. L., Kundu, S. C. Could 3D models of cancer enhance drug screening. Biomaterials. 232, 119744 (2020).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Fitzgerald, A. A., Li, E., Weiner, L. M. 3D culture systems for exploring cancer immunology. Cancers (Basel). 13 (1), 56 (2020).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Sci Rep. 6, 19103 (2016).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Front Immunol. 11, 603640 (2020).
- Li, Y., et al. Recent progress on immunotherapy for breast cancer: Tumor microenvironment, nanotechnology and more. Front Bioeng Biotechnol. 9, 680315 (2021).
- Lo Nigro, C., et al. NK-mediated antibody-dependent cell-mediated cytotoxicity in solid tumors: Biological evidence and clinical perspectives. Ann Transl Med. 7 (5), 105 (2019).
- Sun, Y. S., et al. Risk factors and preventions of breast cancer. Int J Biol Sci. 13 (11), 1387-1397 (2017).
- Liu, P. H., Wei, J. C., Wang, Y. H., Yeh, M. H. Female breast cancer incidence predisposing risk factors identification using nationwide big data: A matched nested case-control study in taiwan. BMC Cancer. 22 (1), 849 (2022).
- Burguin, A., Diorio, C., Durocher, F. Breast cancer treatments: Updates and new challenges. J Pers Med. 11 (8), 808 (2021).
- Costa, R. L. B., Czerniecki, B. J. Clinical development of immunotherapies for HER2(+) breast cancer: A review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer. 6, 10 (2020).
- Musolino, A., et al. Role of fcgamma receptors in HER2-targeted breast cancer therapy. J Immunother Cancer. 10 (1), e003171 (2022).
- Petricevic, B., et al. Trastuzumab mediates antibody-dependent cell-mediated cytotoxicity and phagocytosis to the same extent in both adjuvant and metastatic HER2/NEU breast cancer patients. J Transl Med. 11, 307 (2013).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to Trastuzumab-mediated ADCC. Cancer Immunol Immunother. 71 (9), 2151-2168 (2022).
- Barok, M., et al. Trastuzumab decreases the number of circulating and disseminated tumor cells despite Trastuzumab resistance of the primary tumor. Cancer Lett. 260 (1-2), 198-208 (2008).
- Toth, G., et al. The combination of Trastuzumab and Pertuzumab administered at approved doses may delay development of Trastuzumab resistance by additively enhancing antibody-dependent cell-mediated cytotoxicity. MAbs. 8 (7), 1361-1370 (2016).
- Ehlers, F. a. I., et al. ADCC-inducing antibody Trastuzumab and selection of KIR-HLA ligand mismatched donors enhance the NK cell anti-breast cancer response. Cancers (Basel). 13 (13), 3232 (2021).
- Gangadhara, S., Smith, C., Barrett-Lee, P., Hiscox, S. 3d culture of Her2+ breast cancer cells promotes AKT to MAPK switching and a loss of therapeutic response. BMC Cancer. 16, 345 (2016).
- Balalaeva, I. V., Sokolova, E. A., Puzhikhina, A. D., Brilkina, A. A., Deyev, S. M. Spheroids of Her2-positive breast adenocarcinoma for studying anticancer immunotoxins in vitro. Acta Naturae. 9 (1), 38-43 (2017).
- Selis, F., et al. Pegylated Trastuzumab fragments acquire an increased in vivo stability but show a largely reduced affinity for the target antigen. Int J Mol Sci. 17 (4), 491 (2016).
- Johnston, R. L., et al. High content screening application for cell-type specific behaviour in heterogeneous primary breast epithelial subpopulations. Breast Cancer Res. 18 (1), 18 (2016).
- Kandaswamy, C., Silva, L. M., Alexandre, L. A., Santos, J. M. High-content analysis of breast cancer using single-cell deep transfer learning. J Biomol Screen. 21 (3), 252-259 (2016).
- Esquer, H., Zhou, Q., Abraham, A. D., Labarbera, D. V. Advanced high-content-screening applications of clonogenicity in cancer. SLAS Discov. 25 (7), 734-743 (2020).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced Her2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2009).

