Nano ve Mikrometre Boyutlu Veziküllerde Denge Dışı Metabolik Ağların İnşası
Summary
Membran proteinlerinin yeniden yapılandırılması ve enzimlerin ve diğer suda çözünür bileşenlerin mikrometre altı ve mikrometre boyutundaki lipid veziküllerinde kapsüllenmesi için bir protokol sunuyoruz.
Abstract
Saflaştırılmış bileşenler kullanarak entegre membran proteinleri, enzimler ve floresan bazlı sensörleri içeren karmaşık protein ağlarını veziküllere dahil etmek için bir yöntem sunuyoruz. Bu yöntem, biyoreaktörlerin tasarımı ve inşası ve karmaşık denge dışı metabolik reaksiyon ağlarının incelenmesi ile ilgilidir. Daha önce geliştirilmiş bir protokole göre (çoklu) membran proteinlerini büyük unilameller veziküllere (LUV’ler) yeniden yapılandırarak başlıyoruz. Daha sonra saflaştırılmış enzimler, metabolitler ve floresan bazlı sensörlerin (floresan proteinler veya boyalar) bir karışımını donma-çözülme-ekstrüzyon yoluyla kapsüllüyoruz ve dahil edilmemiş bileşenleri santrifüjleme ve/veya boyut dışlama kromatografisi ile çıkarıyoruz. Metabolik ağların performansı, floresan okuması ile ATP/ADP oranı, metabolit konsantrasyonu, dahili pH veya diğer parametreler izlenerek gerçek zamanlı olarak ölçülür. 100-400 nm çapındaki membran proteini içeren veziküllerimiz, mevcut ancak optimize edilmiş prosedürler kullanılarak dev-unilamellar veziküllere (GUV’ler) dönüştürülebilir. Yaklaşım, çözünür bileşenlerin (enzimler, metabolitler, sensörler) mikrometre boyutundaki veziküllere dahil edilmesini sağlar, böylece biyoreaktörlerin hacmini büyüklük sırasına göre yükseltir. GUV’leri içeren metabolik ağ, optik mikroskopi ile analiz edilmek üzere mikroakışkan cihazlarda tutulur.
Introduction
Aşağıdan yukarıya sentetik biyoloji alanı, biyoteknolojik 3,4 veya biyomedikal amaçlar 5,6,7,8 için (minimal) hücreler 1,2 ve metabolik biyoreaktörler oluşturmaya odaklanır. Sentetik hücrelerin inşası, araştırmacıların, doğal ortamların proteinlerini taklit eden iyi tanımlanmış koşullarda proteinleri (zar) incelemelerine olanak tanıyan, proteinlerin ve reaksiyon ağlarının ortaya çıkan özelliklerinin ve gizli biyokimyasal işlevlerinin keşfedilmesini sağlayan benzersiz bir platform sağlar9. Otonom olarak işleyen bir sentetik hücreye doğru bir ara adım olarak, canlı hücrelerin metabolik enerji korunumu, protein ve lipid sentezi ve homeostaz gibi temel özelliklerini yakalayan modüller geliştirilmiştir. Bu tür modüller sadece yaşam anlayışımızı geliştirmekle kalmaz, aynı zamanda tıp8 ve biyoteknoloji10 alanlarında da potansiyel uygulamalara sahiptir.
Transmembran proteinler, molekülleri hücrenin içine veya dışına taşıdıkları, sinyal verdikleri ve çevrenin kalitesine yanıt verdikleri ve çok sayıda biyosentetik rol oynadıkları için hemen hemen her metabolik ağın merkezinde yer alır. Bu nedenle, sentetik hücrelerdeki metabolik modüllerin mühendisliği, çoğu durumda integral ve/veya periferik membran proteinlerinin, spesifik lipitlerden ve yüksek bütünlükten (düşük geçirgenlik) oluşan bir membran çift tabakasına yeniden yapılandırılmasını gerektirir. Bu zar proteinlerinin kullanımı zordur ve özel bilgi ve deneysel beceriler gerektirir.
Fosfolipid veziküller içindeki zar proteinlerini yeniden oluşturmak için, çoğunlukla spesifik bir proteinin fonksiyon11,12, regülasyon13, kinetik özellikler14,15, lipid bağımlılığı15,16 ve/veya stabilite17’yi incelemek amacıyla çeşitli yöntemler geliştirilmiştir. Bu yöntemler, deterjanla çözündürülmüş proteininlipitlerin 18 varlığında sulu ortama hızlı bir şekilde seyreltilmesini, deterjanla çözündürülmüş proteinin deterjanla destabilize edilmiş lipid vezikülleri ile inkübe edilmesiyle deterjanların uzaklaştırılmasını ve deterjan(lar)ın polistiren boncuklar19 üzerine emilmesini veya deterjanların diyaliz veya boyut dışlama kromatografisi20 ile uzaklaştırılmasını içerir. Organik çözücüler, örneğin yağ-su interfazlarının21 oluşumu yoluyla lipid vezikülleri oluşturmak için kullanılmıştır, ancak integral membran proteinlerinin çoğu, bu tür çözücülere maruz kaldıklarında inaktive edilir.
Laboratuvarımızda, büyük unilameller veziküller (LUV’ler) oluşturmak için çoğunlukla membran proteinlerini deterjan emme yöntemiyle yeniden sulandırıyoruz19. Bu yöntem, çoklu zar proteinlerinin birlikte sulandırılmasına ve enzimlerin, metabolitlerin ve probların vezikül lümeninde kapsüllenmesine izin verir22,23. Membran proteini içeren LUV’ler, elektroformasyon24 veya jel destekli şişme25 ve membran proteinlerinin26 bütünlüğünü korumak için özel koşullar kullanılarak, suda çözünür bileşenlerin kapsüllenmesi ile / kapsüllenmemesi ile dev unilamellar veziküllere (GUV’ler) dönüştürülebilir.
Bu makale, L-arginin’in L-ornitin27’ye parçalanması yoluyla ATP’yi yeniden üreten denge dışı bir metabolik ağın LUV’lerinde sulandırılması için bir protokol sunmaktadır. ATP oluşumu, fosfolipid sentezi için önemli bir yapı taşı olan gliserol-3-fosfat (G3P) üretimi ile birleştirilir22,28. Metabolik yol, bir arginin/ornitin (ArcD) ve bir G3P/Pi antiporter (GlpT) olmak üzere iki integral membran proteininden oluşur. Ek olarak, ATP’nin geri dönüşümü için üç çözünür enzim (ArcA, ArcB, ArcC) gereklidir ve GlpK, L-arginin’in parçalanmasından elde edilen ATP’yi kullanarak gliserolü gliserol 3-fosfata dönüştürmek için kullanılır, yolun şematik bir genel bakışı için Şekil 1’e bakın. Bu protokol, lipitlerin veya proteinlerin sentezi veya hücrelerin bölünmesi için daha da karmaşık reaksiyon ağlarının gelecekteki inşası için iyi bir başlangıç noktasını temsil eder. Veziküllerin lipid bileşimi, çok çeşitli integral membran proteinlerinin aktivitesini destekler ve çeşitli moleküllerin veziküllerin içine veya dışına taşınması için optimize edilmiştir 27,29,30.
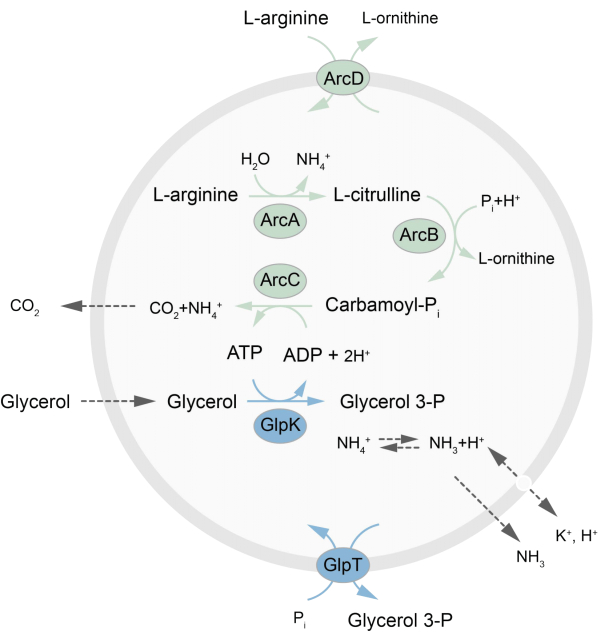
Şekil 1: ATP üretimi ve gliserol 3-fosfat sentezi ve atılımı için yola genel bakış. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Kısacası, saflaştırılmış zar proteinleri (dodesil-β-D-maltosit, DDM içinde çözündürülmüş), proteinlerin zara yerleştirilmesine izin veren Triton X-100 ile destabilize edilmiş önceden oluşturulmuş lipid veziküllerine eklenir. Deterjan molekülleri daha sonra (yavaşça) aktive edilmiş polistiren boncukların eklenmesiyle uzaklaştırılır ve bu da iyi kapatılmış proteolipozomların oluşumuna neden olur. Çözünür bileşenler daha sonra veziküllere eklenebilir ve molekülleri membran füzyonu sürecinde yakalayan donma-çözülme döngüleri yoluyla kapsüllenebilir. Elde edilen veziküller oldukça heterojendir ve çoğu çok lamelli boyalıdır. Daha sonra, daha düzgün boyutta veziküller veren 400, 200 veya 100 nm gözenek boyutuna sahip bir polikarbonat filtreden ekstrüde edilirler; Gözenek boyutu ne kadar küçükse, veziküller o kadar homojen ve tek tiptir, ancak daha küçük bir iç hacim pahasına. Dahil edilmemiş proteinler ve küçük moleküller, boyut dışlama kromatografisi ile harici çözeltiden uzaklaştırılır. ProteoLUV’lar, jel destekli şişme ile mikrometre boyutunda veziküllere dönüştürülebilir ve bu proteoGUV’lar daha sonra toplanır ve mikroskobik karakterizasyon ve manipülasyon için bir mikroakışkan çip içinde tutulur. Şekil 2 , tam protokolün şematik bir genel bakışını göstermektedir.
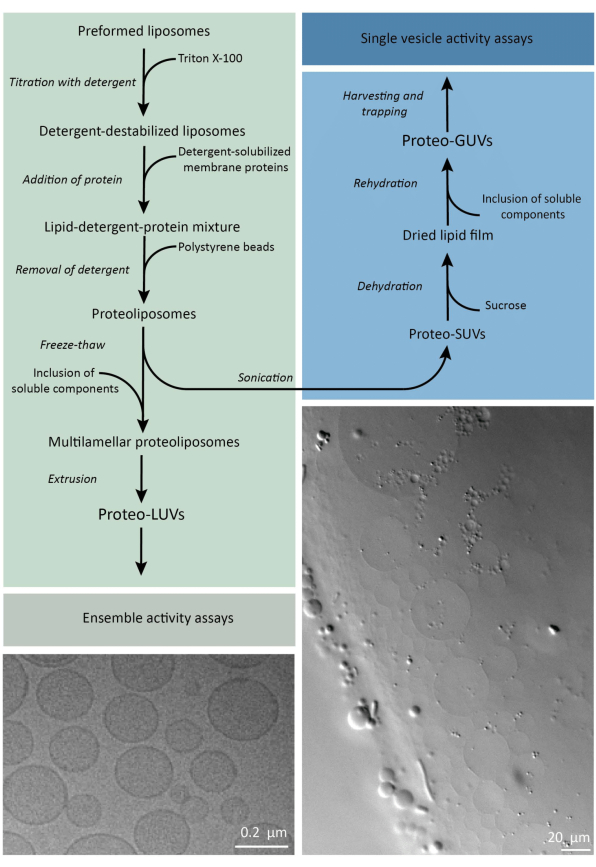
Şekil 2: Mikrometre altı (LUV’ler) ve mikrometre boyutundaki (GUV’ler) lipid veziküllerinde membran proteinlerinin yeniden yapılandırılması ve enzimlerin ve suda çözünür bileşenlerin kapsüllenmesi için protokole genel bakış. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sulandırma ve kapsülleme protokolleri iyi çalışır ve proteinlerin işlevselliği korunur, ancak proteoLUV’lar ve proteoGUV’lar boyut olarak heterojendir. Mikroakışkan yaklaşımlar 31,32, boyut olarak daha homojen olan mikrometre boyutunda veziküllerin oluşumuna izin verir, ancak zar proteinlerinin işlevsel olarak yeniden yapılandırılması genellikle mümkün değildir, çünkü çift tabakadaki artık çözücü proteinleri inaktive eder. ProteoLUV’lerin boyutları 100 ila 400 nm arasında değişir ve düşük enzim konsantrasyonlarında, kapsülleme eksik metabolik yollara sahip veziküllere yol açabilir (stokastik etkiler; bkz. Şekil 3). LUV’ler, ATP ve G3P gibi yapı taşlarının üretimi için burada gösterildiği gibi belirli metabolik modüller oluşturmak için idealdir. Bu tür proteoLUV’lar potansiyel olarak GUV’lerde kapsüllenebilir ve konakçı veziküller için organel benzeri bölmeler olarak hizmet edebilir.
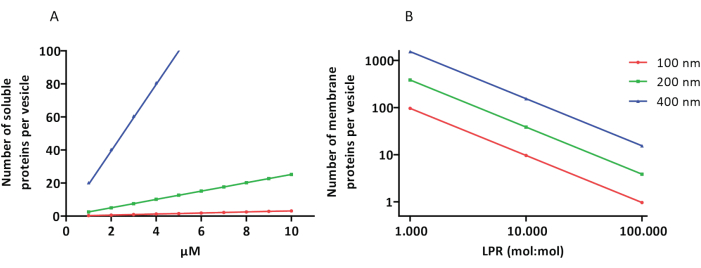
Şekil 3: Çapı 100, 200 veya 400 nm olan vezikül başına molekül sayısı. (A) Kapsüllenmiş proteinler (enzimler, problar) 1-10 μM aralığında olduğunda. (B) Sulandırma, lipid başına 1 ila 1.000, 1 ila 10.000 ve 1 ila 100.000 membran proteini (mol / mol) arasında yapılır. Moleküllerin belirtilen konsantrasyonlarda kapsüllendiği ve bu protein-lipit oranlarında zara dahil edildiği varsayımını yapıyoruz. Bazı enzimler için, zarlara bağlandıklarını gördük, bu da veziküllerdeki görünür konsantrasyonlarını artırabilir. Kısaltma: LPR = Lipid-Protein-Oranı Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Mikrometre altı boyutta lipid veziküller (proteoLUV’ler) içeren (membran) proteinin sentezi ve proteoLUV’lerin dev-unilamellar veziküllere (proteoGUV’lar) dönüştürülmesi için bir protokol sunuyoruz. Protokol, diğer membran proteinlerinin 13,19,30,40 sulandırılması ve burada sunulan L-arginin parçalanması ve gliserol 3-fosfat sentez yolları dışındaki metabolik ağların kapsüllenmesi için uygulanabilir olmalıdır.<sup class="xref"…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Yazarlar, pBAD-PercevalHR geninin klonlanması için Aditya Iyer’e ve protein üretimi ve saflaştırılmasına yardımcı olduğu için Gea Schuurman-Wolters’a teşekkür eder. Araştırma, NWO Yerçekimi programı “Sentetik Bir Hücre İnşa Etmek” (BaSyC) tarafından finanse edildi.
Materials
| Agarose | Sigma Aldrich | A9414-25g | |
| Amicon cut-off filter | Sigma Aldrich | Milipore centrifugal filter units Amicon Ultra | |
| BioBeads | BioRad | 152-3920 | |
| CHCl3 | Macron Fine Chemicals | MFCD00000826 | |
| D(+)-Glucose | Formedium | – | |
| D(+)-Sucrose | Formedium | – | |
| DDM | Glycon | D97002 -C | |
| Diethyl Ether | Biosolve | 52805 | |
| DMSO | Sigma-Aldrich | 276855-100ml | |
| DOPC | Avanti | 850375P-1g | |
| DOPE | Avanti | 850725P-1g | |
| DOPG | Avanti | 840475P-1g | |
| DTT | Formedium | DTT005 | |
| EtOH | J.T.Baker Avantor | MFCD00003568 | |
| Extruder | Avestin Inc | LF-1 | |
| Fluorimeter | Jasco | Spectrofluorometer FP-8300 | |
| Glycerol | BOOM | 51171608 | |
| Gravity flow column | Bio-Rad | 732-1010 | |
| Hamilton syringe 100 µL | Hamilton | 7656-01 | |
| Hamilton syringe 1000 µL | Hamilton | 81320 | |
| Handheld LCP dispenser | Art Robbins Instruments | 620-411-00 | |
| Handheld Sonicator | Hielscher Ultrasound Technology | UP50H | |
| HCl | BOOM | x76021889.1000 | |
| Imidazole | Roth | X998.4-250g | |
| K2HPO4 | Supelco | 1.05099.1000 | |
| KCl | BOOM | 76028270.1 | |
| KH2PO4 | Supelco | 1.04873.1000 | |
| Kimwipe | Kimtech Science | 7552 | |
| Large Falcon tube centrifuge | Eppendorf | Centrifuge 5810 R | |
| L-Arginine | Sigma-Aldrich | A5006-100G | |
| Light microscope | Leica | DM LS2 | |
| L-Ornithine | Roth | T204.1 | |
| LSM Laser Scanning Confocal Microscope | Zeiss | LSM 710 ConfoCor 3 | |
| MgCl2 | Sigma-Aldrich | M2670-1KG | |
| Microfluidic chip | Homemade | PDMS based | DOI: https://doi.org/10.1039/C8LC01275J |
| Na-ADP | Sigma-Aldrich | A2754-1G | |
| NaCl | Supelco | 1.06404.1000 | |
| Nanodrop Spectrometer | Isogen Life Science | ND-1000 spectrophotometer NanoDrop | |
| NaOH | Supelco | 1.06498.1000 | |
| Needles for GUVs | Henke-Ject | 14-14575 | 27 G x 3/4'' 0.4 x 20 mm |
| Needles for microfluidics | Henke-Ject | 14-15538 | 18 G x 1 1/2'' 1.2 x 40 mm |
| Ni2+ Sepharose | Cytiva | 17526802 | |
| Nigericin | Sigma-Aldrich | N7143-5MG | |
| Nutator | VWR | 83007-210 | |
| Osmolality meter | Gonotec Salmenkipp | Osmomat 3000 basic freezing point osmometer | |
| Plasmacleaner | Plasma Etch | PE-Avenger | |
| Polycarbonate filter | Cytiva Whatman | Nuclepor Track-Etch Membrane Product: 10417104 | 0.4 µm |
| Polycarbonate ultracentrifuge tube | Beckman Coulter | 355647 | |
| Pyranine | Acros Organics | H1529-1G | |
| Quartz cuvette (black) | Hellma Analytics | 108B-10-40 | |
| Sephadex G-75 resin | GE Healthcare | 17-0050-01 | |
| Sonicator | Sonics Sonics & Materials INC | Sonics vibra cell | |
| Syringe filter | Sarstedt | Filtropur S plus 0.2 | 0.2 µm |
| Syringe pump | Harvard Apparatus | A-42467 | |
| Tabletop centrifuge | Eppendorf | centrifuge 5418 | |
| Teflon spacer | Homemade | Teflon based | 45 x 26 x 1.5 or 45 x 26 x 3 or 20 x 20 x 3 mm |
| Tris | PanReac AppliChem | A1086.1000 | |
| Triton X-100 | Sigma Aldrich | T8787-100 ml | |
| Ultracentrifuge | Beckman Coulter | Optima Max-E | |
| UV lamp | Spectroline | ENB-280C/FE | |
| UV/VIS Spectrometer | Jasco | V730 spectrophotometer | |
| Valinomycin | Sigma-Aldrich | V0627-10MG | |
| Widefield fluorescence microscope | Zeiss | AxioObserver | |
| β-Casein | Sigma Aldrich | C5890-500g |
References
- Hirschi, S., Ward, T. R., Meier, W. P., Müller, D. J., Fotiadis, D. Synthetic biology: bottom-up assembly of molecular systems. Chem Rev. 122 (21), 16294-16328 (2022).
- Ivanov, I., et al. Bottom-up synthesis of artificial cells: recent highlights and future challenges. Annu Rev Chem Biomol. Eng. 12 (1), 287-308 (2021).
- Clomburg, J. M., Crumbley, A. M., Gonzalez, R. Industrial biomanufacturing: The future of chemical production. Science. 355 (6320), (2017).
- Shi, T., Han, P., You, C., Zhang, Y. -. H. P. J. An in vitro synthetic biology platform for emerging industrial biomanufacturing: Bottom-up pathway design. Synth Syst Biotechnol. 3 (3), 186-195 (2018).
- Wang, A., et al. Liver-target and glucose-responsive polymersomes toward mimicking endogenous insulin secretion with improved hepatic glucose utilization. Adv Funct Mater. 30 (13), 1910168 (2020).
- Kanter, G., et al. Cell-free production of scFv fusion proteins: an efficient approach for personalized lymphoma vaccines. Blood. 109 (8), 3393-3399 (2007).
- Zeltins, A. Construction and characterization of virus-like particles: a review. Mol Biotechnol. 53 (1), 92-107 (2013).
- Jain, K. K. Synthetic biology and personalized medicine. Med Princ Pract. 22 (3), 209-219 (2013).
- Schwille, P., Frohn, B. P. Hidden protein functions and what they may teach us. Trends Cell Biol. 32 (2), 102-109 (2022).
- Sachsenmeier, P. Industry 5.0-The relevance and implications of bionics and synthetic biology. 공학. 2 (2), 225-229 (2016).
- Schmidt, D., Jiang, Q. -. X., MacKinnon, R. Phospholipids and the origin of cationic gating charges in voltage sensors. Nature. 444 (7120), 775-779 (2006).
- Godoy-Hernandez, A., et al. Rapid and highly stable membrane reconstitution by LAiR enables the study of physiological integral membrane protein functions. ACS Cent Sci. 9 (3), 494-507 (2023).
- Sikkema, H. R., et al. Gating by ionic strength and safety check by cyclic-di-AMP in the ABC transporter OpuA. Sci Adv. 6 (47), 7697 (2020).
- Foucaud, C., Poolman, B. Lactose transport system of Streptococcus thermophilus. Functional reconstitution of the protein and characterization of the kinetic mechanism of transport. J Biol Chem. 267 (31), 22087-22094 (1992).
- Yoneda, J. S., Sebinelli, H. G., Itri, R., Ciancaglini, P. Overview on solubilization and lipid reconstitution of Na,K-ATPase: enzyme kinetic and biophysical characterization. Biophys Rev. 12 (1), 49-64 (2020).
- Simidjiev, I., et al. Self-assembly of large, ordered lamellae from non-bilayer lipids and integral membrane proteins in vitro. Proc Natl Acad Sci. 97 (4), 1473-1476 (2000).
- Harris, N. J., Booth, P. J. Folding and stability of membrane transport proteins in vitro. Biochim Biophys Acta BBA – Biomembr. 1818 (4), 1055-1066 (2012).
- Jackson, M. L., Litman, B. J. Rhodopsin-egg phosphatidylcholine reconstitution by an octyl glucoside dilution procedure. Biochim Biophys Acta BBA – Biomembr. 812 (2), 369-376 (1985).
- Geertsma, E. R., Nik Mahmood, N. A. B., Schuurman-Wolters, G. K., Poolman, B. Membrane reconstitution of ABC transporters and assays of translocator function. Nat Protoc. 3 (2), 256-266 (2008).
- Rigaud, J. -. L., Pitard, B., Levy, D. Reconstitution of membrane proteins into liposomes: application to energy-transducing membrane proteins. Biochim Biophys Acta BBA – Bioenerg. 1231 (3), 223-246 (1995).
- Szoka, F., Papahadjopoulos, D. Procedure for preparation of liposomes with large internal aqueous space and high capture by reverse-phase evaporation. Proc Natl Acad Sci. 75 (9), 4194-4198 (1978).
- . Synthetic Organelles for Energy Conservation and Delivery of Building Blocks for Lipid Biosynthesis Available from: https://www.researchsquare.com/article/rs-3385355/v1 (2023)
- Lee, K. Y., et al. Photosynthetic artificial organelles sustain and control ATP-dependent reactions in a protocellular system. Nat Biotechnol. 36 (6), 530-535 (2018).
- Méléard, P., Bagatolli, L. A., Pott, T. Giant unilamellar vesicle electroformation. Methods in Enzymology. , 161-176 (2009).
- Garten, M., Aimon, S., Bassereau, P., Toombes, G. E. S. Reconstitution of a transmembrane protein, the voltage-gated ion channel, KvAP, into giant unilamellar vesicles for microscopy and patch clamp studies. J. Vis. Exp. (95), e52281 (2015).
- Doeven, M. K., et al. lateral mobility and function of membrane proteins incorporated into giant unilamellar vesicles. Biophys J. 88 (2), 1134-1142 (2005).
- Pols, T., et al. A synthetic metabolic network for physicochemical homeostasis. Nat Commun. 10 (1), 4239 (2019).
- Bailoni, E., Poolman, B. ATP recycling fuels sustainable glycerol 3-phosphate formation in synthetic cells fed by dynamic dialysis. ACS Synth Biol. 11 (7), 2348-2360 (2022).
- Van Der Heide, T. On the osmotic signal and osmosensing mechanism of an ABC transport system for glycine betaine. EMBO J. 20 (24), 7022-7032 (2001).
- Van’T Klooster, J. S., et al. Membrane lipid requirements of the lysine transporter Lyp1 from Saccharomyces cerevisiae. J Mol Biol. 432 (14), 4023-4031 (2020).
- Lou, G., Anderluzzi, G., Woods, S., Roberts, C. W., Perrie, Y. A novel microfluidic-based approach to formulate size-tuneable large unilamellar cationic liposomes: Formulation, cellular uptake and biodistribution investigations. Eur J Pharm Biopharm. 143, 51-60 (2019).
- Weiss, M., et al. Sequential bottom-up assembly of mechanically stabilized synthetic cells by microfluidics. Nat Mater. 17 (1), 89-96 (2018).
- Pols, T., Singh, S., Deelman-Driessen, C., Gaastra, B. F., Poolman, B. Enzymology of the pathway for ATP production by arginine breakdown. FEBS J. 288 (1), 293-309 (2021).
- Yandrapalli, N., Robinson, T. Ultra-high capacity microfluidic trapping of giant vesicles for high-throughput membrane studies. Lab Chip. 19 (4), 626-633 (2019).
- Elias, M., et al. Microfluidic characterization of biomimetic membrane mechanics with an on-chip micropipette. Micro Nano Eng. 8, 100064 (2020).
- Robinson, T., Kuhn, P., Eyer, K., Dittrich, P. S. Microfluidic trapping of giant unilamellar vesicles to study transport through a membrane pore. Biomicrofluidics. 7 (4), 044105 (2013).
- Cooper, A., Girish, V., Subramaniam, A. B. Osmotic Pressure Enables High-Yield Assembly of Giant Vesicles in Solutions of Physiological Ionic Strengths. Langmuir. 39 (15), 5579-5590 (2023).
- Tantama, M., Martínez-François, J. R., Mongeon, R., Yellen, G. Imaging energy status in live cells with a fluorescent biosensor of the intracellular ATP-to-ADP ratio. Nat Commun. 4 (1), 2550 (2013).
- Setyawati, I., et al. In vitro reconstitution of dynamically interacting integral membrane subunits of energy-coupling factor transporters. eLife. 9, e64389 (2020).
- Oropeza-Guzman, E., Ríos-Ramírez, M., Ruiz-Suárez, J. C. Leveraging the coffee ring effect for a defect-free electroformation of giant unilamellar vesicles. Langmuir. 35 (50), 16528-16535 (2019).
- Estes, D. J., Mayer, M. Electroformation of giant liposomes from spin-coated films of lipids. Colloids Surf B Biointerfaces. 42 (2), 115-123 (2005).

