3.9:
Determinazione sperimentale della formula chimica
3.9:
Determinazione sperimentale della formula chimica
La composizione elementale di un composto definisce la sua identità chimica e le formule chimiche sono il modo più conciso di rappresentare questo trucco elementale. Quando la formula di un composto è sconosciuta, misurare la massa dei suoi elementi costitutivi è spesso il primo passo per determinare la formula sperimentalmente.
Determinazione delle formule empiriche
L’approccio più comune per determinare la formula chimica di un composto è il primo a misurare le masse dei suoi elementi costitutivi. Tuttavia, le formule chimiche rappresentano i numeri relativi e non le masse di atomi nella sostanza. Pertanto, qualsiasi dato derivato sperimentalmente che coinvolga la massa deve essere usato per ottenere il numero corrispondente di atomi nel composto. Questo si ottiene usando masse molare per convertire la massa di ogni elemento nel suo numero di talpe. Queste quantità molare sono usate per calcolare rapporti di numeri interi che possono essere utilizzati per derivare la formula empirica della sostanza.
Si consideri un campione di un composto determinato a contenere 1,71 grammi di carbonio e 0,287 grammi di idrogeno. Il numero corrispondente di atomi è di 0,142 moli di carbonio e 0,284 moli di idrogeno. Pertanto, questo composto può essere rappresentato dalla formula C0.142H0.284. Per convenzione, le formule contengono pedici a numero intero, che possono essere ottenuti dividendo ogni pedice per il pedice più piccolo (0,142). La formula empirica per questo composto è quindi CH2. I pedici di “1” non sono scritti, ma piuttosto presunti se non è presente nessun altro numero. Questa può essere o meno la formula molecolare del composto; tuttavia, sono necessarie ulteriori informazioni per effettuare tale determinazione.
Come secondo esempio, un campione di un composto è determinato a contenere 5,31 grammi di cloro e 8,40 grammi di ossigeno. Lo stesso approccio produce una formula empirica provvisoria di ClO3.5. In questo caso, dividere per il pedice più piccolo lascia ancora un decimale nella formula empirica. Per convertire questo in un numero intero, moltiplicare ciascuno dei pedici per due, mantenendo lo stesso rapporto atomo e producendo Cl2O7 come formula empirica finale.
Derivazione di formule empiriche dalla composizione percentuale
Nei casi in cui è disponibile la composizione percentuale di un composto, viene utilizzato per calcolare le masse di elementi presenti nel composto. Poiché la bilancia per le percentuali è 100, è conveniente calcolare la massa di elementi presenti in un campione del peso di 100 grammi. Le masse ottenute sono usate per derivare la formula empirica.
Si supponga, ad esempio, che un composto gassoso contenga il 27,29% C e il 72,71% O. Le percentuali di massa, quindi, sono espresse in frazioni:


La massa di carbonio, 27,29 g, corrisponde a 2.272 moli di carbonio, e la massa di ossigeno, 72,71 g, corrisponde a 4.544 talpe di ossigeno. La formula rappresentativa è quindi C2.272O4.544. Dividere ogni pedice con 2.272 fornisce la formula empirica: CO2.
Derivazione delle formule molecolari
Determinare il numero assoluto di atomi che compongono una singola molecola di un composto covalente richiede la conoscenza sia della sua formula empirica che della sua massa molecolare o massa molare. Queste quantità possono essere determinate sperimentalmente con varie tecniche di misurazione. La massa molecolare, ad esempio, è spesso derivata dallo spettro di massa del composto.
Le formule molecolari sono derivate confrontando la massa molare o la massa molecolare del composto con la sua massa formula empirica. Come suggerisce il nome, una massa di formula empirica è la somma delle masse atomiche medie di tutti gli atomi rappresentati in una formula empirica. Se la massa molare nota di una sostanza è divisa per la massa empirica della formula, produce il numero di unità di formula empiriche per molecola (n).
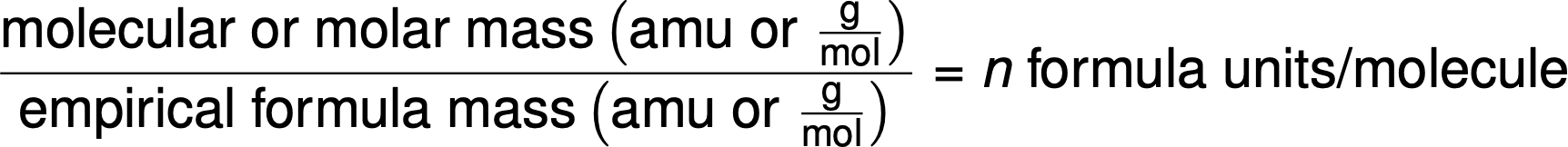
La formula molecolare si ottiene quindi moltiplicando ogni pedice nella formula empirica per n, come mostrato dalla formula empirica generica AxBy:
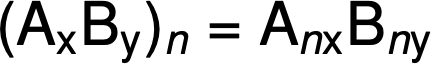
Ad esempio, la formula empirica di un composto covalente è determinata come CH2O, e la sua massa di formula empirica è di circa 30 amu. Se la massa molecolare del composto è determinata in 180 amu, questo indica che le molecole di questo composto contengono sei volte il numero di atomi rappresentati nella formula empirica.
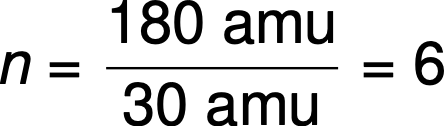
Le molecole di questo composto sono quindi rappresentate da una formula molecolare con pedici che sono sei volte superiori a quelli nella formula empirica: (CH2O)6 = C6H12O6.
Questo testo è adattato da Openstax, Chemistry 2e, Section 3.2: Determining Empirical and Molecular Formulas.
