4.3:
Resa di reazione
4.3:
Resa di reazione
La resa teorica di una reazione è la quantità di prodotto che si stima si formi in base alla stechiometria dell’equazione chimica bilanciata. La resa teorica presuppone la conversione completa del reagente limitante nel prodotto desiderato. La quantità di prodotto ottenuta eseguendo la reazione è chiamata resa effettiva, e può essere minore o (molto raramente) uguale alla resa teorica.
Resa percentuale
Nel caso di reazioni chimiche, la resa effettiva del prodotto è spesso inferiore alla resa teorica prevista in base alla stechiometria della reazione. Quando le reazioni vengono eseguite in una data serie di condizioni, si prevede un’inevitabile perdita di massa a causa di diversi motivi. Alcune reazioni sono naturalmente inefficienti, generando altri prodotti indesiderati attraverso reazioni collaterali. Altri sono incompleti a causa della loro natura reversibile, accompagnati da uno stato di equilibrio tra i reagenti e i prodotti. A volte la perdita di massa del prodotto è dovuta all’inadeguato recupero del prodotto desiderato dalla miscela di reazione durante le tecniche di purificazione come cristallizzazione, distillazione, filtrazione e cromatografia. Nei casi in cui si sperimenta una perdita di prodotto, la resa percentuale viene utilizzata per misurare la misura in cui viene raggiunta la resa teorica di una reazione.

Le rese effettive e teoriche possono essere espresse in masse o quantità molare (o qualsiasi altra proprietà appropriata, ad esempio volume, se il prodotto è un gas). Finché entrambi i rendimenti sono espressi utilizzando le stesse unità, queste unità verranno annullate quando viene calcolato il rendimento percentuale.
Calcolo del rendimento percentuale
Considera la combustione dell’ossido nitrico in biossido di azoto.
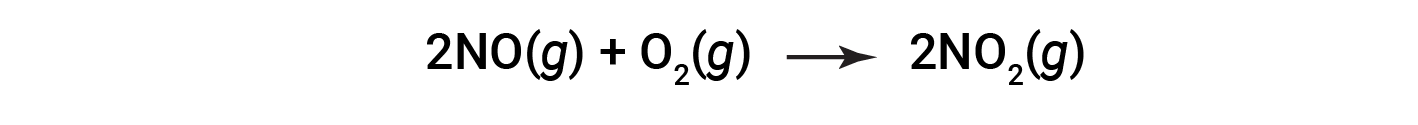
Alla fine della reazione, 180 grammi di biossido di azoto si ottengono da 150 grammi di ossido nitrico e un eccesso di ossigeno. Qual è il rendimento percentuale?
La resa effettiva della reazione è di 180 grammi. Sapendo che l’ossido nitrico è il reagente limitante, le talpe di resa teorica sono ottenute in base alla stechiometria di NO e NO2. In primo luogo, la massa di NO viene convertita in talpe di NO. Quindi, viene applicato il rapporto stechiometrico di NO:NO2 (1:1), il che suggerisce che 5 talpe di NO2 si formeranno da 5 talpe di NO. In terzo luogo, le talpe di NO2 vengono convertite in massa.

Nella fase finale, il rendimento percentuale viene calcolato in base al rapporto tra il rendimento effettivo e il rendimento teorico.

Questo testo è adattato da Openstax, Chemistry 2e, Section 4.4: Reaction Yields.
