5.2:
Газовые законы
5.2:
Газовые законы
В ходе экспериментов ученые установили математические отношения между парами переменных, такими как давление и температура, давление и объем, объем и температура, а также объем и моль, которые справедливы для идеального газа .
/ p>
Давление и температура: закон Гей-Люссака (закон Амонтона)
Представьте, что вы наполняете газом жесткий контейнер, прикрепленный к манометру, а затем герметизируете контейнер, чтобы газ не выходил. Если контейнер охлаждается, газ внутри также становится холоднее, и его давление падает. Поскольку контейнер жесткий и плотно закрытый, как объем, так и количество молей газа остаются постоянными. Если сфера нагревается, газ внутри становится горячее, и давление увеличивается.
Температура и давление связаны линейно, и эта зависимость наблюдается для любого образца газа, ограниченного постоянным объемом. Если температура находится по шкале Кельвина, тогда P и T прямо пропорциональны (опять же, когда объем и моль газа поддерживаются постоянными); если температура по шкале Кельвина увеличивается в определенный раз, давление газа увеличивается во столько же раз.
Эта зависимость давления от температуры для газов известна как закон Гей-Люссака. Закон гласит, что давление данного количества газа прямо пропорционально его температуре по шкале Кельвина, когда объем поддерживается постоянным. Математически это можно записать как:

где k – константа пропорциональности, которая зависит от типа, количества и объема газа. Следовательно, для ограниченного постоянного объема газа отношение P / T является постоянным (т. Е. P / T = к ). Если газ изначально соответствует & lsquo; Условию 1 & rsquo; (с P = P 1 и T = T 1 ) и изменится на & lsquo; Условие 2 & rsquo; (с P = P 2 и T = T 2 ), затем
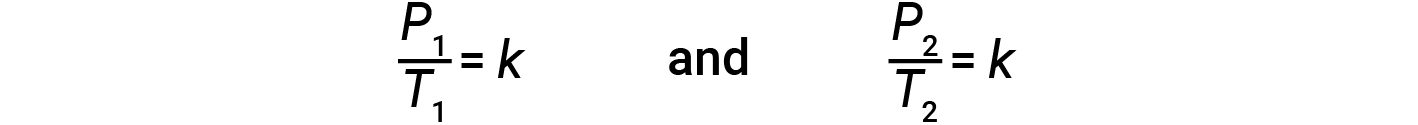
Следовательно, & nbsp;
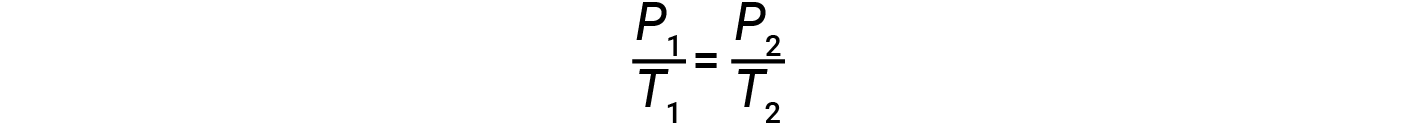
Обратите внимание, что для любого расчета газового закона температуры должны быть в шкале Кельвина. & nbsp;
Объем и температура: закон Чарльза
Если воздушный шар наполнен воздухом и запечатан, то в нем содержится определенное количество воздуха при атмосферном давлении (1 атм). Если баллон помещается в холодильник, газ внутри становится холодным, и баллон сжимается (хотя и количество газа, и его давление остаются постоянными). Если сделать воздушный шар очень холодным, он сильно усадится. Когда он нагреется, воздушный шар снова расширится.
Это пример влияния температуры на объем заданного количества ограниченного газа при постоянном давлении. Объем увеличивается при повышении температуры и уменьшается при понижении температуры.
Связь между объемом и температурой определенного количества газа при постоянном давлении известна как закон Чарльза. Закон гласит, что объем заданного количества газа прямо пропорционален его температуре по шкале Кельвина, когда давление поддерживается постоянным.
Математически это можно записать как:
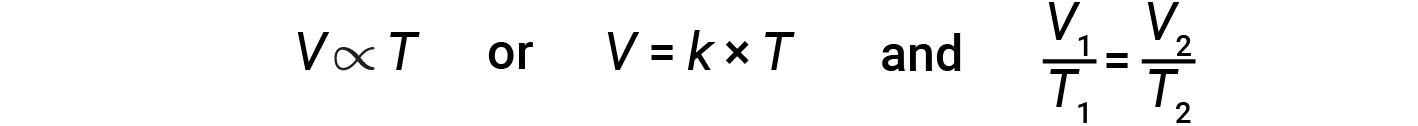
где k – константа пропорциональности, которая зависит от количества и давления газа. Для ограниченного газа при постоянном давлении отношение V / T постоянно.
Объем и давление: закон Бойля
Если герметичный шприц частично заполнен воздухом, то шприц содержит определенное количество воздуха при постоянной температуре, скажем, 25 ° C. Если на поршень медленно нажимать, пока температура остается постоянной, то газ в шприце сжимается до меньшего объема и его давление увеличивается. При извлечении плунжера объем газа увеличивается, а давление снижается.
Уменьшение объема содержащегося газа увеличивает его давление, а увеличение его объема снижает его давление. Если объем увеличивается в определенный раз, давление уменьшается во столько же раз, и наоборот. Следовательно, давление и объем демонстрируют обратную пропорциональность: пропорциональность: увеличение давления приводит к уменьшению объема газа. Математически это можно записать:
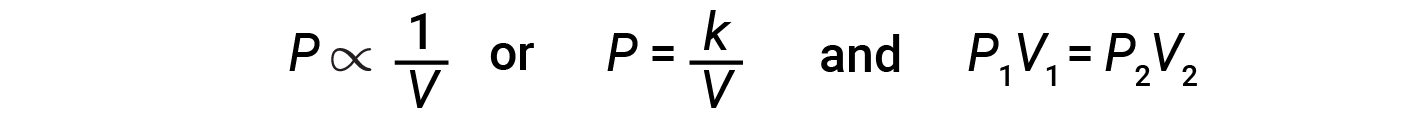
где k – постоянная. График зависимости P от V отображает гиперболу. Графики с изогнутыми линиями трудно читать точно при низких или высоких значениях переменных, и их труднее использовать при подборе теоретических уравнений и параметров к экспериментальным данным. По этим причинам ученые часто пытаются найти способ «линеаризовать»; свои данные. Графически взаимосвязь между давлением и объемом отображается на графике, обратной зависимости давления от объема, или обратной величины объема от давления.
Взаимосвязь между объемом и давлением данного количества газа при постоянной температуре определяется законом Бойля: объем данного количества газа, находящегося при постоянной температуре, обратно пропорционален давлению, при котором он измеряется. .
Моли газа и объем: закон Авогадро
Итальянский ученый Амедео Авогадро в 1811 году выдвинул гипотезу, объясняющую поведение газов, заявив, что равные объемы всех газов, измеренные при одинаковых условиях температуры и давления, содержат одинаковое количество молекул. Со временем это соотношение было подтверждено множеством экспериментальных наблюдений, выраженных законом Авогадро: для ограниченного газа объем (V) и количество молей (n) прямо пропорциональны, если давление и температура остаются постоянными.
В форме уравнения это записывается как:
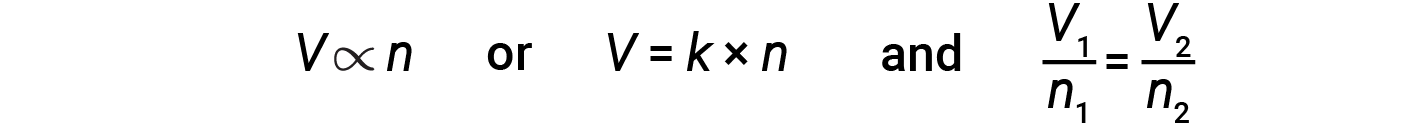
Математические отношения также могут быть определены для других пар переменных, таких как P против n и n против T .
Закон идеального газа
Объединение этих четырех законов дает закон идеального газа, соотношение между давлением, объемом, температурой и числом молей газа:
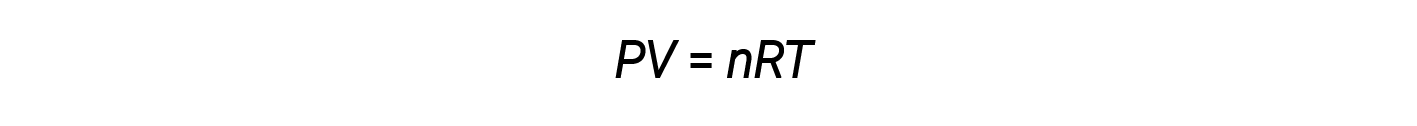
Здесь R – постоянная, называемая постоянной идеального газа или универсальной газовой постоянной. Единицы, используемые для выражения давления, объема и температуры, определяют правильную форму газовой постоянной, как того требует анализ размеров. Наиболее часто встречающиеся значения R составляют 0,08206 л & sdot; атм моль & ndash; 1 & sdot; K & ndash; 1 и 8,314 кПа ⋅ л моль & ndash; 1 & sdot; K & ndash; 1 .
Газы, свойства которых P , V и T точно описываются законом идеального газа (или другими законами газа): Говорят, что он демонстрирует идеальное поведение или приближается к характеристикам идеального газа. Идеальный газ – это гипотетическая конструкция, подходящая только для газов в условиях относительно низкого давления и высокой температуры.
Уравнение идеального газа содержит пять членов, газовую постоянную R и переменные свойства P , V , n и T . Указание любых четырех из этих терминов позволит использовать закон идеального газа для вычисления пятого параметра.
Если количество молей идеального газа остается постоянным при двух различных наборах условий, получается полезная математическая зависимость, называемая законом комбинированного газа (с использованием единиц атм, л и К): & nbsp;
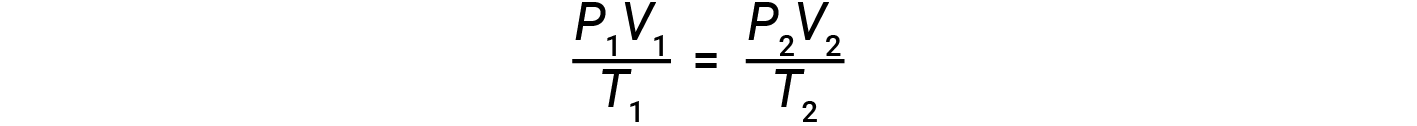
Оба набора условий равны произведению n & times; R (где n = количество молей газа, а R – постоянная закона идеального газа).
Этот текст адаптирован из Openstax, Химия 2e изд., раздел 9.2: Соотношение давления, объема, количества и температуры: закон идеального газа .
