6.4:
Quantificazione del calore
6.4:
Quantificazione del calore
Energia termica
Microscopicamente, l’energia termica è l’energia cinetica associata al moto casuale di atomi e molecole. La temperatura è una misura quantitativa di “caldo” o “freddo”, che dipende dalla quantità di energia termica. Quando gli atomi e le molecole di un oggetto si muovono o vibrano rapidamente, hanno un’energia cinetica media più alta (KE) (o energia termica più alta), e l’oggetto è percepito come “caldo”, o è descritto come ad una temperatura più alta. Quando gli atomi e le molecole si muovono lentamente, hanno una KE media inferiore (o energia termica inferiore), e l’oggetto è percepito come “freddo”, o è descritto come ad una temperatura inferiore.
Supponendo che non si verifichi alcuna reazione chimica o cambiamento di fase (come la fusione o la vaporizzazione), l’aumento della quantità di energia termica in un campione di materia causerà un aumento della sua temperatura, mentre la diminuzione della quantità di energia termica in un campione di materia causerà il declino della sua temperatura.
Calore
Il calore (q) è il trasferimento di energia termica tra due corpi a temperature diverse. Il flusso di calore aumenta l’energia termica di un corpo e diminuisce l’energia termica dell’altro. Il calore scorre spontaneamente dal caldo al freddo (cioè una sola direzione) e continua fino a quando le due sostanze non sono alla stessa temperatura. Le variazioni di calore vengono misurate attraverso variazioni di temperatura.
L’unità SI di calore, lavoro ed energia è il joule. Un joule (J) è definito come la quantità di energia utilizzata quando una forza di 1 newton muove un oggetto di 1 metro. Prende il nome dal fisico inglese James Prescott Joule. Un joule è equivalente a 1 kg m2/s2, che è anche chiamato 1 newton-metro. Un kilojoule (kJ) è di 1000 joule. Per standardizzare la sua definizione, una caloria è stata impostata su 4.184 joule.
Trasferimento di energia termica
La capacità termica (C) di un corpo di materia è la quantità di calore (q) che assorbe o rilascia quando sperimenta un cambiamento di temperatura (ΔT)di 1 grado C (o equivalentemente, 1 kelvin):
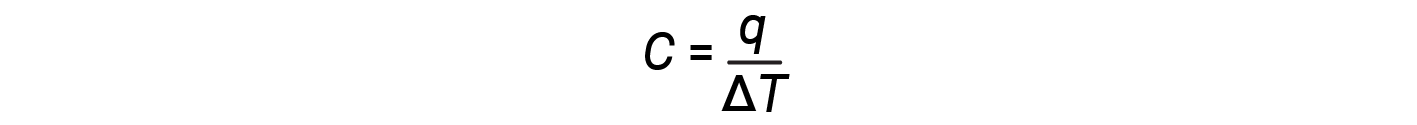
La capacità termica è determinata sia dal tipo che dalla quantità di sostanza che assorbe o rilascia calore. Pertanto, la capacità termica è una proprietà estesa : il suo valore è proporzionale alla quantità della sostanza. Ad esempio, considera le capacità di calore di due padelle in ghisa. La capacità termica della padella grande è cinque volte superiore a quella della piccola padella perché, sebbene entrambi siano fatti dello stesso materiale, la massa della padella grande è cinque volte superiore alla massa della piccola padella. Più massa significa che più atomi sono presenti nella padella più grande, quindi ci vuole più energia per far vibrare tutti quegli atomi più velocemente. La capacità termica della piccola padella in ghisa si trova osservando che ci vogliono 18.140 J di energia (q) per aumentare la temperatura della padella di 50,0 °C (ΔT):

La padella in ghisa più grande, pur essendo fatta della stessa sostanza, richiede 90.700 J di energia (q) per aumentare la sua temperatura di 50,0 °C (ΔT). La padella più grande ha una capacità termica (proporzionalmente) maggiore perché la maggiore quantità di materiale richiede una quantità (proporzionalmente) maggiore di energia per produrre lo stesso cambiamento di temperatura:

La capacità termica specifica (c) di una sostanza, comunemente chiamata “calore specifico”, è la quantità di calore necessaria per aumentare la temperatura di 1 grammo di una sostanza di 1 grado Celsius (o 1 kelvin):

La capacità termica specifica dipende solo dal tipo di sostanza che assorbe o rilascia calore. Si tratta di una proprietà intensiva, quindi non dipende dalla quantità della sostanza. Ad esempio, la piccola padella in ghisa ha una massa di 808 g. Il calore specifico del ferro (il materiale utilizzato per realizzare la padella) è, quindi:

La padella grande ha una massa di 4040 g. Utilizzando i dati per questa padella, possiamo anche calcolare il calore specifico del ferro:

Sebbene la padella grande sia più massiccia della piccola padella, poiché entrambi sono fatti dello stesso materiale, entrambi producono lo stesso valore per il calore specifico (per il materiale di costruzione, il ferro). Si noti che il calore specifico viene misurato in unità di energia per temperatura per massa ed è una proprietà intensiva, essendo derivato da un rapporto di due proprietà estese (calore e massa). La capacità termica molare, anche una proprietà intensiva, è la capacità termica per talpa di una particolare sostanza e ha unità di J/mol-°C.
L’acqua ha un calore specifico relativamente elevato (circa 4,2 J/g°C per il liquido e 2,09 J/g-C per il solido); la maggior parte dei metalli ha calore specifico molto più basso (di solito meno di 1 J/g-°C). Conoscendo la massa (m) di una sostanza e il suo calorespecifico( c ), si può determinare la quantità di calore, q, entrando o uscendo dalla sostanza misurando la variazione di temperatura (ΔT) prima e dopo che il calore è guadagnato o perso:
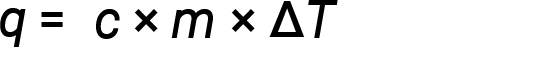
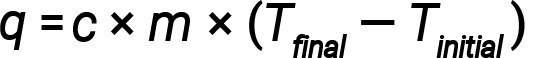
Se una sostanza guadagna energia termica, la sua temperatura aumenta, la sua temperatura finale è superiore alla sua temperatura iniziale, Tfinale − Tiniziale ha un valore positivo, e il valore di q è positivo. Se una sostanza perde energia termica, la sua temperatura diminuisce, la temperatura finale è inferiore alla temperatura iniziale, Tfinale − Tiniziale ha un valore negativo, e il valore di q è negativo.
Si noti che la relazione tra calore, calore specifico, massa e variazione di temperatura può essere utilizzata per determinare una di queste quantità (non solo il calore) se le altre tre sono conosciute o possono essere dedotte.
Questo testo è adattato da OpenStax Chemistry 2e, Sezione 5.1: Energy Basics and OpenStax Chemistry 2e, Sezione 5.3: Enthalpy.
