9.5:
Tendenze nell'energia dei reticoli: dimensione e carica degli ioni
9.5:
Tendenze nell'energia dei reticoli: dimensione e carica degli ioni
Un composto ionico è stabile a causa dell’attrazione elettrostatica tra i suoi ioni positivi e negativi. L’energia reticolare di un composto è una misura della forza di questa attrazione. L’energia reticolare(reticoloΔH)di un composto ionico è definita come l’energia necessaria per separare una talpa del solido nei suoi ioni gassosi componenti. Per il cloruro di sodio solido ionico, l’energia del reticolo è il cambiamento di entalpia del processo:
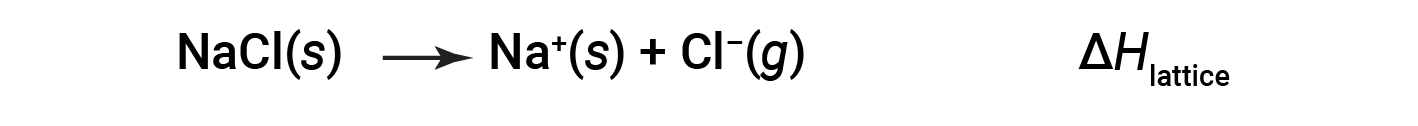
Convenzioni
Qui, la convenzione è usata dove il solido ionico è separato in ioni, il che significa che le energie del reticolo saranno endotermiche (valori positivi). Un altro modo è quello di usare una convenzione equivalente ma opposta, in cui l’energia del reticolo è esotermica (valori negativi) e descritta come l’energia rilasciata quando gli ioni si combinano per formare un reticolo. Pertanto, assicurarsi di confermare quale definizione viene utilizzata quando si cercano energie reticolari in un altro riferimento. In entrambi i casi, una magnitudine maggiore per l’energia del reticolo indica un composto ionico più stabile. Per cloruro di sodio, reticolo ΔH= 769 kJ. Pertanto, richiede 769 kJ per separare una talpa di NaCl solido in Ioni Na+ e Cl gassosi. Quando una talpa ciascuno di Na+ gassoso e Cl– gli ioni formano NaCl solido, vengono rilasciati 769 kJ di calore.
Legge di Coulomb ed energia reticolare
L’energia reticolare ΔH reticolare di un cristallo ionico può essere espressa dalla seguente equazione (derivata dalla legge di Coulomb, che governa le forze tra cariche elettriche):
ΔHreticolo = C(Z +)(Z−)/Ro
in cui C è una costante che dipende dal tipo di struttura cristallina; Z+ e Z– sono le cariche sugli ioni, e Roè la distanza interionica (la somma dei raggi degli ioni positivi e negativi). Così, l’energia reticolare di un cristallo ionico aumenta rapidamente man mano che le cariche degli ioni aumentano e le dimensioni degli ioni diminuiscono. Quando tutti gli altri parametri sono mantenuti costanti, raddoppiare la carica sia della catione che dell’anione quadruplica l’energia del reticolo.
Esempi
- L’energia reticolare di LiF (Z+ e Z– = 1) è 1023 kJ/mol, mentre quella di MgO(Z+ e Z– = 2) è di 3900 kJ/mol(Ro è quasi la stessa — circa 200 pm per entrambi i composti).
- Distanze interatomiche diverse producono diverse energie reticolari. Ad esempio, confrontare l’energia reticolare di MgF2 (2957 kJ/mol) con quella di MgI2 (2327 kJ/mol) per osservare l’effetto sull’energia reticolare della dimensione ionica più piccola di F– rispetto a I–.
- Il prezioso rubino gioiello è l’ossido di alluminio, Al2O3,contenente tracce di Cr3+. Il composto Al2Se3 è usato nella fabbricazione di alcuni dispositivi semiconduttori. In questi due composti ionici, le cariche Z+ e Z– sono le stesse, quindi la differenza nell’energia del reticolo dipende da Ro. Poiché l’O2– ione è più piccolo dello ione Se2 – , l’Al2O3 ha una distanza interionica più breve di Al2Se 3 e ha,quindi, un’energia reticolare più grande.
- Un altro esempio è l’ossido di zinco, ZnO, rispetto al NaCl. ZnO ha un’energia reticolare più grande perché i valori Z sia del catione che dell’anione in ZnO sono maggiori, e la distanza interionica di ZnO è più piccola di quella di NaCl.
Questo testo è adattato da Openstax, Chemistry 2e, Section 7.5: Strengths of Ionic and Covalent Bonds.
