9.13:
결합에너지와 결합길이
9.13:
결합에너지와 결합길이
안정적인 분자는 공유 결합이 원자를 함께 보유하기 때문에 존재합니다. 공유 결합의 강도는 그것을 깨는 데 필요한 에너지, 즉 결합 된 원자를 분리하는 데 필요한 에너지로 측정됩니다. 결합된 원자 한 쌍을 분리하려면 에너지가 필요합니다— 유대가 강해지고, 그것을 깨는 데 필요한 에너지가 커집니다.
기체 분자의 한 두더지에서 특정 공유 결합을 끊는 데 필요한 에너지는 결합 에너지 또는 결합 해리 에너지라고합니다. 다원자 분자에 대한 결합 에너지, DX-Y는,동위 반응에 대한 표준 엔탈피 변화로 정의된다 :
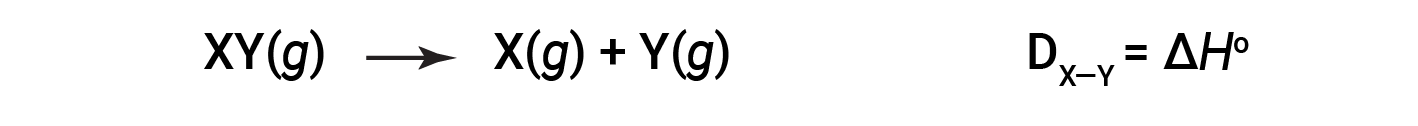
예를 들어, 순수한 공유 H-H 채권의 채권 에너지, DH-H- H는H-H 채권의 436 kJ/mol 깨진:

3개 이상의 원자를 가진 분자는 2개 이상의 결합을 가지고 있습니다. 이러한 분자에 있는 모든 결합 에너지의 합은 분자에 있는 모든 결합을 끊는 엔더럴 반응에 대한 표준 엔탈피 변화와 동일합니다. 예를 들어, CH4,1660 kJ에서 4개의 C-H 결합 에너지의 합은 반응의 표준 엔탈피 변화와 동일합니다.
평균 C-H 채권 에너지인 DC-H는1660/4 = 415kJ/mol이며, 반응의 두더지당 C-H 채권의 4개의 두더지가 있기 때문이다. 4개의 C-H 결합은 원래 분자에 동일하지만, 각각 깨기 위하여 동일한 에너지를 요구하지 않습니다; 첫 번째 채권이 깨지면 (439 kJ / mol이 필요함) 나머지 채권은 깨지기 쉽습니다. 415 kJ/mol 값은 하나의 채권을 끊는 데 필요한 정확한 값이 아니라 평균값입니다.
결합의 전자 쌍의 수가 증가함에 따라 두 원자 사이의 결합 강도가 증가합니다. 일반적으로 채권 강도가 증가함에 따라 채권 길이가 감소합니다. 따라서, 삼중 채권은 동일한 두 원자 사이의 이중 채권보다 강하고 짧습니다. 마찬가지로 이중 채권은 동일한 두 원자 간의 단일 채권보다 더 강하고 짧습니다. 한 원자가 한 그룹의 다양한 원자에 결합하면 일반적으로 그룹을 아래로 이동하면 채권 강도가 감소합니다. 예를 들어 C-F는 439kJ/mol, C-Cl은 330kJ/mol이고 C-Br은 275kJ/mol입니다.
본드 에너지는 형성의 엔탈피를 사용할 수없는 본드 엔탈피라고도 반응에 대한 대략적인 엔탈피 변화를 계산하는 데 사용할 수 있습니다. 이 유형의 계산은 반응이 외형인지 또는 동체인지 여부를 알려줍니다. 제품 내 채권이 반응제의 채권보다 강할 때 외형 반응(ΔH 음수, 열 생성)이 발생합니다. 벤더혈 반응(ΔH 양성, 열 흡수)은 제품의 결합이 반응제에 있는 것보다 약할 때 발생합니다.
엔탈피 변화, ΔH,화학 반응에 대한 반응의 경우 모든 결합을 분해하는 데 필요한 에너지의 합(에너지 “인”, 양수 기호)과 모든 결합이 제품에 형성될 때 방출되는 에너지(에너지 “out”, 음의 기호)와 거의 같습니다. 다음 방법으로 수학적으로 표현할 수 있습니다.

이 표현식에서 심볼은 “총합”을 의미하며© D는 kJ/mol의 결합 에너지를 나타내며, 이는 항상 양수입니다. 채권 에너지는 특정 채권이 단일 채권인지, 이중 또는 삼중 채권인지에 따라 달라집니다. 따라서, 이러한 방식으로 엔탈피를 계산할 때, 모든 반응제 및 제품의 결합을 고려하는 것이 중요하다. D 값은 일반적으로 많은 다른 분자에서 결합의 한 유형에 대 한 평균, 이 계산은 대략적인 추정을 제공, 하지 정확한 값, 반응의 엔탈피에 대 한.
다음 반응을 고려하십시오.
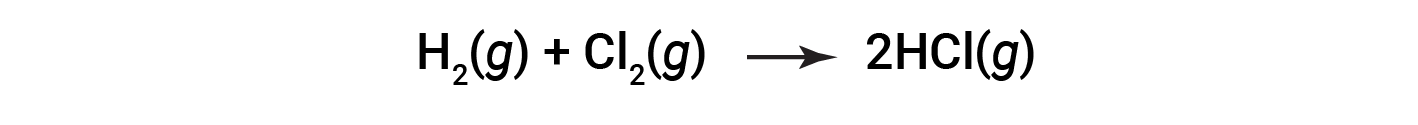
또는
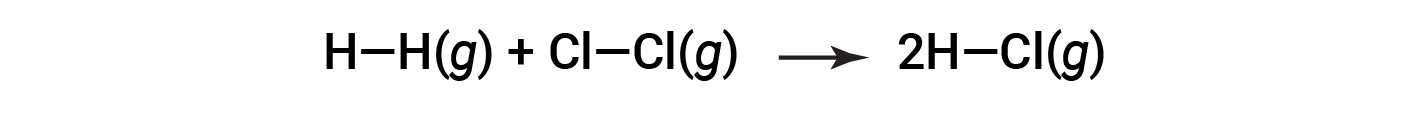
HCl의 두 더두를 형성하려면 H-H 채권 1개와 Cl-Cl 채권 1개를 깨야 합니다. 이러한 채권을 깨는 데 필요한 에너지는 H-H 채권(436kJ/mol)과 Cl-Cl 채권(243kJ/mol)의 결합입니다. 반응 하는 동안, H-Cl 채권의 두 더몰 형성 (채권 에너지 = 432 kJ/mol), 출시 2 × 432 kJ; 또는 864 kJ. 제품의 채권은 반응제보다 강하기 때문에 반응은 소비하는 것보다 더 많은 에너지를 방출합니다.

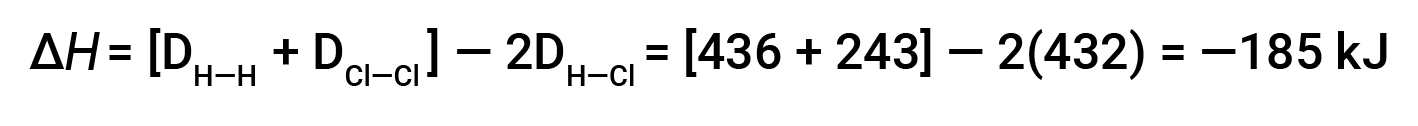
이 과잉 에너지는 열로 방출되므로 반응은 외설적입니다.
