11.7:
Hal Değişimleri: Buharlaşma ve Katılaşma
11.7:
Hal Değişimleri: Buharlaşma ve Katılaşma
Bir maddenin fiziksel formu, sıcaklığının değişmesiyle değişir. Örneğin, bir sıvının sıcaklığının yükseltilmesi sıvının buharlaşmasına (buhara dönüşmesine) neden olur. Bu sürece buharlaşma adı verilir—bir yüzey fenomeni. Buharlaşma, moleküllerin termal hareketi moleküller arası kuvvetlerin üstesinden geldiğinde ve moleküller (yüzeyde) gaz haline kaçtığında meydana gelir. Kapalı bir kapta bir sıvı buharlaştığında, gaz molekülleri kaçamaz. Bu gaz fazı molekülleri rastgele hareket ettikçe, zaman zaman yoğunlaşmış fazın yüzeyiyle çarpışacaklar ve bazı durumlarda bu çarpışmalar, moleküllerin yoğunlaşmış faza yeniden girmesine neden olacaktır. Gaz fazından sıvıya geçiş, yoğunlaşma olarak adlandırılır.
Buharlaşma endotermik bir süreçtir. Soğutma etkisi, yüzme veya duştan sonra belirgindir. Ciltteki su buharlaştığında ciltteki ısıyı uzaklaştırır ve cildi serinletir. Buharlaşma süreciyle ilişkili enerji değişimi, buharlaşma entalpisidir, ΔHvap. Örneğin, standart sıcaklıkta suyun buharlaşması şu şekilde temsil edilir:

Endotermik bir sürecin tersi ekzotermiktir. Ve böylece, bir gazın yoğunlaşması ısı açığa çıkarır:
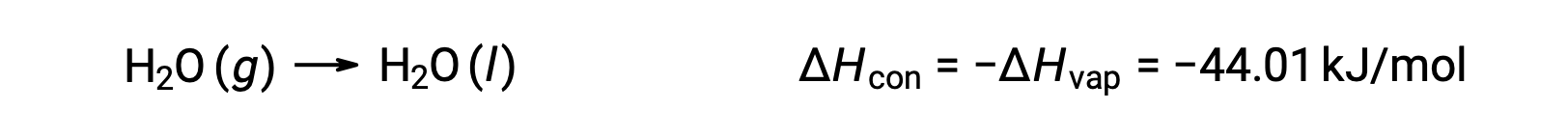
Buharlaşma ve yoğunlaşma zıt süreçlerdir; sonuç olarak, entalpi değerleri zıt işaretlerle aynıdır. Buharlaşma entalpisi pozitif iken, yoğunlaşma entalpisi negatiftir.
Farklı maddeler farklı düzeylerde buharlaşır (IMF’lerinin gücüne bağlı olarak) ve dolayısıyla farklı buharlaşma entalpisi değerleri gösterir. Moleküller arasındaki nispeten güçlü moleküller arası çekici kuvvetler, buharlaşma değerlerinin daha yüksek entalpisine neden olur. Zayıf moleküller arası çekimler, buharlaşmaya karşı daha az engel teşkil eder ve nispeten düşük buharlaşma entalpisi değerleri verir.
Bu metin bu kaynaktan uyarlanmıştır Openstax, Chemistry 2e, Section 10.3: Phase Transitions.
