11.12:
Curve di riscaldamento e raffreddamento
11.12:
Curve di riscaldamento e raffreddamento
Quando una sostanza, isolata dal suo ambiente, è soggetta a variazioni di calore, si osservano corrispondenti variazioni di temperatura e di fase della sostanza; questo è rappresentato graficamente da curve di riscaldamento e raffreddamento.
Ad esempio, l’aggiunta di calore aumenta la temperatura di un solido; la quantità di calore assorbita dipende dalla capacità termica del solido (q = mcsolidoΔT). Secondo la termochimica, la relazione tra la quantità di calore assorbito o rilasciato da una sostanza, q, e il suo conseguente cambiamento di temperatura, ΔT, è:
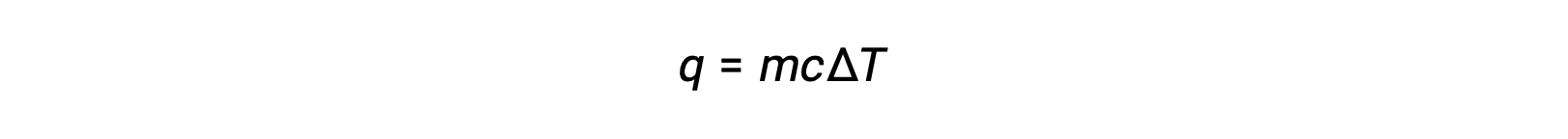
dove m è la massa della sostanza, e c è il suo calore specifico. La relazione si applica alla materia che viene riscaldata o raffreddata, ma non cambia stato.
Quando la temperatura è abbastanza alta, il solido inizia a sciogliersi (Figura 1, punto A). Il calore assorbito dipende dalla capacità termica del solido (q = mcsolidoΔT), e si osserva un plateau nel suo punto di fusione. L’altopiano indica un cambiamento di stato da solido a liquido, durante il quale la temperatura non aumenta a causa del calore di fusione (q = mΔHfusione). In altre parole, un ulteriore guadagno di calore è il risultato della diminuzione delle attrazioni intermolecolari, invece di aumentare le energie cinetiche molecolari. Di conseguenza, mentre una sostanza sta cambiando stato, la sua temperatura rimane costante.
Una volta che il solido si è completamente fuso (Figura 1, punto B),il liquido inizia a riscaldarsi e sperimenta un aumento della temperatura. Il calore assorbito dipende dalla capacità termica del liquido (q = mcliquidoΔT). Quando il liquido raggiunge il suo punto di ebollizione, il liquido inizia a vaporizzare (figura 1, punto C) e la temperatura rimane costante nonostante il continuo apporto di calore. Un altro plateau (temperatura costante) si osserva al punto di ebollizione del liquido durante la transizione da liquido a gas a causa del calore di vaporizzazione (q = mΔHvap). Questa stessa temperatura viene mantenuta dal liquido finché bolle. Se il calore viene fornito a una velocità maggiore, la temperatura del liquido non aumenta, ma invece l’ebollizione diventa più vigorosa (rapida). Dopo che tutto il liquido si è vaporizzato (Figura 1, punto D),la temperatura del gas aumenta.
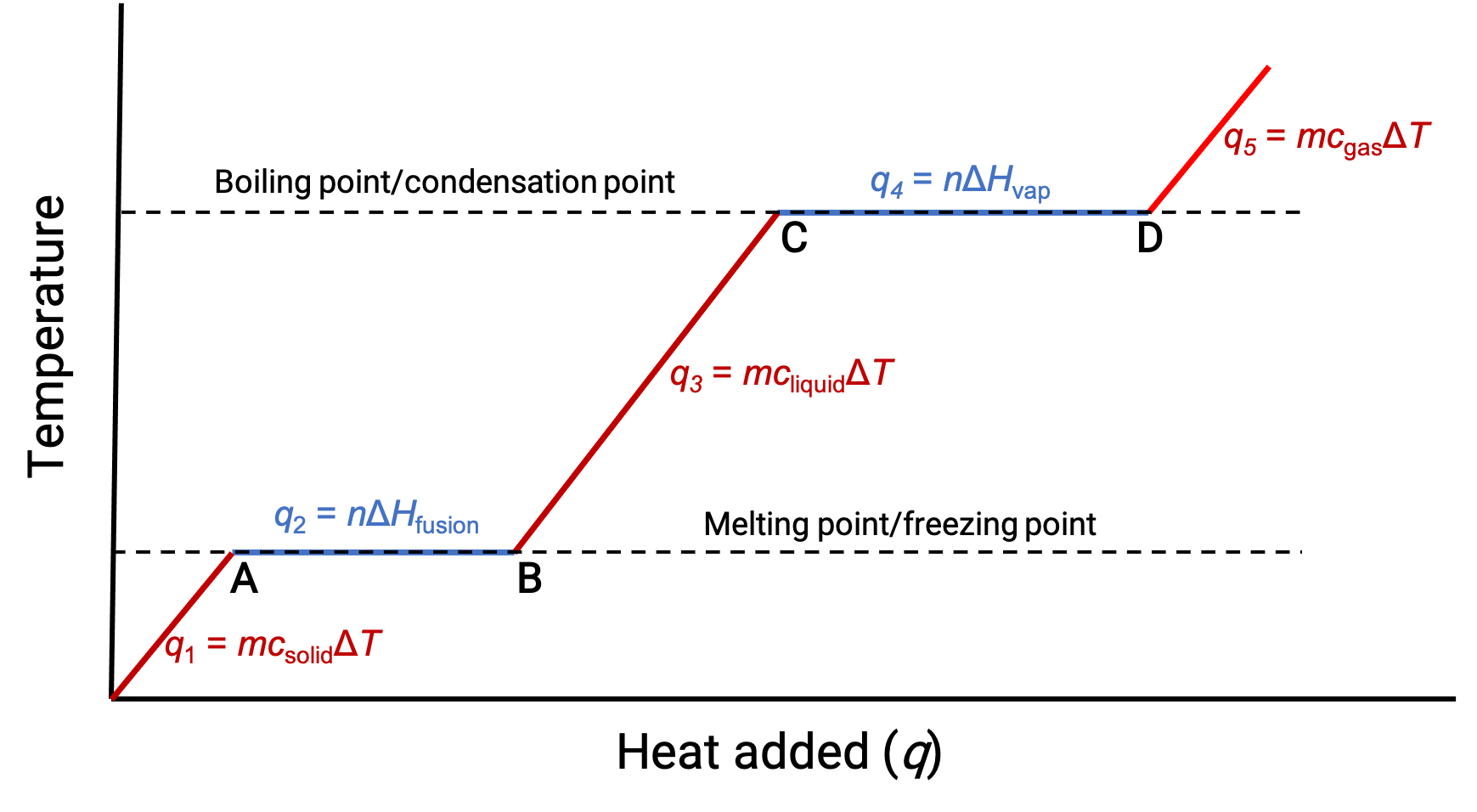
Figura 1. La curva di riscaldamento rappresentativa per una sostanza descrive i cambiamenti di temperatura che si traducono nel fatto che la sostanza assorbe quantità crescenti di calore. Gli altipiani nella curva (regioni a temperatura costante) sono esposti quando la sostanza subisce transizioni di fase.
Questo testo è adattato da Openstax, Chemistry 2e, Sezione 10.3: Phase Transitions.
