12.13:
コロイド
12.13:
コロイド
子どもたちが遊ぶとき、泥と水、小麦粉と水の混合物や、テンペラ絵具と呼ばれる乳化顔料の水への懸濁液などを作ることがあります。これらの懸濁液は、比較的大きな粒子からなる不均一な混合物で、肉眼や虫眼鏡で観察することができます。これらは濁っていて、混ぜると懸濁粒子が沈殿します。一方、溶液とは、沈殿を作らない均質な混合物であり、溶質は分子またはイオンです。溶液は、懸濁液とは全く異なる挙動を示します。溶液には色がついていることもありますが、見た目は透明であり、分子やイオンは目に見えず、放置しても沈殿しません。また、コロイド(またはコロイド分散液)と呼ばれる別の種類の混合物は、懸濁液と溶液の中間の性質を示します。コロイドの粒子はほとんどの分子よりも大きいが、コロイド粒子は十分に小さいため、放置しても沈殿しません。
コロイド分散液の調製
コロイドは、コロイドサイズの粒子を分散媒体に分散させることで調製されます。コロイドサイズの粒子は2つの方法で形成されます。
•分散法:大きな粒子を分解する方法。例えば、塗料の顔料は、大きな粒子を特殊なミルで粉砕して分散させることで製造されます。
• 凝集法:分子やイオンなどの小さな単位から成長していく方法。例えば、雲は水分子が凝縮して非常に小さな液滴になったときにできます。
いくつかの固体物質は、水と接触すると自然に分散し、コロイド系を形成します。ゼラチン、糊、でんぷん、脱脂粉乳などがその例です。粒子はすでにコロイド状になっていて、水がそれを分散させます。コロイドサイズの粉ミルク粒子は、ミルクスプレーを脱水することで作られます。乳化剤は、空気中で液体のコロイド状分散液を作ることができます。
エマルジョンは、本来混じり合わない2つの液体を振ったり混ぜたりすることで、一方の液体がコロイドサイズの液滴になり、もう一方の液体に分散したものです。海に流出した油は、波の影響でオイルと水がエマルジョンを形成することがあるため、しばしば清掃が困難となります。しかし、多くのエマルジョンでは、分散した相が合体して大きな滴を形成して分離します。そのため、エマルジョンは通常、乳化剤(分散液の合体を抑制する物質)によって安定化されます。例えば、水に灯油を入れたエマルジョンに少量の石鹸を入れると安定になります。牛乳は、カゼインというたんぱく質が乳化剤となり、乳脂肪が水に溶けています。マヨネーズは、油と酢のエマルジョンであり、卵黄成分が乳化剤として働いています。
凝集法では、分子やイオンの凝集によってコロイド状の粒子を形成します。しかし粒子がコロイドサイズの範囲を超えて成長すると、滴や沈殿物が形成され、コロイド系にはなりません。雲は、水分子が凝集してコロイドサイズの粒子を形成することで形成されます。この水の粒子が合体して、液体の水滴や固体の水の結晶として十分な大きさになると、雨やみぞれ、雪となって空から降ります。凝集法の多くは化学反応を伴います。水酸化鉄の赤いコロイド状の懸濁液は、塩化鉄(III)の濃厚な溶液と熱水を混ぜることで作ることができます。

塩化金酸のごく希薄な溶液を、ホルムアルデヒド、塩化スズ(II)、硫酸鉄(II)などの還元剤で還元すると、コロイド状の金ゾルが得られます。
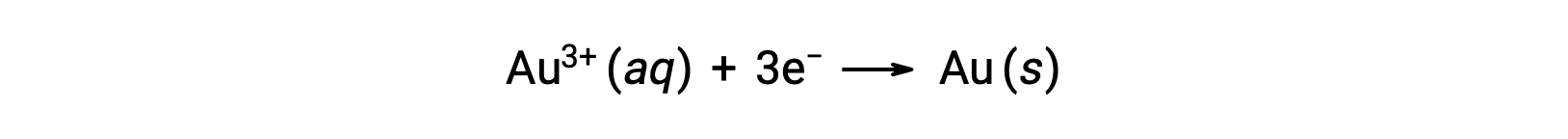
1857年に調製された金のゾルの中には、いまだに粒子が沈殿をつくらないものがあり、多くのコロイドが長時間安定していることを示しています。
石けんと洗剤
昔の人々は、木灰から炭酸カリウム(K2CO3)を熱水で浸出させた強塩基性溶液で油脂を煮て、石鹸を作りました。動物性油脂には、脂肪酸(長鎖カルボン酸)のポリエステルが含まれています。動物性油脂を炭酸カリウムや水酸化ナトリウムなどの塩基で処理すると、グリセロールやパルミチン酸、オレイン酸、ステアリン酸などの脂肪酸の塩が生成されます。この脂肪酸の塩を「石鹸」と呼びます。ステアリン酸のナトリウム塩であるステアリン酸ナトリウムは、無電荷の非極性炭化水素鎖であるC17H35基と、イオン性のカルボン酸基であるCOO−基を含んでいます。
石鹸や洗剤の洗浄作用は、その分子の構造によって説明できます。石鹸や洗剤の分子の炭化水素側(非極性)は、油やグリース、汚れの粒子などの非極性物質に溶けたり、引き寄せられたりします。一方、イオン性の末端は水(極性)に引き寄せられます。その結果、石けんや洗剤の分子は、汚れの粒子と水の界面で配向し、無極性と極性の異なる2つの物質の間の橋渡しをすることになります。このような分子は、疎水性(水と混ざらない性質)の部分と親水性(水と混ざりやすい性質)の部分の両方を持つことから、両親性と呼ばれています。その結果、汚れの粒子はコロイド状の粒子として浮遊し、容易に洗い流されることになります。
上記の文章は以下から引用しました。Openstax, Chemistry 2e, Section 11.5: Colloids.
Leitura Sugerida
- Riley, John T. "Appetizing colloids." Journal of Chemical Education 57, no. 2 (1980): 153.
- Friberg, Stig E., and Beverly Bendiksen. "A simple experiment illustrating the structure of association colloids." Journal of Chemical Education 56, no. 8 (1979): 553.
- Liang, Fuxin, Bing Liu, Zheng Cao, and Zhenzhong Yang. "Janus colloids toward interfacial engineering." Langmuir 34, no. 14 (2017): 4123-4131.
- Hansen, Robert S., and C. A. Smolders. "Colloid and surface chemistry in the mainstream of modern chemistry." (1962): 167.
