12.13:
Coloides
12.13:
Coloides
A menudo los niños preparan suspensiones a manera de juego tales como mezclas de barro y agua, harina y agua, o una suspensión de pigmentos sólidos en agua conocida como pintura de tempera. Estas suspensiones son mezclas heterogéneas compuestas de partículas relativamente grandes que son visibles a simple vista o pueden ser vistas con una lupa. Estas son turbias y las partículas suspendidas se asientan después de mezclarse. Por otra parte, una solución es una mezcla homogénea en la que no se produce sedimentación y en la que las especies disueltas son moléculas o iones. Las soluciones muestran un comportamiento completamente diferente de las suspensiones. Una solución puede estar coloreada, pero es transparente, las moléculas o iones son invisibles, y no se depositan al reposar. Otra clase de mezclas llamadas coloides (o dispersiones coloidales) presentan propiedades intermedias entre las de las suspensiones y las soluciones. Las partículas en un coloide son más grandes que la mayoría de las moléculas simples; sin embargo, las partículas coloidales son lo suficientemente pequeñas como para que no se asienten al reposar.
Preparación de Sistemas Coloidales
Los coloides se preparan produciendo partículas de dimensiones coloidales y distribuyendo estas partículas a través de un medio de dispersión. Las partículas de tamaño coloidal se forman mediante dos métodos:
• Métodos de dispersión: Descomposición de partículas más grandes. Por ejemplo, los pigmentos de pintura se producen dispersando partículas grandes mediante molienda en molinos especiales.
• Métodos de condensación: Crecimiento a partir de unidades más pequeñas, como moléculas o iones. Por ejemplo, las nubes se forman cuando las moléculas de agua se condensan y forman gotas muy pequeñas.
Algunas sustancias sólidas, cuando entran en contacto con el agua, se dispersan espontáneamente y forman sistemas coloidales. La gelatina, el pegamento, el almidón y la leche deshidratada en polvo se comportan de esta manera. Las partículas ya son de tamaño coloidal; el agua simplemente las dispersa. Las partículas de leche en polvo de tamaño coloidal se producen deshidratando el spray de leche. Algunos atomizadores producen dispersiones coloidales de un líquido en el aire.
Se puede preparar una emulsión agitando o mezclando dos líquidos inmiscibles. Esto rompe un líquido en gotitas de tamaño coloidal, que luego se dispersan por todo el otro líquido. Los derrames de petróleo en el océano pueden ser difíciles de limpiar, en parte porque la acción de las olas puede hacer que el aceite y el agua formen una emulsión. En muchas emulsiones, sin embargo, la fase dispersa tiende a coalescer, formar gotas grandes y separarse. Por lo tanto, las emulsiones son estabilizadas generalmente por un agente emulsificante, una sustancia que inhibe la coalescencia del líquido disperso. Por ejemplo, un poco de jabón estabilizará una emulsión de queroseno en agua. La leche es una emulsión de grasa butírica en agua, con la proteína caseína como agente emulsionante. La mayonesa es una emulsión de aceite en vinagre, con componentes de yema de huevo como agentes emulsionantes.
Los métodos de condensación forman partículas coloidales mediante la agregación de moléculas o iones. Si las partículas crecen más allá del rango de tamaño coloidal, se forman gotas o precipitados y no se produce ningún sistema coloidal. Las nubes se forman cuando las moléculas de agua se agregan y forman partículas de tamaño coloidal. Si estas partículas de agua coalescen para formar gotas lo suficientemente grandes de agua líquida o cristales de agua sólida, caen del cielo como lluvia, aguanieve o nieve. Muchos métodos de condensación implican reacciones químicas. Se puede preparar una suspensión coloidal roja de hidróxido de hierro(III) mezclando una solución concentrada de cloruro de hierro(III) con agua caliente:

Una solución coloidal de oro resulta de la reducción de una solución muy diluida de cloruro de oro(III) por un agente reductor como formaldehído, cloruro de estaño(II) o sulfato de hierro(II):
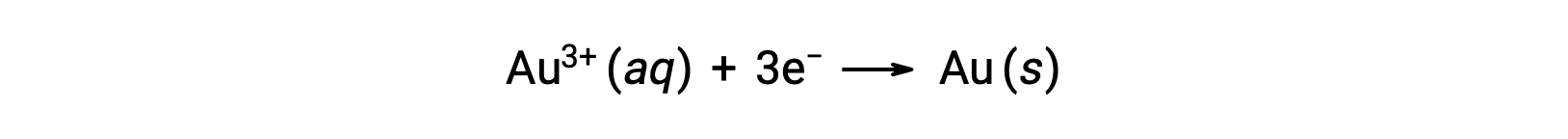
Algunas soluciones de oro preparadas en 1857 siguen intactas (las partículas no se han unido y asentado), lo que ilustra la estabilidad a largo plazo de muchos coloides.
Jabones y detergentes
Los pioneros fabricaron jabón hirviendo grasas con una solución fuertemente básica obtenida mediante lixiviación de carbonato de potasio, K2CO3, a partir de cenizas de madera con agua caliente. Las grasas animales contienen poliésteres de ácidos grasos (ácidos carboxílicos de cadena larga). Cuando las grasas animales se tratan con una base como carbonato de potasio o hidróxido de sodio, se forman glicerol y sales de ácidos grasos como ácido palmítico, oleico y esteárico. Las sales de los ácidos grasos se llaman jabones. La sal sódica del ácido esteárico, estearato de sodio, contiene una cadena de hidrocarburos no polares sin carga, la unidad C17H35 y un grupo de carboxilato iónico, la unidad COO−.
La acción limpiadora de los jabones y detergentes puede explicarse en términos de las estructuras de las moléculas implicadas. El extremo de hidrocarburo (no polar) de una molécula de jabón o detergente se disuelve o es atraído por sustancias no polares, como aceite, grasa o partículas de suciedad. El extremo iónico es atraído por el agua (polar). Como resultado, las moléculas de jabón o detergente se orientan en la interfaz entre las partículas de suciedad y el agua, por lo que actúan como una especie de puente entre dos tipos diferentes de materia, no polar y polar. Moléculas como esta se denominan anfipáticas ya que tienen una parte hidrofóbica (“que repele el agua”) y una parte hidrofílica (“que ama el agua”). Como consecuencia, las partículas de suciedad quedan suspendidas como partículas coloidales y se lavan fácilmente.
Este texto es adaptado de Openstax, Química 2e, Sección 11.5: Coloides.
Leitura Sugerida
- Riley, John T. "Appetizing colloids." Journal of Chemical Education 57, no. 2 (1980): 153.
- Friberg, Stig E., and Beverly Bendiksen. "A simple experiment illustrating the structure of association colloids." Journal of Chemical Education 56, no. 8 (1979): 553.
- Liang, Fuxin, Bing Liu, Zheng Cao, and Zhenzhong Yang. "Janus colloids toward interfacial engineering." Langmuir 34, no. 14 (2017): 4123-4131.
- Hansen, Robert S., and C. A. Smolders. "Colloid and surface chemistry in the mainstream of modern chemistry." (1962): 167.
