13.4:
Determinazione dell'ordine di reazione
13.4:
Determinazione dell'ordine di reazione
Le leggi sui tassi descrivono la relazione tra la velocità di una reazione chimica e la concentrazione dei suoi reagenti. In una legge di tasso, la costante di velocità k e gli ordini di reazione sono determinati sperimentalmente osservando come cambia il tasso di reazione man mano che le concentrazioni dei reagenti vengono modificate. Un approccio sperimentale comune alla determinazione delle leggi sui tassi è il metodo dei tassi iniziali. Questo metodo prevede la misurazione delle velocità di reazione per più prove sperimentali effettuate utilizzando diverse concentrazioni iniziali di reagenti. Il confronto dei tassi misurati per queste prove consente di determinare gli ordini di reazione e, successivamente, la costante di velocità, che insieme vengono utilizzati per formulare una legge sui tassi.
La velocità di reazione, ad esempio, che coinvolge ossido nitrico con ozono [NO (g) + O3 (g) ⟶ NO2 (g) + O2 (g)] può essere determinata dai dati sperimentali del metodo dei tassi iniziali, in laboratorio.
| Prova | [NO] (mol/L) | [O3] (mol/L) | Δ[NO2]/Δt (mol/L·s) |
| 1 | 1,00 × 10-6 | 3,00 × 10-6 | 6,60 × 10-5 |
| 2 | 1,00 × 10-6 | 6,00 × 10-6 | 1,32 × 10-4 |
| 3 | 1,00 × 10-6 | 9.00 × 10−6 | 1,98 × 10-4 |
| 4 | 2,00 × 10-6 | 9.00 × 10−6 | 3,96 × 10-4 |
| 5 | 3,00 × 10-6 | 9.00 × 10−6 | 5,94 × 10-4 |
Dai dati sulle velocità, una legge generica sulle tassi; rate = k[NO]m[O3]n è formulato. I valori degli ordini di reazione m e ne la costante di velocità k sono determinati dai dati sperimentali utilizzando un processo in tre parti:
Nel passaggio 1, il valore di m viene determinato dai dati in cui [NO] varia e [O3] è costante. Nelle prove 3, 4 e 5, [NO] varia mentre [O3]rimane costante. Quando [NO] raddoppia dalla prova 3 a 4, il tasso raddoppia, e quando [NO] triplica dalla prova 3 a 5, anche il tasso triplica. Pertanto, il tasso è anche direttamente proporzionale a [NO], e m nella legge del tasso è uguale a 1.
Nel passaggio 2, il valore di n viene determinato dai dati in cui [O3] varia e [NO] è costante. Nelle prove 1,2 e 3, [NO] è costante e [O3] varia. La velocità di reazione cambia in proporzione diretta alla variazione in [O3]. Quando [O3] raddoppia dalla prova da 1 a 2, il tasso raddoppia; quando [O3] triplica dalla prova 1 a 3, anche il tasso aumenta. Pertanto, il tasso è direttamente proporzionale a [O3], e n è uguale a 1. La legge dei tassi è quindi: tasso = k [NO]1 [O3]1 = k [NO][O3]
Nel passaggio 3, il valore di k è determinato da un insieme di concentrazioni (ad esempio, i dati della prova 1) e dal suo tasso corrispondente.
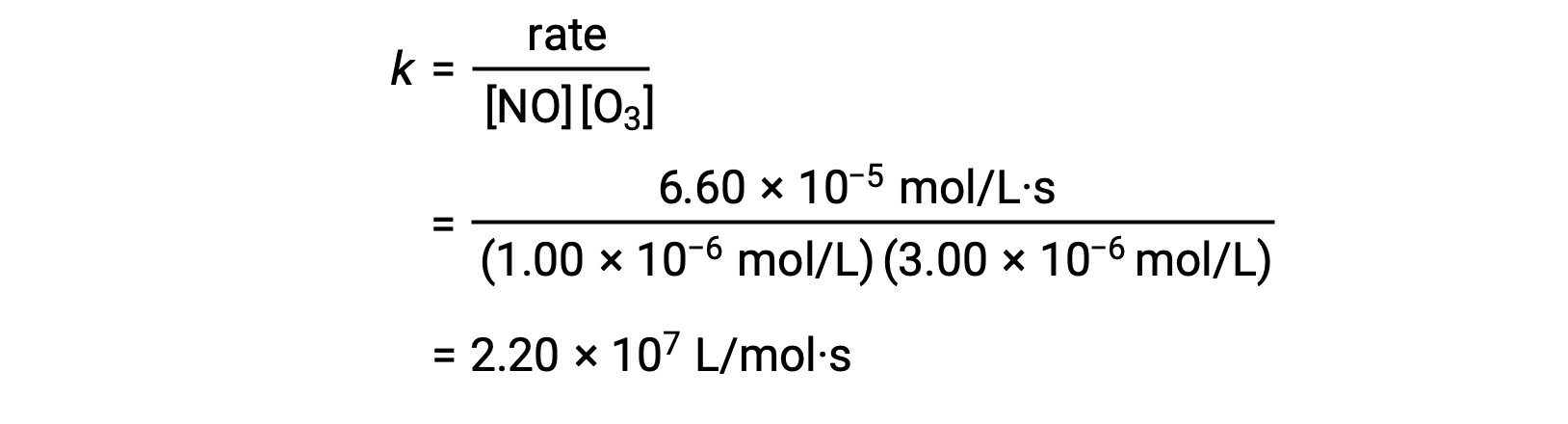
Nelle reazioni in cui i dati del metodo dei tassi iniziali non implicano direttamente la relazione tra le concentrazioni iniziali e i tassi iniziali, è possibile utilizzare un calcolo che comporti il rapporto tra le leggi sui tassi per calcolare l’ordine di reazione e la costante di velocità.
Ad esempio, la legge generale sui tassi per la reazione 2 NO (g) + Cl2 (g) ⟶ 2 NOCl (g) è espressa come: tasso = k [NO]m[Cl2]n.
I dati del metodo delle tariffe iniziali sono:
| Prova | [NO] (mol/L) | [Cl2] (mol/L) | Tasso iniziale (mol/L·s) |
| 1 | 0.10 | 0.10 | 0.00300 |
| 2 | 0.10 | 0.15 | 0.00450 |
| 3 | 0.15 | 0.10 | 0.00675 |
I valori di m e n possono essere determinati dai dati sperimentali usando un approccio algebrico, seguendo il quale viene determinato il valore di k.
Nel passaggio 1, il valore di m viene determinato dai dati in cui [NO] varia e [Cl2] è costante. Un rapporto tra le leggi sui tassi è espresso sostituendo i dati di due diverse prove (ad esempio la sperimentazione 3 e la prova 1).

Nel passaggio 2, il valore di n viene determinato dai dati in cui [Cl2] varia e [NO] è costante.
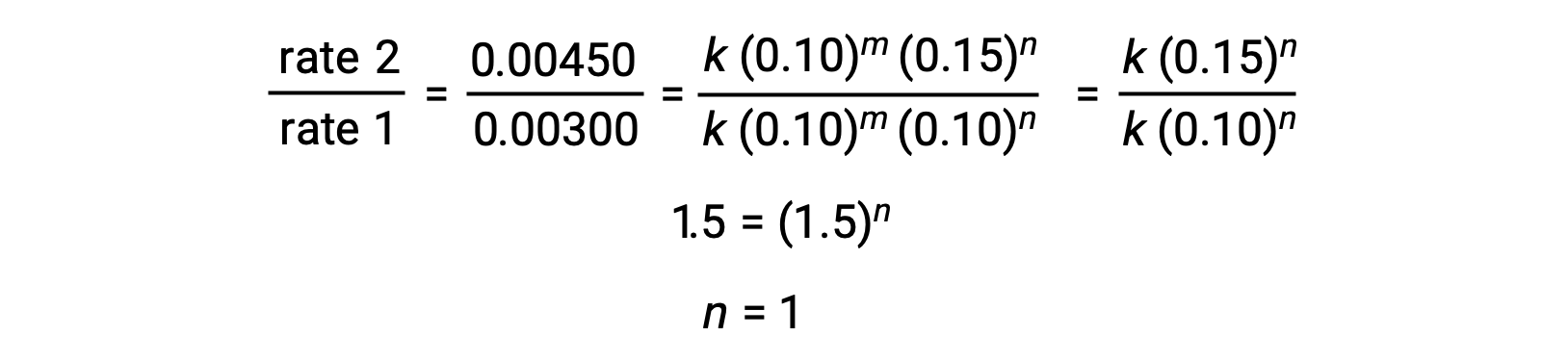
Utilizzando i valori calcolati di m e n la legge dei tassi è espressa come rate = k [NO]2 [Cl2].
Nel passaggio 3, il valore numerico della costante di velocità k è determinato con unità appropriate. Le unità per la velocità di reazione sono mol/L·s. Le unità per k si concludono sostituendo le unità di tutti gli altri parametri della legge sui tassi. In questo esempio, le unità di concentrazione sono mol3/L3. Le unità per k devono essere L2/mol2·s in modo che il tasso sia in termini di mol/L·s. Il valore di k è determinato una volta risolta l’espressione della legge del tasso, sostituendo semplicemente i valori di una qualsiasi delle prove sperimentali (ad esempio la prova 1).
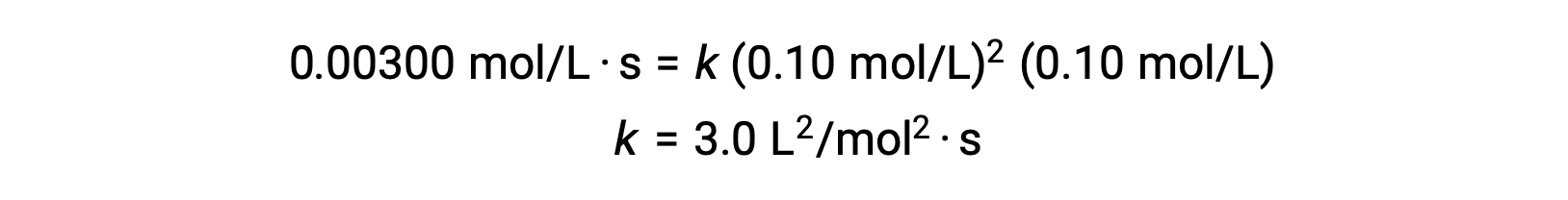
Ordine di reazione e unità costanti di velocità
In alcune reazioni, gli ordini di reazione nella legge dei tassi sono gli stessi dei coefficienti nell’equazione chimica per la reazione. Si tratta semplicemente di una coincidenza e molto spesso non è così. Le leggi sui tassi possono mostrare ordini frazionari per alcuni reagenti, e gli ordini di reazione negativa sono talvolta osservati quando un aumento della concentrazione di un reagente causa una diminuzione della velocità di reazione. Le leggi sui tassi sono determinate solo dall’esperimento e non sono previste in modo affidabile dalla stechiometria di reazione.
Le unità per una costante di velocità varieranno a seconda dei casi per adattarsi all’ordine complessivo della reazione. L’unità della costante di velocità per una reazione di ordine zero è mol/L·s (o M/s) e quella per una reazione di primo ordine è 1/s. L’unità della costante di velocità per una reazione di secondo ordine è L/mol·s (o 1/M·s) e che per una reazione di terzo ordine è L2/mol2·s. Sebbene le unità specifiche per la concentrazione e il tempo siano indicate come (mol/L) e (s), qualsiasi altra unità valida può essere utilizzata per rappresentare le proprietà della concentrazione e del tempo.
Questo testo è adattato da Openstax, Chemistry 2e, Section 12.3: Rate Laws.
