13.7:
Dependência da Temperatura em Relação à Velocidade de Reação
13.7:
Dependência da Temperatura em Relação à Velocidade de Reação
A Teoria das Colisões
Átomos, moléculas, ou iões devem colidir antes de poderem reagir uns com os outros. Os átomos devem estar próximos para formarem ligações químicas. Esta premissa é a base de uma teoria que explica muitas observações em cinética química, incluindo factores que afetam as velocidades de reação.
A teoria das colisões baseia-se nos postulados que (i) a velocidade de reação é proporcional à velocidade de colisões dos reagentes, (ii) a espécie que reage colide em uma orientação permitindo o contacto entre os átomos que ficam unidos no produto, e (iii) a colisão ocorre com energia adequada para permitir a penetração mútua das camadas de valência das espécies que reagem, de modo a que os eletrões se possam reorganizar e formar novas ligações (e novas espécies químicas).
Por exemplo, em uma reação em fase gasosa entre monóxido de carbono e oxigénio, que ocorre a temperaturas e pressões elevadas, o primeiro passo é uma colisão entre as duas moléculas.
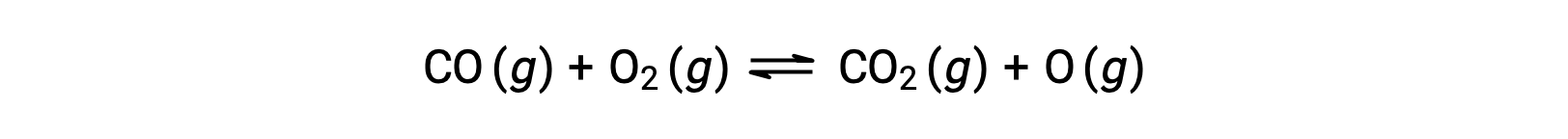
No entanto, poderia haver muitas orientações relativas diferentes em que as duas moléculas colidem. Assim, a orientação das moléculas que colidem tem grande significado na determinação parcial da viabilidade de uma reação que ocorre entre elas.
Por um lado, a porção do oxigénio da molécula de monóxido de carbono pode colidir com a molécula de oxigénio. Por outro lado, a porção do carbono da molécula de monóxido de carbono pode colidir com a molécula de oxigénio. O segundo caso é mais provável que resulte na formação de dióxido de carbono, com um átomo de carbono central ligado a dois átomos de oxigénio (O = C = O).
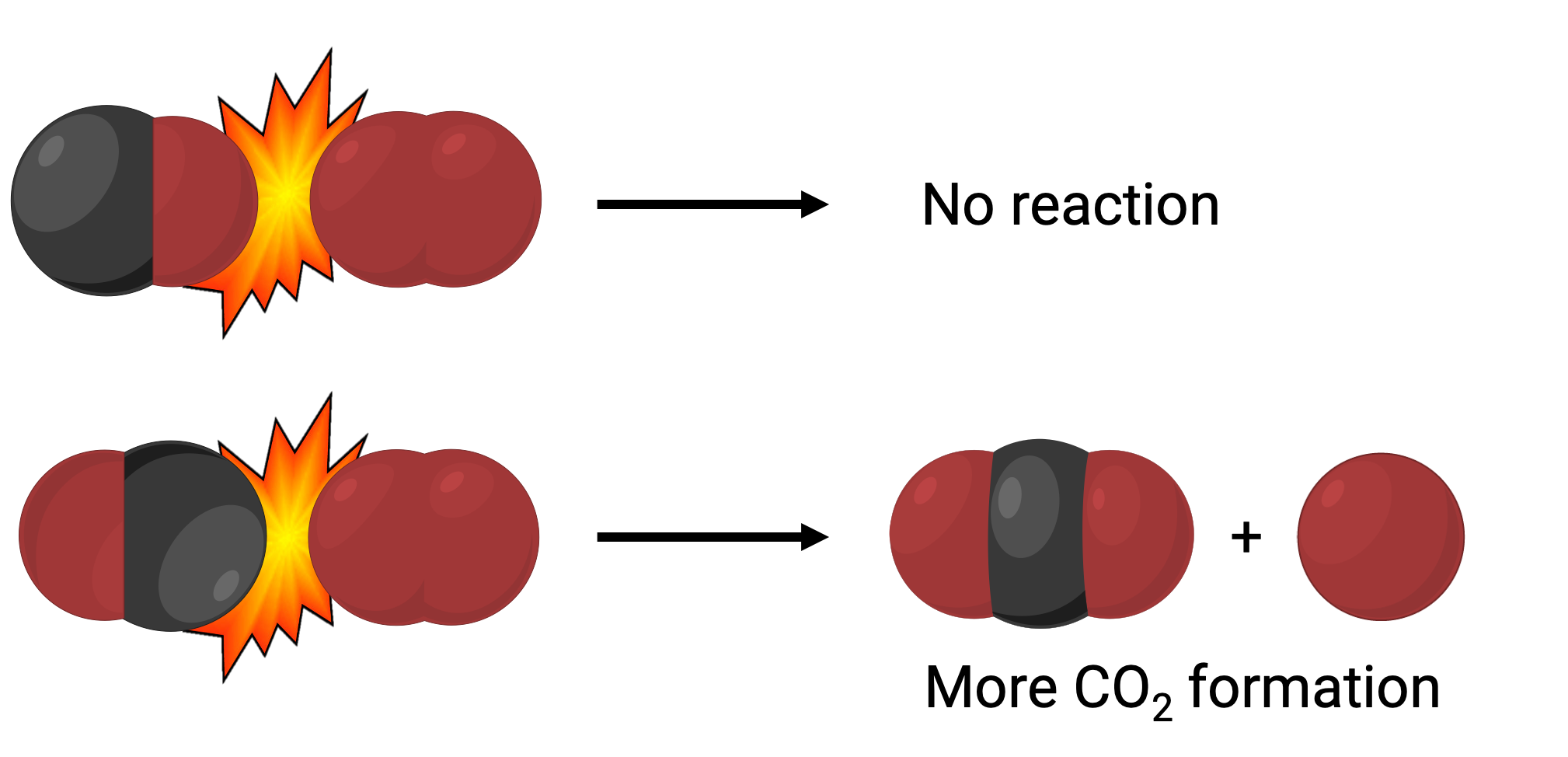
No entanto, mesmo que a colisão ocorra na orientação certa, a garantia de que a reação irá formar dióxido de carbono é limitada. Isto porque, além da orientação adequada, a colisão também deve ocorrer com energia suficiente chamada energia de ativação para resultar na formação do produto. Quando as espécies reagentes colidem com a orientação certa e energia de ativação suficiente, elas combinam-se para formar uma espécie instável chamada de complexo ativado ou um estado de transição. Estas espécies são de curta duração e geralmente indetectáveis pela maioria dos instrumentos analíticos. Em alguns casos, medições espectrais sofisticadas podem observar estados de transição.
A teoria das colisões explica porque é que a maioria das velocidades de reação aumenta à medida que a temperatura aumenta; com um aumento na temperatura, a frequência das colisões aumenta. Mais colisões significam uma velocidade de reação mais rápida, assumindo que a energia das colisões é adequada.
Energia de Ativação
A energia mínima necessária para formar um produto durante uma colisão entre reagentes é chamada de energia de ativação (Ea). A diferença entre a energia de ativação necessária e a energia cinética fornecida pelas moléculas de regentes em colisão é um factor primário que afeta a velocidade de uma reação química. Se a energia de ativação for muito maior do que a energia cinética média das moléculas, a reação ocorrerá lentamente, uma vez que apenas algumas moléculas de movimento rápido terão energia suficiente para reagir. Se a energia de ativação for muito menor do que a energia cinética média das moléculas, uma grande fração de moléculas será adequadamente energética, e a reação prosseguirá rapidamente.
Diagramas de reação são amplamente utilizados na cinética química para ilustrar várias propriedades de uma reação de interesse. Eles mostram como a energia de um sistema químico muda enquanto sofre uma reação, convertendo reagentes em produtos.
Por exemplo, considere o seguinte diagrama de reação para uma reação exotérmica: A + B → C + D;
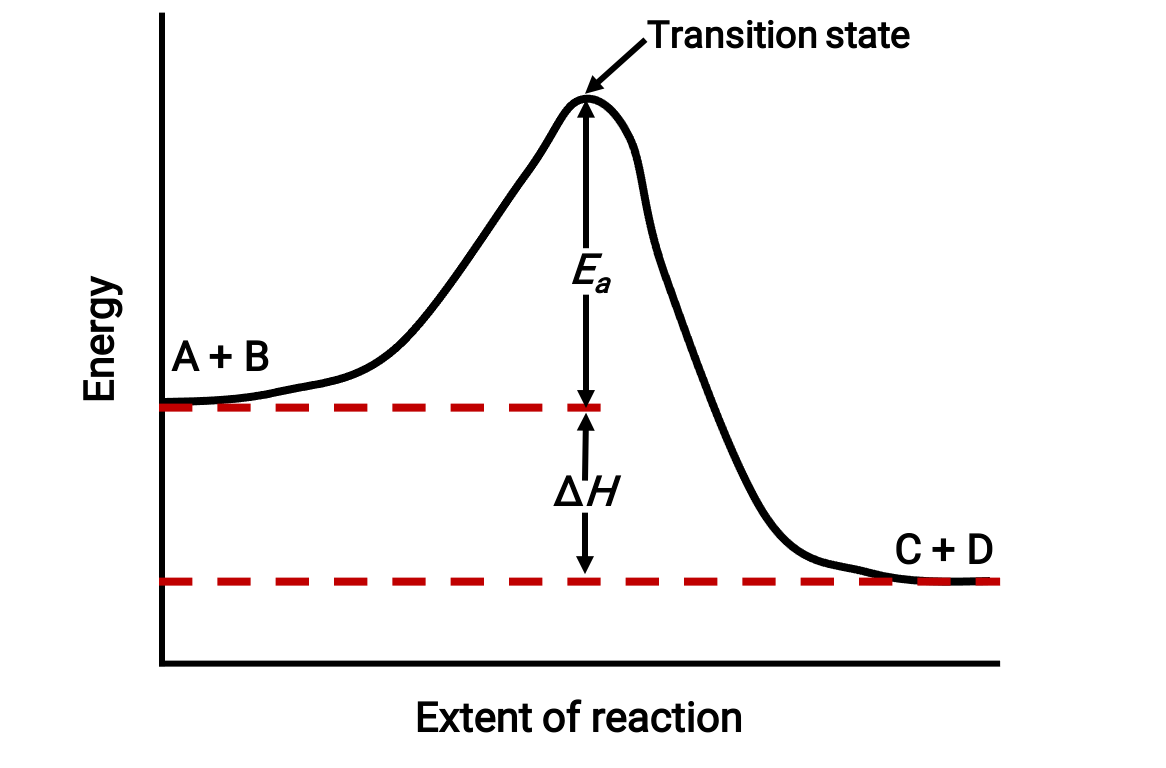
O diagrama é visto da esquerda para a direita. Inicialmente, o sistema consiste apenas de reagentes (A + B). Assim que as moléculas de reagentes com energia suficiente colidem, elas formam um complexo ativado de alta energia ou um estado de transição. Em seguida, o estado de transição instável decai para formar produtos estáveis (C + D).
O diagrama representa a energia de ativação da reação, Ea, como a diferença de energia entre os reagentes e o estado de transição. A diferença energética entre os reagentes e os produtos corresponde à alteração da entalpia da reação (ΔH). Neste caso, a reação é exotérmica (ΔH < 0), uma vez que produz uma diminuição da entalpia do sistema.
Equação de Arrhenius
A equação de Arrhenius, k = Ae−Ea/RT relaciona a energia de ativação e a constante de velocidade, k, para muitas reações químicas.
Nesta equação, R é a constante de gás ideal, que tem um valor de 8,314 J/mol·K, T é a temperatura em kelvin, Ea é a energia de ativação em joules por mole, e é a constante 2,7183, e A é uma constante chamada de factor de frequência, que está relacionado com a frequência de colisões e com a orientação das moléculas reativas. A equação de Arrhenius acomoda bem os postulados da teoria das colisões. O factor de frequência, A, reflete o quão bem as condições da reação favorecem colisões corretamente orientadas entre moléculas de reagentes. Uma maior probabilidade de colisões eficientemente orientadas resulta em valores maiores para A e velocidades de reação mais rápidas.
O termo exponencial, e−Ea/RT, descreve o efeito da energia de ativação na velocidade de reação. De acordo com a teoria cinética molecular, a temperatura da matéria é uma medida da energia cinética média dos seus átomos ou moléculas constituintes—uma energia de ativação mais baixa resulta em uma fração mais significativa de moléculas com energia adequada e uma reação mais rápida.
O termo exponencial também descreve o efeito da temperatura na velocidade da reação. Uma temperatura mais alta representa uma fração correspondentemente maior de moléculas que possuem energia suficiente (RT) para superar a barreira de ativação (Ea). Isto produz um valor mais elevado para a constante de velocidade e uma velocidade de reação correspondentemente mais rápida.
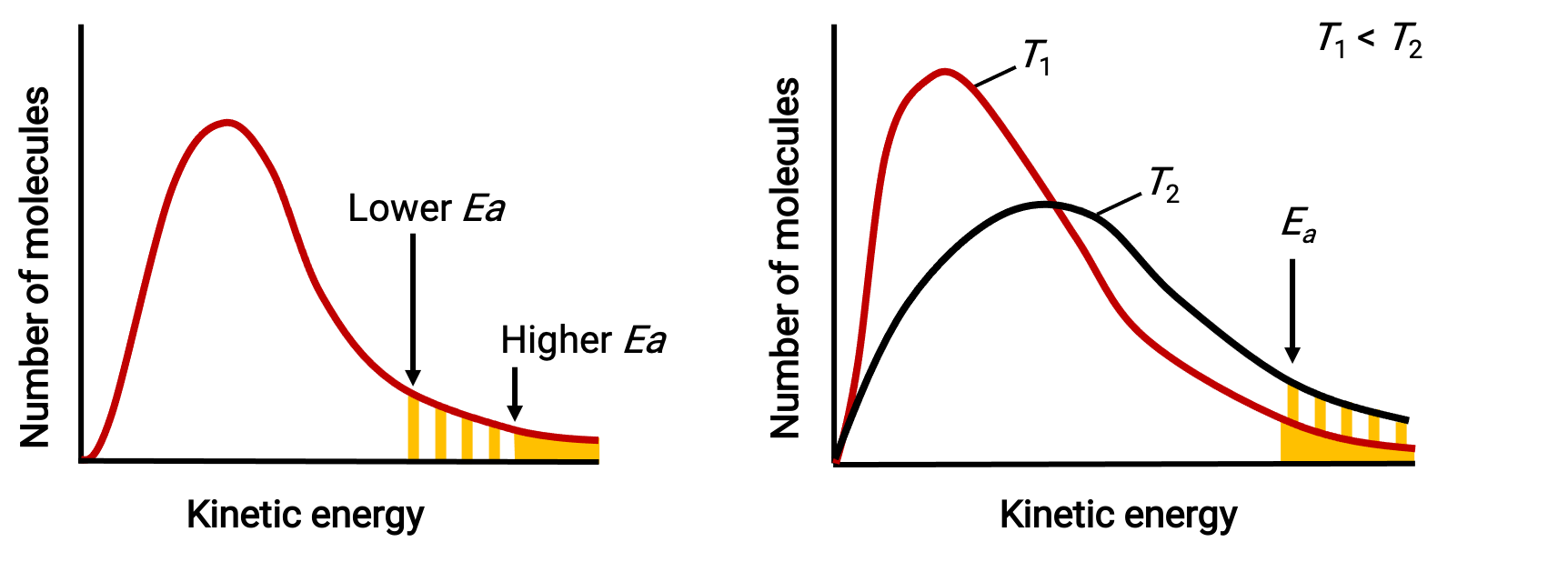
Distribuições de energia molecular mostram números de moléculas com energias que excedem duas energias de ativação diferentes a uma determinada temperatura, e uma determinada energia de ativação a duas temperaturas diferentes.
Este texto é adaptado de Openstax, Chemistry 2e, Section 12.5: Collision Theory.
