13.12:
Enzimi
13.12:
Enzimi
All’interno degli organismi viventi, gli enzimi fungono da catalizzatori per molte reazioni biochimiche coinvolte nel metabolismo cellulare. Il ruolo degli enzimi è quello di ridurre le energie di attivazione delle reazioni biochimiche formando complessi con i suoi substrati. L’abbassamento delle energie di attivazione favorisce un aumento dei tassi di reazioni biochimiche.
Le carenze enzimatiche possono spesso tradursi in malattie potenzialmente letali. Ad esempio, un’anomalia genetica che provoca la carenza dell’enzima G6PD (glucosio-6-fosfato deidrogenasi) influisce negativamente sulla via metabolica che fornisce NADPH alle cellule.
Un’interruzione di questa via metabolica può ridurre il glutatione nei globuli rossi causando danni ad altri enzimi e proteine come l’emoglobina. L’eccessiva metabolizzazione dell’emoglobina aumenta il livello di bilirubina, che porta all’ittero, una condizione che può diventare grave. Pertanto, le persone che soffrono di carenza di G6PD devono evitare determinati alimenti e medicinali contenenti sostanze chimiche che potrebbero causare danni ai loro globuli rossi carenti di glutatione.
Funzione e struttura enzimatica
Gli enzimi sono raggruppati in classi diverse in base alla funzione specifica che svolgono. Ad esempio, le ossidoreduttasi sono coinvolte nelle reazioni redox, mentre le transferasi catalizzano il trasferimento di gruppi funzionali. La formazione di legami con l’idrolisi dell’ATP richiede ligasi, mentre le reazioni di idrolisi e la formazione di doppi legami sono catalizzate rispettivamente da idrolasi e liscivie. Gli enzimi isomerasi di solito catalizzano reazioni di isomerizzazione.
Gli enzimi generalmente possiedono siti attivi. Queste sono regioni specifiche sulla molecola con una conformazione che favorisce l’enzima a legarsi a un substrato specifico (una molecola reagente) per formare un complesso enzima-substrato o l’intermedio di reazione.
Due modelli, il modello lock-and-key e il modello indotto, tentano di spiegare il funzionamento di un sito attivo (Figura 1). L’ipotesi più semplicistica del lock-and-key suggerisce che il sito attivo e la forma molecolare del substrato sono complementari, adattandosi insieme come una chiave in una serratura (Figura 1a). D’altra parte, l’ipotesi dell’adattamento indotto suggerisce che la molecola enzimatica è flessibile e cambia forma per adattarsi a un legame con il substrato (Figura 1b).
Tuttavia, sia il modello lock-and-key che il modello induced-fit tengono conto del fatto che gli enzimi possono legarsi solo con substrati specifici e catalizzano solo una particolare reazione.
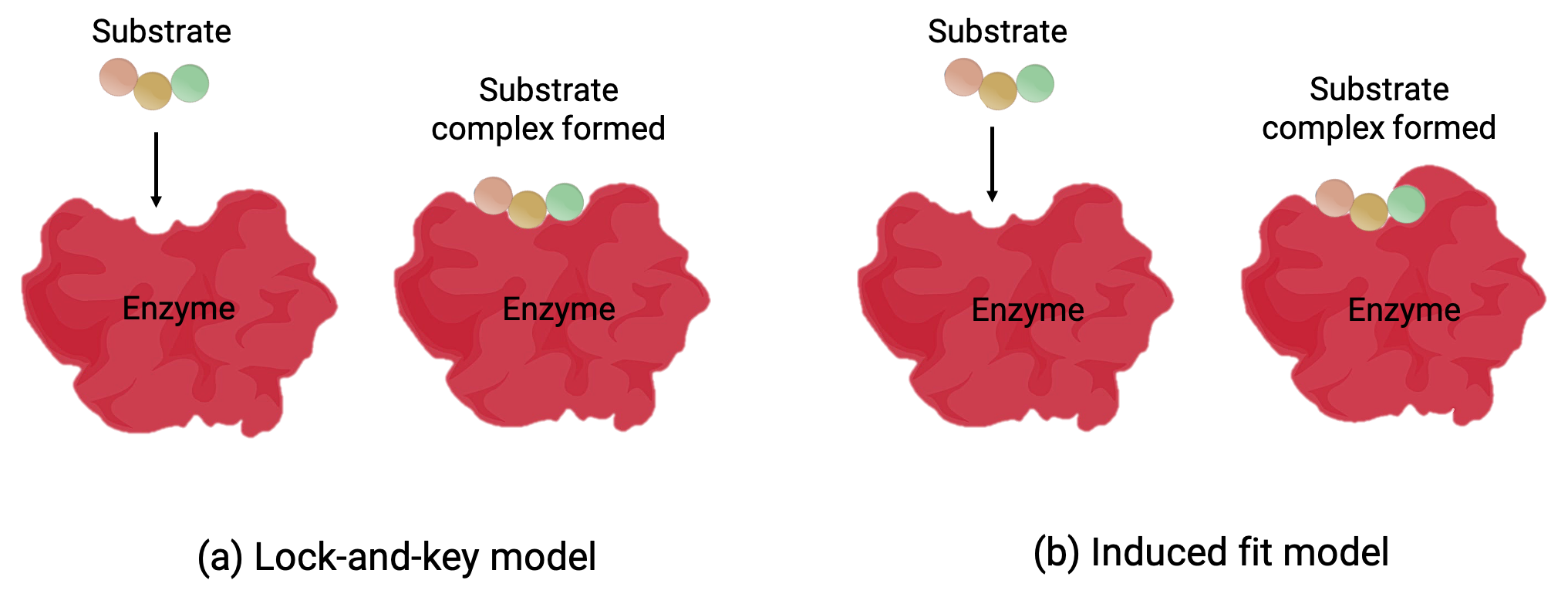
Figura 1 (a) Secondo il modello lock-and-key, la forma del sito attivo di un enzima è perfetta per il substrato. (b) Secondo il modello di adattamento indotto, il sito attivo è in qualche modo flessibile e può cambiare forma per legarsi con il substrato.
Inibitori enzimatici
L’attività degli enzimi può anche essere interrotta dal processo di inibizione enzimatica. Esistono diversi tipi comuni di inibizione enzimatica.
Durante l’inibizione competitiva, una molecola (naturale o sintetica) diversa dal substrato si lega direttamente al sito attivo dell’enzima. La somiglianza strutturale e chimica dell’inibitore con il substrato ne facilita il legame con il sito attivo. Tali inibitori competitivi, quindi, competono con i substrati, impedendo loro di legarsi all’enzima. Molto spesso, l’aumento della concentrazione del substrato può sopprimere gli effetti dell’inibizione competitiva.
Nell’inibizione non competitiva, una molecola (naturale o sintetica) si lega ad una regione allosterica (altra) dell’enzima, diversa dal suo sito attivo. Il legame inibitore provoca un cambiamento conformazionale al sito attivo dell’enzima, con conseguente diminuzione della capacità dell’enzima di catalizzare la reazione. A differenza dell’inibizione competitiva, un aumento della concentrazione del substrato non mitiga gli effetti inibitori dell’inibizione non competitiva.
Parte di questo testo è adattato da Openstax, Chimica 2e, Sezione 12.7: Catalisi.
