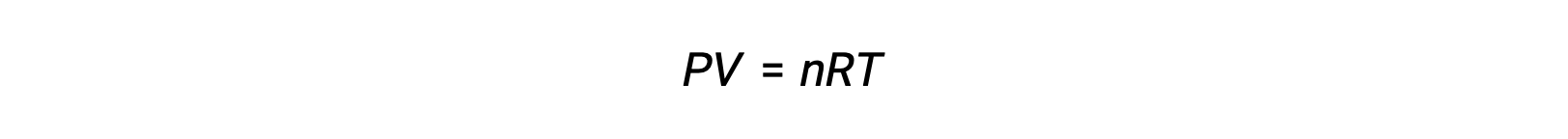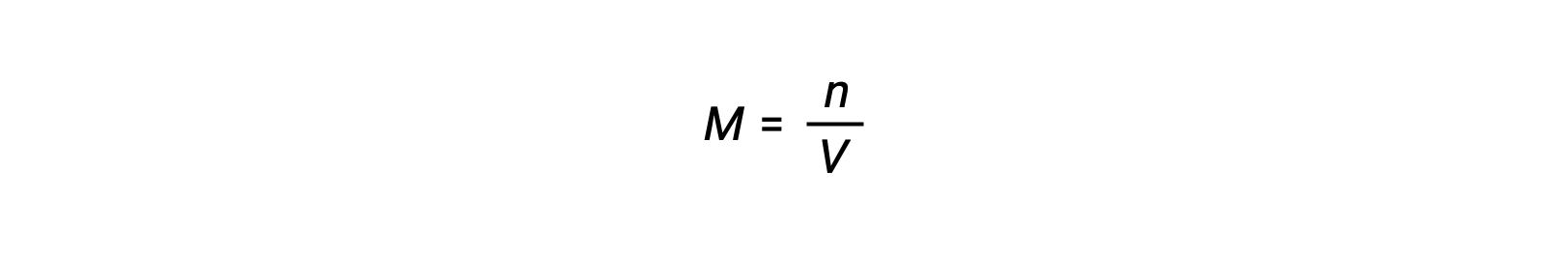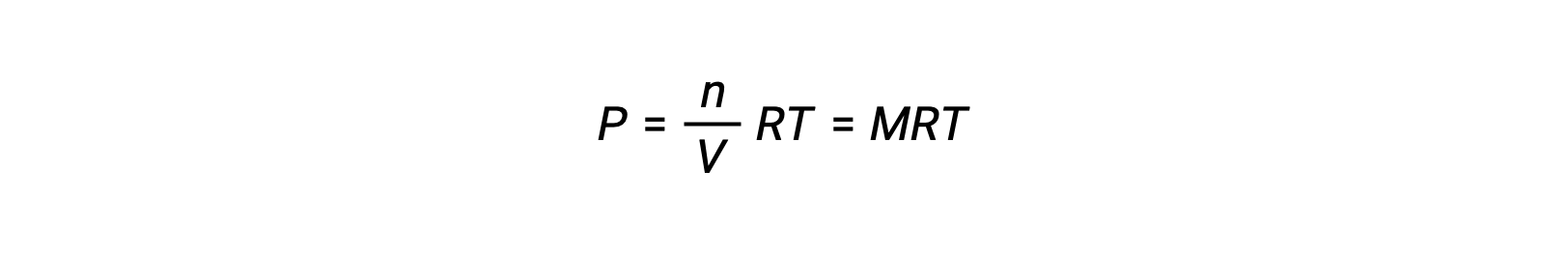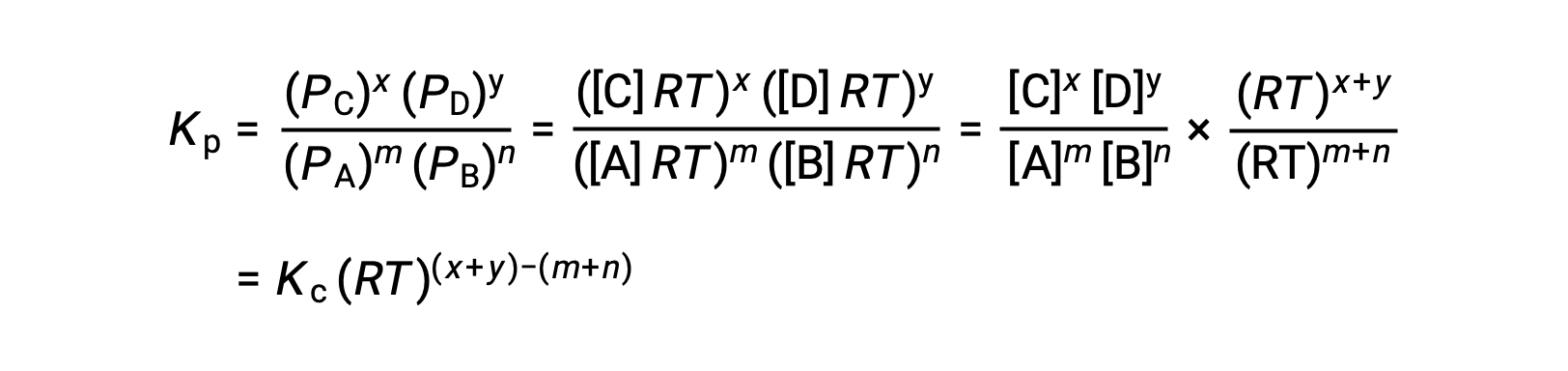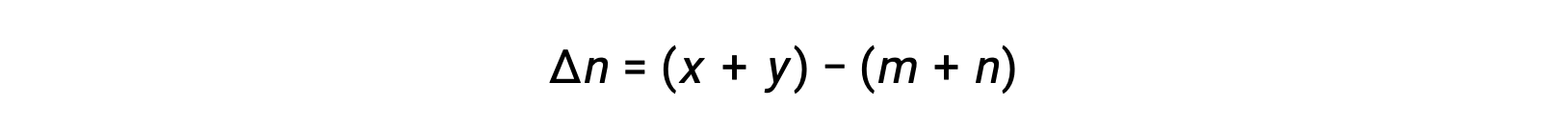Voor chemische reacties, waarbij de reactanten en producten allemaal gassen zijn, kan de evenwichtsconstante ook worden berekend met behulp van de individuele partiële drukken in plaats van hun molaire concentraties. Dus wanneer gassen A en B in een omkeerbare reactie worden omgezet in gassen C en D, kan de evenwichtsuitdrukking in plaats daarvan worden geschreven als de partiële druk van elk gas, verhoogd tot hun stoichiometrische coëfficiënten. De evenwichtsconstante wordt aangeduid als Kp, waarbij het onderschrift p de druk aangeeft.Voor een gegeven gasvormige reactie is Kp niet noodzakelijk gelijk aan Kc, omdat de partiële druk van een gas en zijn molaire concentratie afzonderlijke waarden zijn. Er kan echter een verband worden afgeleid tussen de twee constanten met behulp van de ideale gasvergelijking en de definitie van molariteit. Om dit verband af te leiden, moet u de evenwichtsuitdrukkingen voor Kc en Kp voor de gegeven chemische reactie beschouwen.De ideale gasvergelijking relateert de druk van een gas aan het aantal mol en het volume bij een bepaalde temperatuur. Door de molariteitsverhouding tot het volume in de ideale gasvergelijking te vervangen, kan de druk van een ideaalgas worden uitgedrukt in termen van zijn molaire concentratie. Op deze manier kunnen de individuele partiële drukken in de uitdrukking voor Kp worden vervangen door het concentratie-equivalent van elk gas.De stoichiometrische coëfficiënten blijven ongewijzigd. In de gemodificeerde uitdrukking van Kp kan de verhouding van de concentratie van de producten tot de concentratie van reactanten worden vervangen door Kc.Deze vergelijking geeft de relatie tussen de twee constanten Kp is gelijk aan Kc maal RT verhoogd tot de som van de coëfficiënten van de producten min de som van de coëfficiënten van de reactanten. Het verschil tussen de coëfficiënten van gasvormige reactanten en producten kan worden weergegeven als delta n.