14.4:
حساب ثابت التوازن
14.4:
حساب ثابت التوازن
يتم حساب ثابت التوازن للتفاعل من تركيزات التوازن (أو الضغوط) للمواد المتفاعلة ونواتجها. إذا كانت هذه التركيزات معروفة ، فإن الحساب يتضمن ببساطة استبدالها في تعبير Kc .
على سبيل المثال ، يشكل ثاني أكسيد النيتروجين الغازي رباعي أكسيد ثنائي النيتروجين وفقًا لهذه المعادلة:
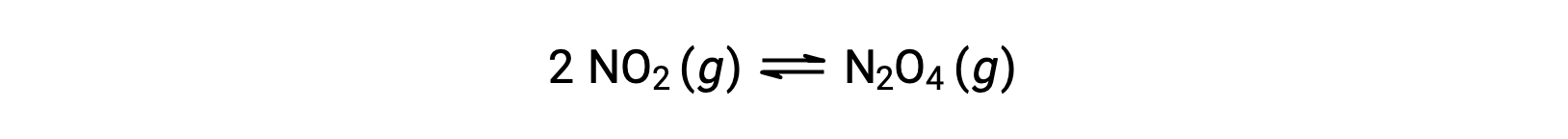
عند إضافة 0.10 مول NO2 إلى دورق سعة 1.0 لتر عند 25 °C، يتغير التركيز بحيث عند التوازن ، [NO2] = 0.016 م و [N2O4] = 0.042 م. يمكن حساب قيمة ثابت التوازن للتفاعل على النحو التالي:
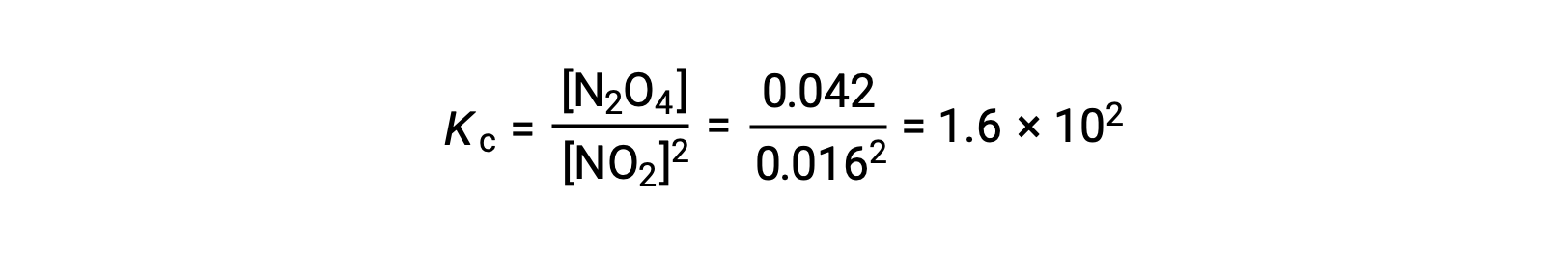
يتم تقديم مثال أكثر تحديًا قليلاً بعد ذلك ، حيث يتم استخدام قياس العناصر المتكافئة للتفاعل لاشتقاق تركيزات التوازن من المعلومات المقدمة. الاستراتيجية الأساسية لهذا الحساب مفيدة للعديد من أنواع حسابات التوازن وتعتمد على استخدام المصطلحات لتركيزات المادة المتفاعلة والمنتج الموجودة في البداية ، وكيفية تغيرها مع تقدم التفاعل ، وما هي عليه عندما يصل النظام إلى التوازن. يستخدم الاختصار ICE بشكل شائع للإشارة إلى هذا النهج الرياضي ، وعادة ما يتم جمع مصطلحات التركيز في تنسيق جدولي يسمى جدول ICE.
حساب ثابت التوازن
تتفاعل جزيئات اليود بشكل عكسي مع أيونات اليود لإنتاج أيونات ثلاثي اليود.

إذا كان الحل بتركيزات I2 و I− كلاهما يساوي 1.000 × 10−3 M قبل التفاعل يعطي تركيز توازن I2 of 6.61 × 10−4 M, ما هو ثابت التوازن للتفاعل؟
لحساب ثوابت التوازن ، هناك حاجة إلى تركيزات التوازن لجميع المواد المتفاعلة والمنتجات:
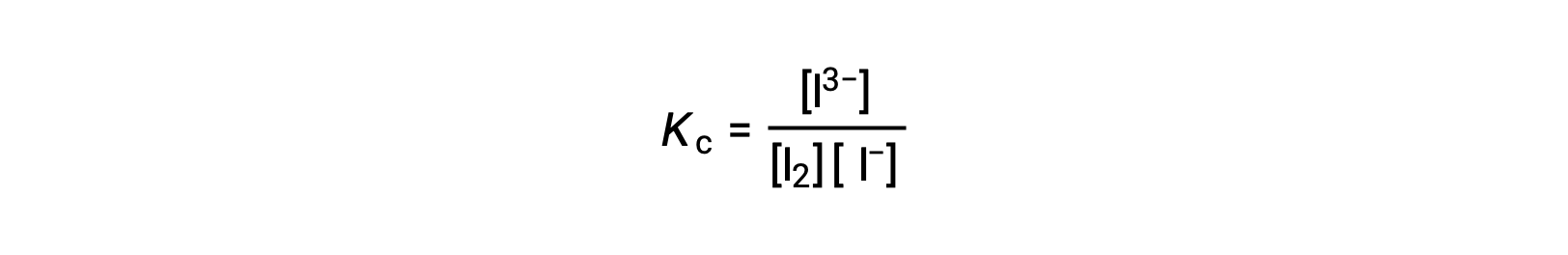
يتم توفير التركيزات الأولية للمواد المتفاعلة وتركيز التوازن للمنتج. يمكن استخدام هذه المعلومات لاشتقاق مصطلحات لتركيزات توازن المواد المتفاعلة ، وتقديم جميع المعلومات في جدول ICE.
| I2 (aq) | I− (aq) | I3− (aq) | |
| Initial Concentration (M) | 1.000 × 10−3 | 1.000 × 10−3 | 0 |
| Change (M) | −x | −x | +x |
| Equilibrium Concentration (M) | 1.000 × 10−3 − x | 1.000 × 10-3 − x | x |
عند التوازن، يكون تركيز I2 هو 6.61 × 10−4 M بحيث يكون

يمكن الآن تحديث جدول ICE بقيم رقمية لكل تركزات الجدول:
| i2 (aq) | I− (aq) | i3− (aq) | |
| التركيز الأولي (M) | 1.000 × 10-3 | 1.000 × 10-3 | 0 |
| تغيير (M) | −3.39 × 10–4 | −3.39 × 10–4 | +3.39 × 10-4 |
| تركيز الاتزان (M) | 6.61 × 10–4 | 6.61 × 10–4 | 3.39 × 10–4 |
وأخيراً، يمكن استبدال تركيزات التوازن في تعبير Kc وحلها:
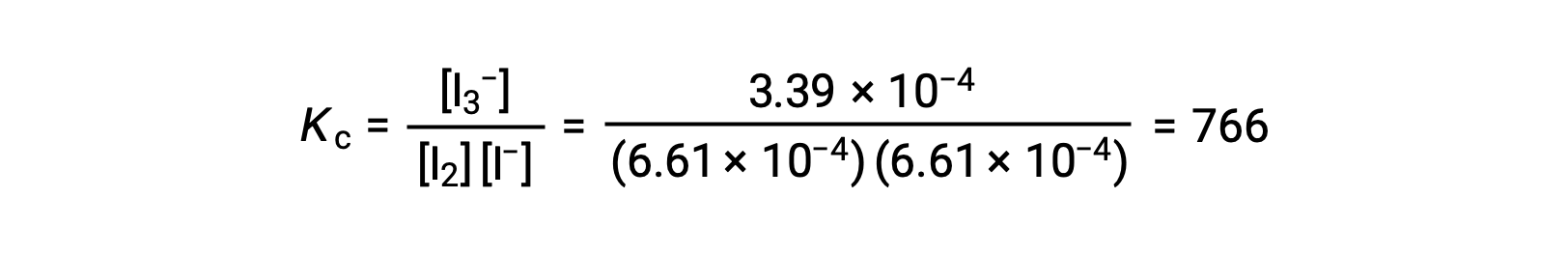
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 13.4 Equilibrium Calculations.
