15.3:
Água: Um Ácido e Base de Bronsted-Lowry
15.3:
Água: Um Ácido e Base de Bronsted-Lowry
A reação entre um ácido de Brønsted-Lowry e água é chamada ionização ácida. Por exemplo, quando o fluoreto de hidrogénio se dissolve em água e ioniza, os protões são transferidos das moléculas de fluoreto de hidrogénio para as moléculas de água, produzindo iões hidrónio e iões fluoreto:
A ionização básica de uma espécie ocorre quando ela aceita protões de moléculas de água. No exemplo abaixo, moléculas de piridina, C5NH5, sofrem ionização básica quando dissolvidas em água, produzindo iões hidróxido e piridínio:
As reações de ionização anteriores sugerem que a água pode funcionar tanto como uma base (como na sua reação com fluoreto de hidrogénio) como um ácido (como na sua reação com amoníaco). As espécies capazes de doar ou aceitar protões são chamadas de anfipróticas, ou mais geralmente, anfotéricas, termo que pode ser usado para ácidos e bases por definições que não a de Brønsted-Lowry. As equações abaixo mostram as duas possíveis reações ácido-base para duas espécies anfipróticas, ião bicarbonato, e água:
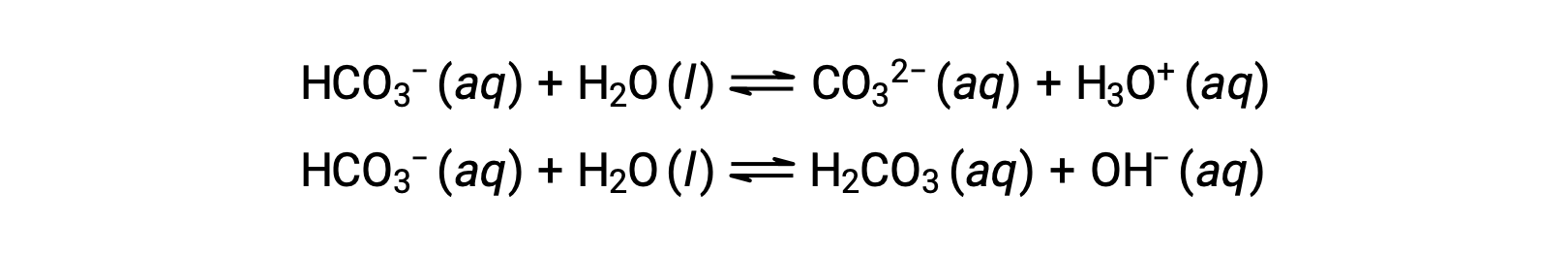
A primeira equação representa a reação do bicarbonato como ácido com água como base, enquanto que a segunda representa a reação de bicarbonato como base com água como ácido. Quando o bicarbonato é adicionado à água, ambos os equilíbrios são estabelecidos simultaneamente e a composição da solução resultante pode ser determinada através de cálculos de equilíbrio adequados. No estado líquido, as moléculas de uma substância anfiprótica podem reagir umas com as outras, conforme ilustrado para a água nas equações abaixo:
O processo no qual moléculas semelhantes reagem aos iões produzidos é chamado de autoionização. A água líquida é submetida a autoionização em uma extensão muito pequena; a 25 °C, aproximadamente duas em cada mil milhões de moléculas de água são ionizadas. A extensão do processo de autoionização da água reflete-se no valor da sua constante de equilíbrio, a constante do produto de iões para a água, KW:
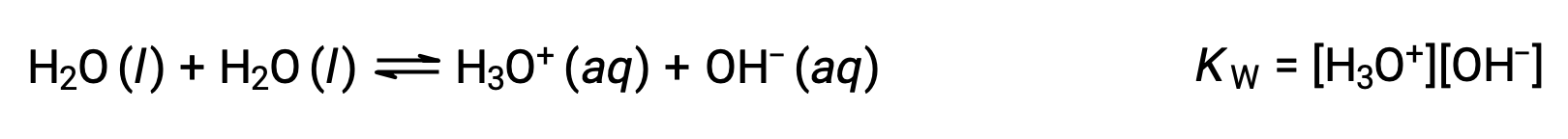
A ligeira ionização da água pura reflete-se no pequeno valor da constante de equilíbrio; a 25 °C, KW tem um valor de 1,0 × 10−14.
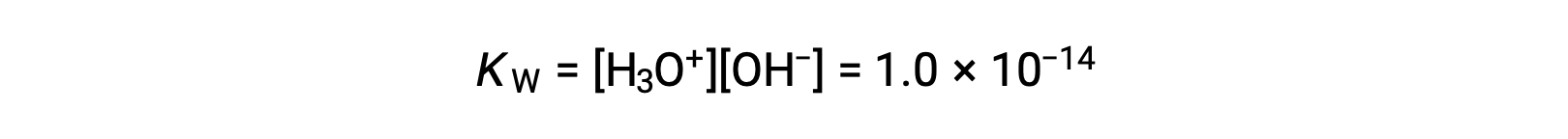
O processo é endotérmico, e assim a extensão da ionização e as concentrações resultantes do ião hidrónio e do ião hidróxido aumentam com a temperatura. Por exemplo, a 100 °C, o valor para KW é cerca de 5,6 × 10−13, aproximadamente 50 vezes maior do que o valor a 25 °C.
A autoionização da água produz o mesmo número de iões hidrónio e hidróxido. Por conseguinte, em água pura a 25 °C:
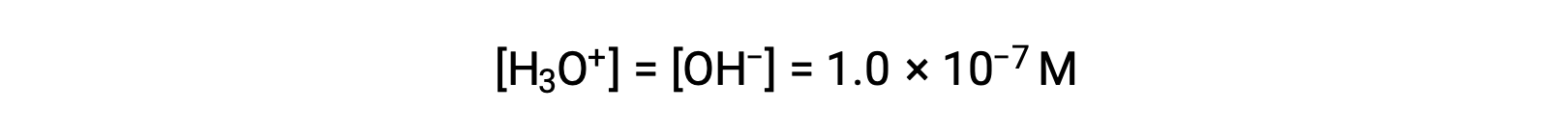
As concentrações desses iões em uma solução são muitas vezes determinantes críticos das propriedades da solução e dos comportamentos químicos dos seus outros solutos, e um vocabulário específico foi desenvolvido para descrever essas concentrações em termos relativos. Uma solução é neutra se contiver concentrações iguais de iões hidrónio e hidróxido; ácida se contiver uma concentração superior de iões hidrónio do que iões hidróxido; e básica se contiver uma concentração inferior de iões hidrónio do que iões hidróxido.
Resumo de Relações para Soluções Ácidas, Básicas, e Neutras
| Classificação | Concentrações Relativas de Iões | pH a 25 °C |
| ácida | [H3O+] > [OH−] | pH < 7 |
| neutra | [H3O+] = [OH−] | pH = 7 |
| básica | [H3O+] < [OH−] | pH > 7 |
Este texto é adaptado de Openstax, Chemistry 2e, Section 14.1: Brønsted-Lowry Acids and Bases, e Section 14.2: pH and pOH.
