15.4:
Scala del pH
15.4:
Scala del pH
Gli ioni idronio e idrossido sono presenti sia in acqua pura che in tutte le soluzioni acquose, e le loro concentrazioni sono inversamente proporzionali come determinato dal prodotto ionico dell’acqua (Kw). Le concentrazioni di questi ioni in una soluzione sono spesso determinanti critici delle proprietà della soluzione e dei comportamenti chimici degli altri soluti. Due diverse soluzioni possono differire nelle loro concentrazioni di ioni idronio o idrossido di un milione, miliardi o addirittura trilioni di volte. Un mezzo comune per esprimere quantità che possono estendersi su molti ordini di grandezza è usare una scala logaritmica. Il pH di una soluzione è quindi definito come mostrato qui, dove [H3O+] è la concentrazione molare di ioni idronio nella soluzione:
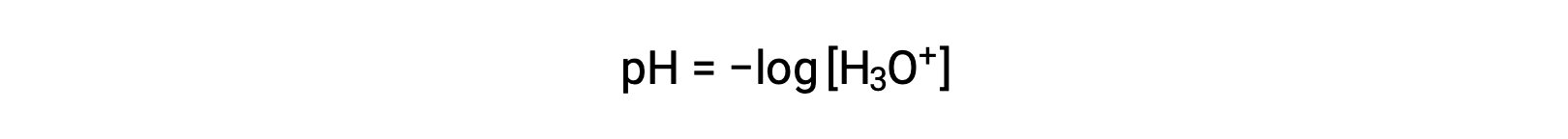
Riordinando questa equazione per isolare la molarità ionica dell’idronio si ottiene l’espressione equivalente:
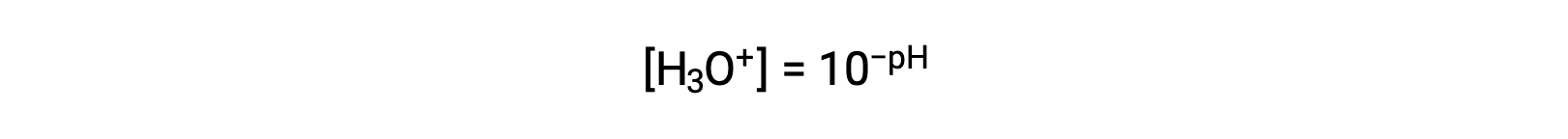
Allo stesso modo, la molarità ionico idrossido può essere espressa come p-funzione o pOH:

O
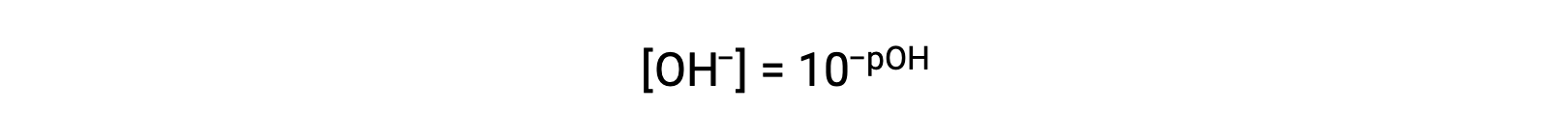
Infine, la relazione tra queste due concentrazione di ioni espressa come funzioni p è facilmente derivata dall’espressione KW:
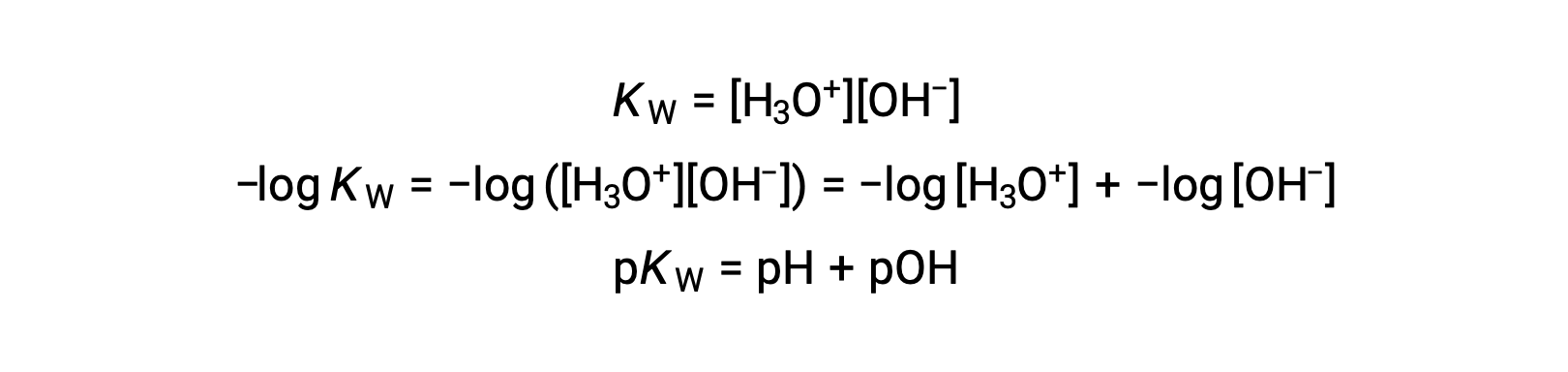
A 25 °C, il valore di KW è 1,0 × 10−14, e così:
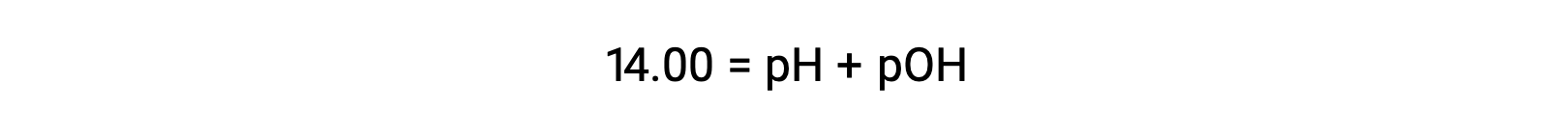
La molarità ionico di idronio in acqua pura (o qualsiasi soluzione neutra) è di 1,0 × 10−7 M a 25 °C. Il pH e il pOH di una soluzione neutra a questa temperatura sono quindi:
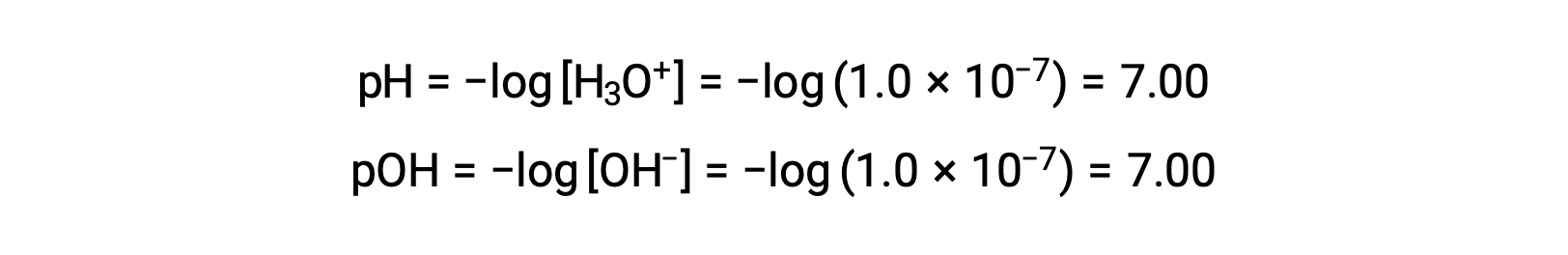
E così, a questa temperatura, le soluzioni acide sono quelle con molarità ioniche di idronio superiori a 1,0 × 10−7 M e molare di ioni idrossido inferiori a 1,0 × 10−7 M (corrispondenti a valori di pH inferiori a 7,00 e valori di pOH superiori a 7,00). Le soluzioni di base sono quelle con molarità ionici di idronio inferiori a 1,0 × 10−7 M e molare di ioni idrossido superiori a 1,0 × 10−7 M (corrispondenti a valori di pH superiori a 7,00 e valori di pOH inferiori a 7,00).
Poiché la costante di autoionizzazione KW dipende dalla temperatura, queste correlazioni tra i valori di pH e gli aggettivi acidi/neutri/di base saranno diverse a temperature diverse da 25 °C. Ad esempio, la molarità dell’idronio dell’acqua pura a 80°C è di 4,9 × 10−7 M, che corrisponde ai valori di pH e pOH di:

A questa temperatura, le soluzioni neutre mostrano pH = pOH = 6,31, le soluzioni acide presentano pH inferiore a 6,31 e pOH maggiore di 6,31, mentre le soluzioni di base presentano pH maggiore di 6,31 e pOH inferiore a 6,31. Questa distinzione può essere importante quando si studiano determinati processi che si verificano ad altre temperature, come le reazioni enzimatiche negli organismi a sangue caldo a una temperatura intorno ai 36 – 40 °C. Salvo diversa indicazione, si presume che i riferimenti ai valori di pH siano quelli a 25 °C.
Questo testo è adattato da Openstax, Chemistry 2e, Sezione 14.2: pH e pOH.
Leitura Sugerida
- van Lubeck, Henk. "Why not replace pH and pOH by just one real acidity grade, AG?." Journal of Chemical Education 76, no. 7 (1999): 892. https://pubs.acs.org/doi/pdf/10.1021/ed076p892
