16.1:
Effetto ionico comune
16.1:
Effetto ionico comune
Rispetto all’acqua pura, la solubilità di un composto ionico è minore in soluzioni acquose contenenti uno ione comune (uno prodotto anche dalla dissoluzione del composto ionico). Questo è un esempio di un fenomeno noto come effetto ionico comune, che è una conseguenza della legge dell’azione di massa che può essere spiegata usando il principio di Le Châtelier. Considera la dissoluzione dello ioduro d’argento:
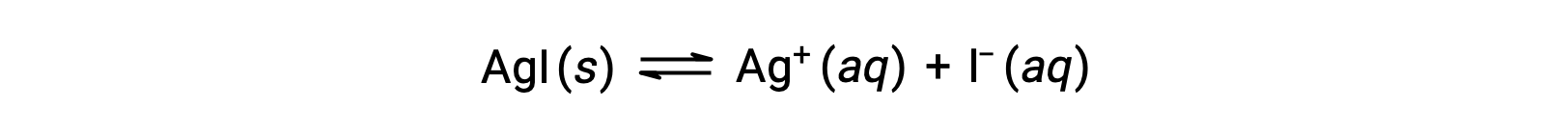
Questo equilibrio di solubilità può essere spostato a sinistra con l’aggiunta di ioni argento(I) o ioduro, con conseguente precipitazione di AgI e concentrazioni abbassate di Ag+ disciolto e I–. Nelle soluzioni che contengono già uno di questi ioni, meno AgI può essere sciolto rispetto alle soluzioni senza questi ioni.
Questo effetto può anche essere spiegato in termini di azione di massa rappresentata nell’espressione del prodotto di solubilità:
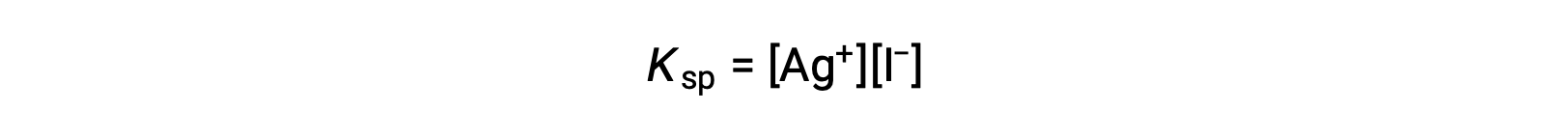
Il prodotto matematico delle molarità degli ioni d’argento(I) e ioduro è costante in una miscela di equilibrio indipendentemente dalla fonte degli ioni, e quindi un aumento della concentrazione di uno ione deve essere bilanciato da una diminuzione proporzionale nell’altro.
Effetto ionico comune sulla solubilità
Lo ione comune influisce sulla solubilità del composto in una soluzione. Ad esempio, gli ioni solidi Mg(OH)2 si dissociano in Mg2+ e OH− ioni come segue;
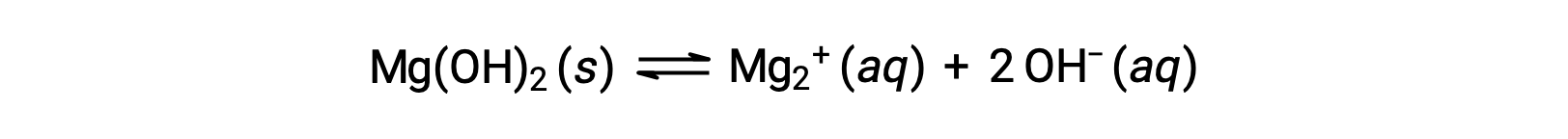
Se MgCl2 viene aggiunto a una soluzione satura di Mg(OH)2, la reazione si sposta a sinistra per alleviare lo stress prodotto dallo ione Mg2+ aggiuntivo, in conformità con il principio di Le Châtelier. In termini quantitativi, l’mg2+ aggiunto fa sì che il quoziente di reazione sia più grande del prodotto di solubilità (Q > Ksp) e Mg(OH)2 si forma fino a quando il quoziente di reazione è di nuovo uguale a Ksp. Al nuovo equilibrio, [OH–] è minore e [Mg2+] è maggiore che nella soluzione di Mg(OH)2 in acqua pura.
Se KOH viene aggiunto a una soluzione satura di Mg(OH)2, la reazione si sposta a sinistra per alleviare lo stress dell’OH– ione aggiuntivo. Mg(OH)2 si forma fino a quando il quoziente di reazione è di nuovo uguale a Ksp. Al nuovo equilibrio, [OH–] è maggiore e [Mg2+] è inferiore rispetto alla soluzione di Mg(OH)2 in acqua pura.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 15.1: Precipitazione e Dissoluzione.
