16.7:
حسابات المعايرة: حمض ضعيف-قاعدة ضعيفة
16.7:
حسابات المعايرة: حمض ضعيف-قاعدة ضعيفة
حساب الرقم الهيدروجيني لحلول المعايرة: حمض ضعيف/قاعدة قوية
لمعايرة 25.00 مل من 0.100 مول CH3CO2H، يمكن تمثيل التفاعل على النحو التالي:
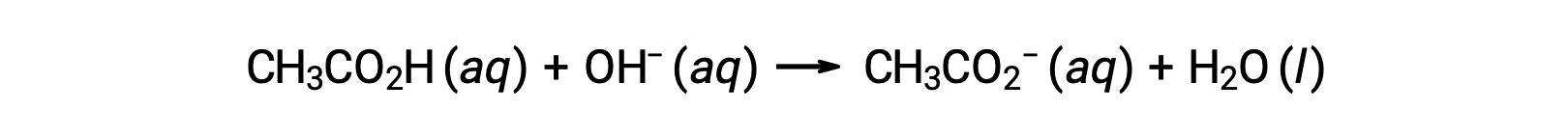
يمكن حساب الرقم الهيدروجيني لمحلول المعايرة بعد إضافة الأحجام المختلفة من معاير NaOH على النحو التالي:
(أ) يتم حساب الأس الهيدروجيني الأولي لمحلول حمض الأسيتيك في نهج ICE المعتاد:
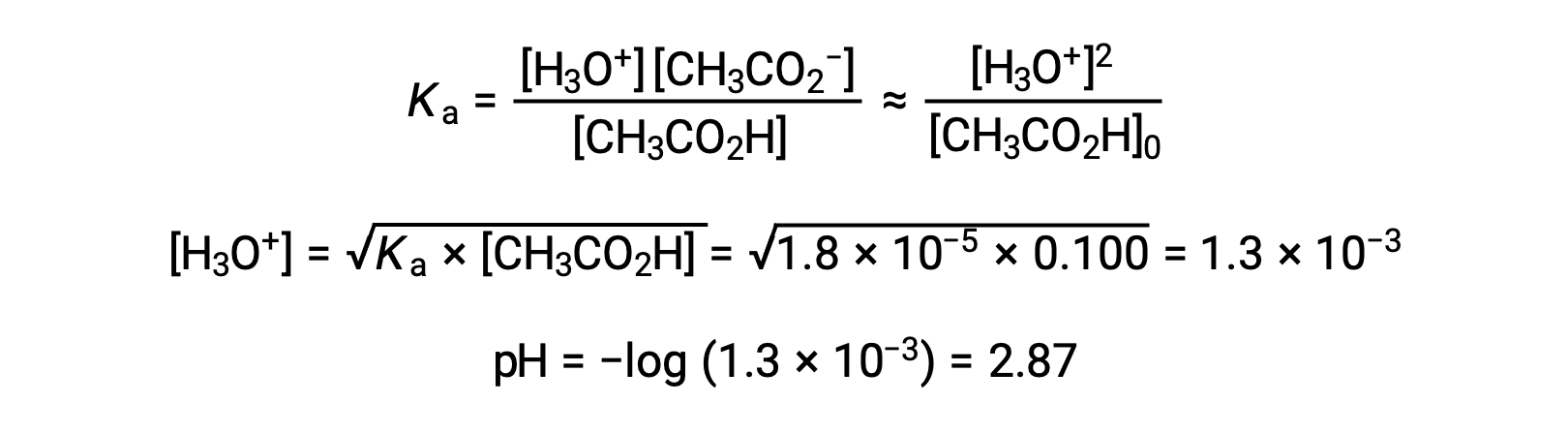
(ب) يعتبر كل من الحمض والمعاير أحادي الخلية والعينة ومحاليل المعايرة مركزة بشكل متساوٍ؛ وبالتالي، يمثل هذا الحجم من المعاير نقطة التكافؤ. على عكس مثال الحمض القوي، يحتوي خليط التفاعل في هذه الحالة على قاعدة مترافقة ضعيفة (أيون الأسيتات). يتم حساب الرقم الهيدروجيني للمحلول مع الأخذ في الاعتبار التأين الأساسي للأسيتات ، والذي يوجد بتركيز
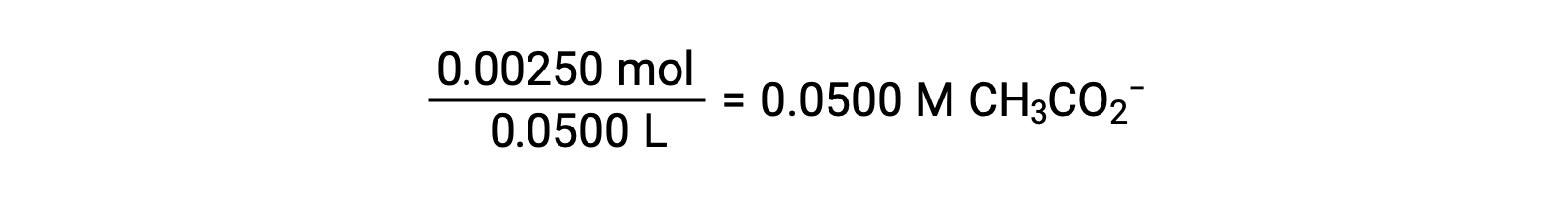
يتم تمثيل التأين الأساسي للأسيتات بالمعادلة
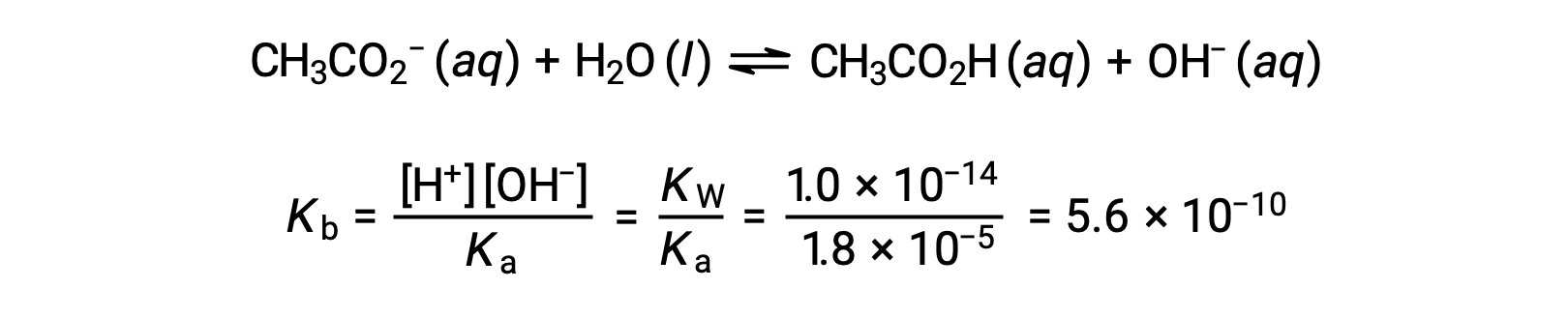
بافتراض x << 0.0500، يمكن حساب الأس الهيدروجيني من خلال نهج ICE المعتاد:
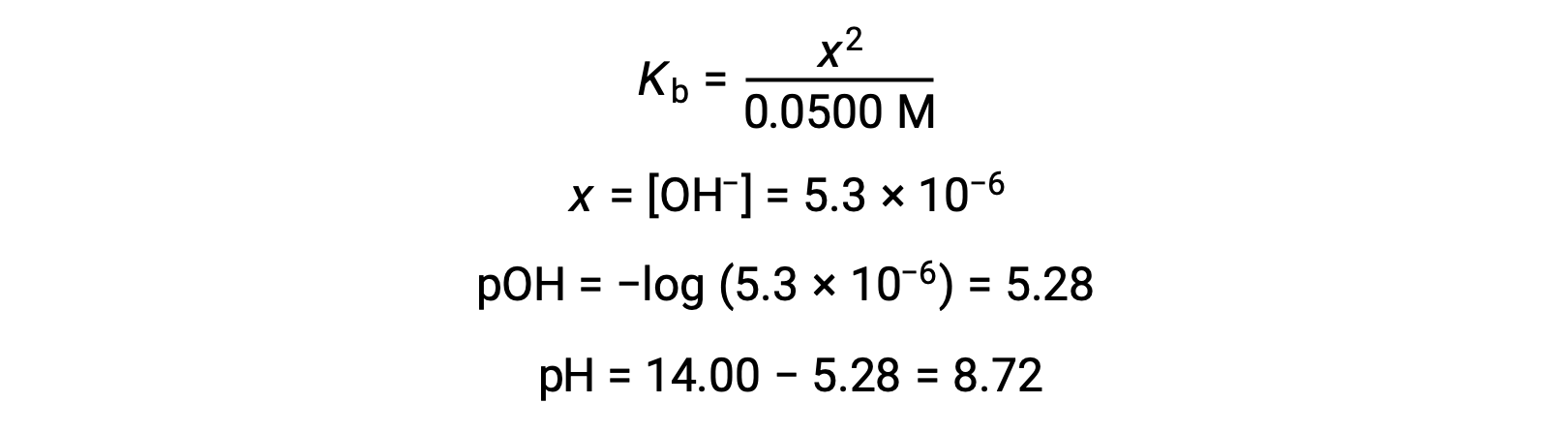
لاحظ أن الرقم الهيدروجيني عند نقطة التكافؤ لهذه المعايرة أكبر بكثير من 7، كما هو متوقع عند معايرة حمض ضعيف بقاعدة قوية.
(ج) حجم المعاير = 12.50 مل. يمثل هذا الحجم نصف كمية القياس المتكافئ للمعايرة، وبالتالي تم تحييد نصف حمض الأسيتيك لإنتاج كمية مكافئة من أيون الأسيتات. وبالتالي، فإن تراكيز تلك الأزواج المتقارنة من حمض-قاعدة متساوية. من الأساليب الملائمة لحساب الرقم الهيدروجيني استخدام معادلة هندرسون-هاسلبالخ:
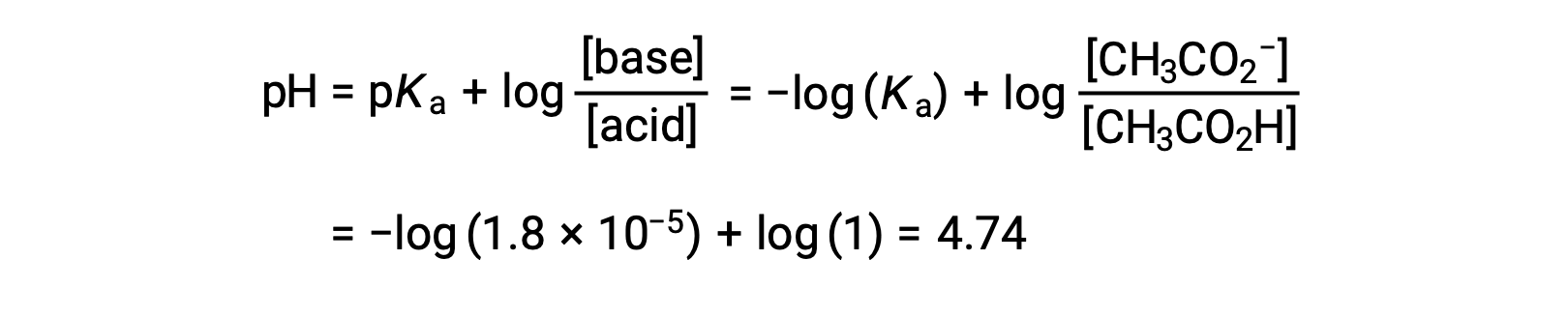
(pH = pKa عند نقطة نصف التكافؤ في معايرة حمض ضعيف)
(د) حجم المعاير = 37.50 مل. يمثل هذا الحجم فائضاً في القياس المتكافئ للمعايرة، ومحلول تفاعل يحتوي على منتج المعايرة، وأيون الأسيتات، والمعايرة القوية الزائدة. في مثل هذه المحاليل، يتم تحديد الرقم الهيدروجيني للمحلول بشكل أساسي من خلال المقدار الزائد من القاعدة القوية:

هذا النص مقتبس من Openstax, Chemistry 2e, Section 14.7: Acid-base Titrations.
