16.11:
Fattori che influenzano la solubilità
16.11:
Fattori che influenzano la solubilità
Rispetto all’acqua pura, la solubilità di un composto ionico è minore in soluzioni acquose contenenti uno ione comune (uno prodotto anche dalla dissoluzione del composto ionico). Questo è un esempio di un fenomeno noto come effetto ionico comune, che è una conseguenza della legge dell’azione di massa che può essere spiegata usando il principio di Le Chȃtelier. Considera la dissoluzione dello ioduro d’argento:
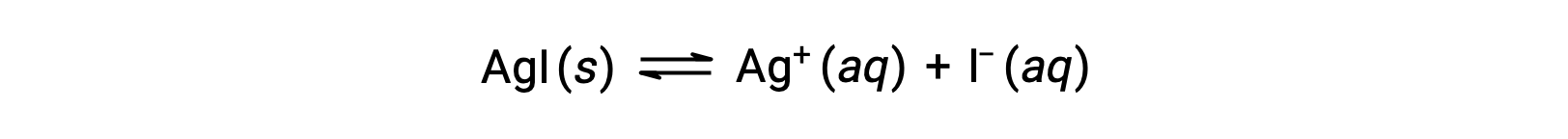
Questo equilibrio di solubilità può essere spostato a sinistra con l’aggiunta di ioni argento o ioduro, con conseguente precipitazione di AgI e concentrazioni abbassate di Ag+ e I–. Nelle soluzioni che contengono già uno di questi ioni, meno AgI può essere sciolto rispetto alle soluzioni senza questi ioni.
Questo effetto può anche essere spiegato in termini di azione di massa rappresentata nell’espressione del prodotto di solubilità:
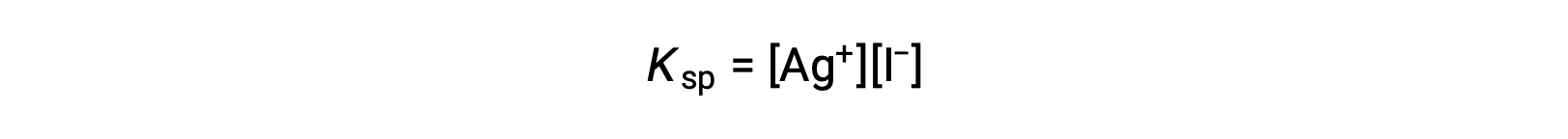
Il prodotto matematico delle molarità dell’argento e dello ione ioduro è costante in una miscela di equilibrio indipendentemente dalla fonte degli ioni, e quindi un aumento della concentrazione di uno ione deve essere bilanciato da una diminuzione proporzionale nell’altro.
Il ruolo delle precipitazioni nel trattamento delle acque reflue
Gli equilibri di solubilità sono strumenti utili per il trattamento delle acque reflue effettuate in impianti che possono trattare l’acqua comunale in una città o in una città. In particolare, le precipitazioni selettive vengono utilizzate per rimuovere i contaminanti dalle acque reflue prima che vengono rilasciati di nuovo nei corpi idrici naturali. Ad esempio, gli ioni fosfati (PO43−) sono spesso presenti nell’acqua scaricata dagli impianti di produzione. Un’abbondanza di fosfato fa crescere le alghe in eccesso, il che influisce sulla quantità di ossigeno disponibile per la vita marina e rende l’acqua inadatta al consumo umano.
Un modo comune per rimuovere i fosfati dall’acqua è l’aggiunta di idrossido di calcio, o calce, Ca(OH)2. Man mano che l’acqua è resa più basilare, gli ioni di calcio reagiscono con ioni fosfati per produrre idrossilapatite, Ca5(PO4)3· OH, che poi precipita fuori dalla soluzione:
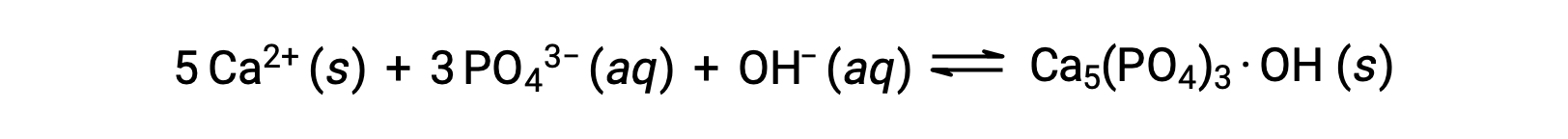
Poiché la quantità di ioni di calcio aggiunti non si traducono nel superamento dei prodotti di solubilità per altri sali di calcio, gli anioni di tali sali rimangono indietro nelle acque reflue. Il precipitato viene quindi rimosso per filtrazione e l’acqua viene riportato a un pH neutro con l’aggiunta di CO2 in un processo di ricarbonizzazione. Altre sostanze chimiche possono anche essere utilizzate per la rimozione dei fosfati mediante precipitazione, tra cui cloruro di ferro(III) e solfato di alluminio.
Questo testo è adattato da Openstax, Chemistry 2e, Section 15.1: Precipitation and Dissolution.
Leitura Sugerida
- Koubek, E. "Demonstration of the Common Ion Effect." Journal of chemical education 70, no. 2 (1993): 155.
- Amaral, L. F., I. R. Oliveira, R. Salomão, E. Frollini, and V. C. Pandolfelli. "Temperature and common-ion effect on magnesium oxide (MgO) hydration." Ceramics International 36, no. 3 (2010): 1047-1054.
- Cassens, Jan, Anke Prudic, Feelly Ruether, and Gabriele Sadowski. "Solubility of pharmaceuticals and their salts as a function of pH." Industrial & Engineering Chemistry Research 52, no. 7 (2013): 2721-2731.
