17.3:
القانون الثاني للديناميكا الحرارية
17.3:
القانون الثاني للديناميكا الحرارية
في السعي لتحديد خاصية قد تتنبأ بشكل موثوق بتلقائية العملية، تم تحديد مرشح واعد: الإنتروبيا. غالبًا ما تكون العمليات التي تتضمن زيادة في إنتروبيا النظام (ΔS > 0) تلقائية؛ ومع ذلك، فإن الأمثلة على عكس ذلك وفيرة. من خلال توسيع النظر في تغييرات الانتروبيا لتشمل المناطق المحيطة، يمكن الوصول إلى نتيجة مهمة تتعلق بالعلاقة بين هذه الخاصية والعفوية. في النماذج الديناميكية الحرارية ، يشتمل النظام والبيئة المحيطة على كل شيء، أي الكون ، وبالتالي فإن ما يلي صحيح:

لتوضيح هذه العلاقة ، ضع في اعتبارك مرة أخرى عملية تدفق الحرارة بين كائنين ، أحدهما محدد على أنه النظام والآخر على أنه محيط. هناك ثلاثة احتمالات لمثل هذه العملية:
- درجات حرارة الأجسام مختلفة ، وتتدفق الحرارة من الجسم الأكثر سخونة إلى الجسم الأكثر برودة. يُلاحظ دائمًا أن هذا يحدث تلقائيًا. تعيين الكائن الأكثر سخونة كنظام واستدعاء تعريف الانتروبيا ينتج عنه ما يلي:
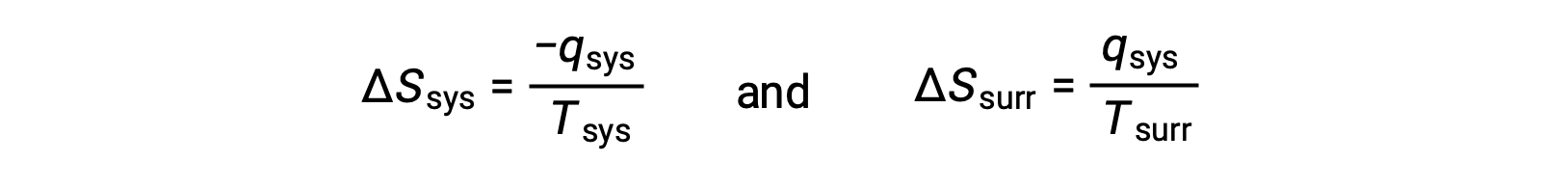
The magnitudes of −qsys and qsys متساويان، تشير علاماتهما الحسابية المعاكسة إلى فقدان الحرارة من قبل النظام واكتساب الحرارة من المناطق المحيطة. بما أن Tsys > Tمحيط في هذا السيناريو، فإن انخفاض الانتروبيا في النظام سيكون أقل من زيادة إنتروبيا البيئة المحيطة، وهكذا تزداد إنتروبيا الكون:
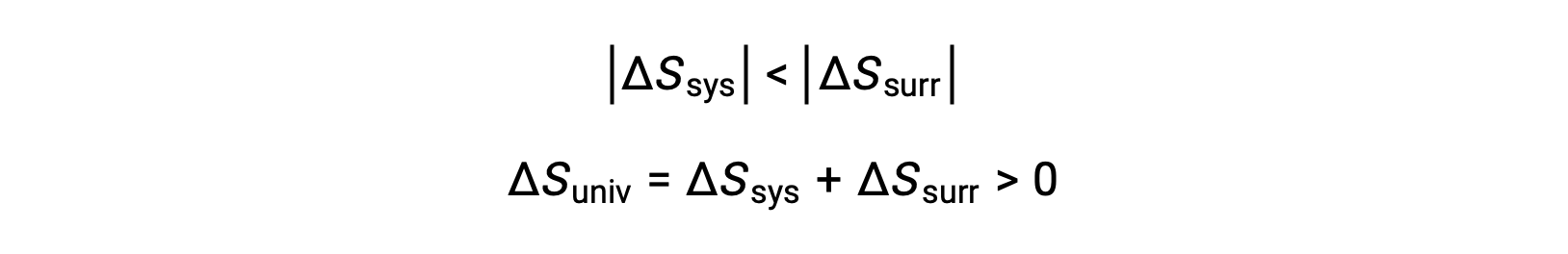
- تكون الأجسام في درجات حرارة مختلفة ، وتتدفق الحرارة من المبرد إلى الجسم الأكثر سخونة. لا يحدث هذا مطلقًا بشكل تلقائي. مرة أخرى ، يؤدي تعيين الكائن الأكثر سخونة على أنه النظام واستدعاء تعريف الانتروبيا إلى ما يلي:
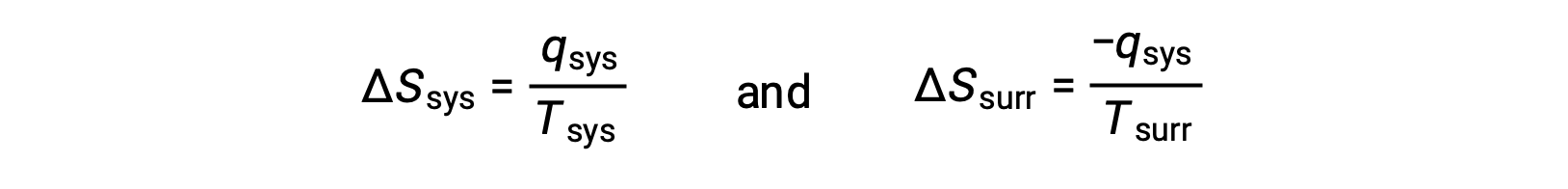
العلامات الحسابية لـ qsys تشير إلى اكتساب النظام للحرارة وفقدان الحرارة من المناطق المحيطة. سيكون حجم التغير في الانتروبيا في المناطق المحيطة أكبر مرة أخرى من حجم النظام ، ولكن في هذه الحالة، ستنتج علامات تغير الحرارة (أي ، اتجاه تدفق الحرارة) قيمة سالبة لـ ΔSكون تتضمن هذه العملية انخفاضًا في إنتروبيا الكون.
- تكون الكائنات في الأساس في نفس درجة الحرارة ، Tsys ≈ Tمحيط، وبالتالي فإن مقادير الانتروبيا تتغير بشكل أساسي لكل من النظام والمناطق المحيطة. في هذه الحالة ، تغير الكون في الكون هو صفر ، والنظام في حالة توازن .
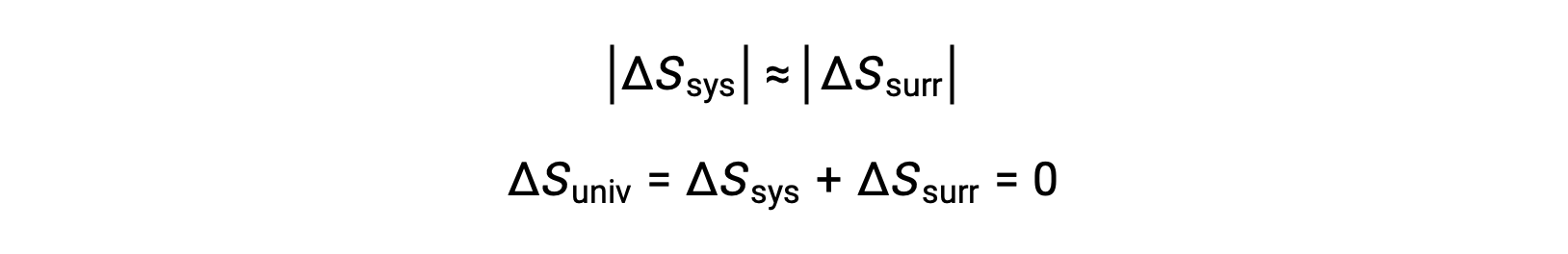
تؤدي هذه النتائج إلى بيان عميق فيما يتعلق بالعلاقة بين الانتروبيا والعفوية المعروفة باسم القانون الثاني للديناميكا الحرارية: كل التغييرات العفوية تسبب زيادة في إنتروبيا الكون. ملخص لهذه الثلاثة يتم توفير العلاقات في الجدول أدناه.
| القانون الثاني في الديناميك الحراري | |
| ΔSuniv > 0 | عفوي |
| ΔSuniv < 0 | غير عفوي (عفوياً في الاتجاه المعاكس) |
| ΔSuniv = 0 | at توازن |
بالنسبة للعديد من التطبيقات الواقعية، تكون المناطق المحيطة شاسعة مقارنة بالنظام. في مثل هذه الحالات، فإن الحرارة التي تكتسبها البيئة المحيطة أو تفقدها نتيجة لبعض العمليات تمثل جزءًا صغيرًا جدًا، شبه متناهي الصغر، من إجمالي طاقتها الحرارية. على سبيل المثال، يتضمن احتراق الوقود في الهواء نقل الحرارة من نظام (جزيئات الوقود والأكسجين التي تخضع للتفاعل) إلى محيط أكثر ضخامة بشكل لا نهائي (الغلاف الجوي للأرض’). ونتيجة لذلك، فإن qمحيط هو تقريب جيد لـ qنظام، ويمكن ذكر القانون الثاني على أنه ما يلي:
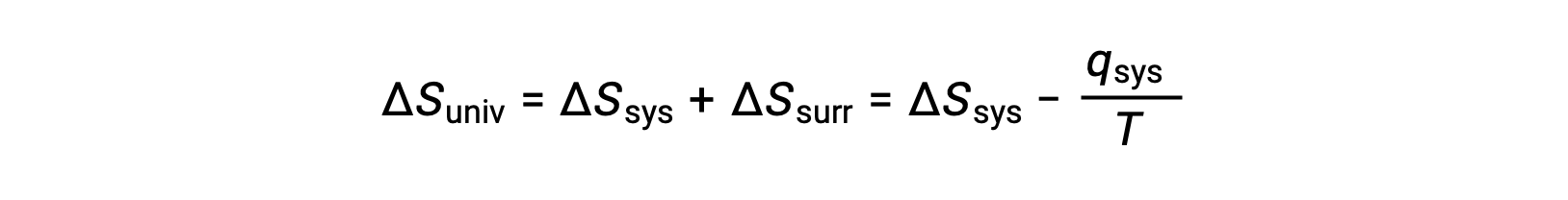
هذه المعادلة مفيدة للتنبؤ بعفوية العملية.
هذا النص مقتبس من Openstax, Chemistry 2e, Chapter 16.2: The Second and Third Law of Thermodynamics.
