17.5:
Modifica dell'entropia standard per una reazione
17.5:
Modifica dell'entropia standard per una reazione
L’entropia è una funzione di stato, quindi il cambiamento di entropia standard per una reazione chimica (ΔS°rxn) può essere calcolato dalla differenza nell’entropia standard tra i prodotti e i reagenti.
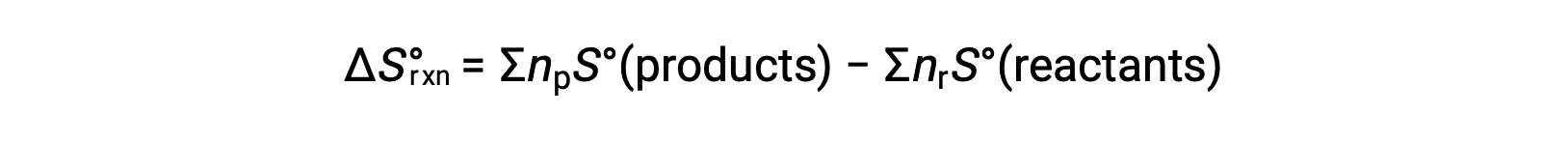
dove np e nr rappresentano rispettivamente i coefficienti stechiometrici nell’equazione bilanciata dei prodotti e dei reagenti.
Ad esempio, ΔS°rxn per la seguente reazione a temperatura ambiente
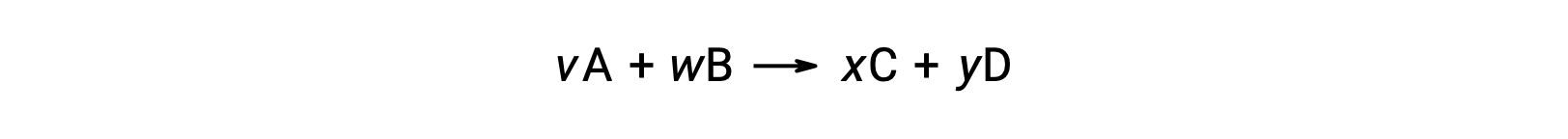
è calcolato come segue:
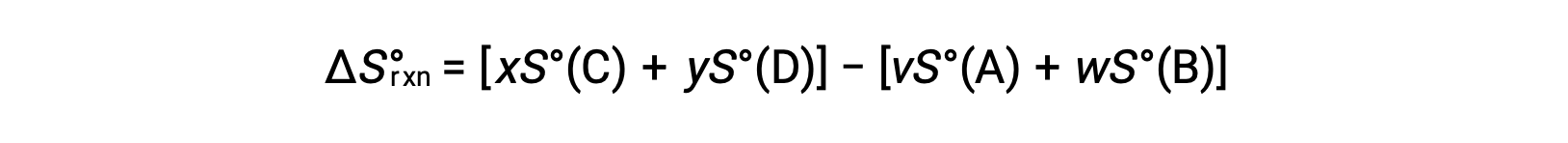
Nella tabella è disponibile un elenco parziale delle entropie standard.
| Sostanza | S° (J/mol· K) La commissione per l’ |
| C (s, grafite) | 5.740 |
| C (s, diamante) | 2.38 |
| CO (g) | 197.7 |
| CO2 (g) | 213.8 |
| CH4 (g) | 186.3 |
| C2H4 (g) | 219.5 |
| C2H6 (g) | 229.5 |
| CH3OH (l) | 126.8 |
| C2H5OH (l) | 160.7 |
| H2 (g) | 130.57 |
| H (g) | 114.6 |
| H2O (g) | 188.71 |
| H2O (l) | 69.91 |
| HCI (g) | 186.8 |
| H2S (g) | 205.7 |
| O2 (g) | 205.03 |
Determinazione di ΔS°
Si consideri la condensa dell’acqua, in cui 1 talpa di H2O gassoso si trasforma in 1 talpa di liquido H2O.
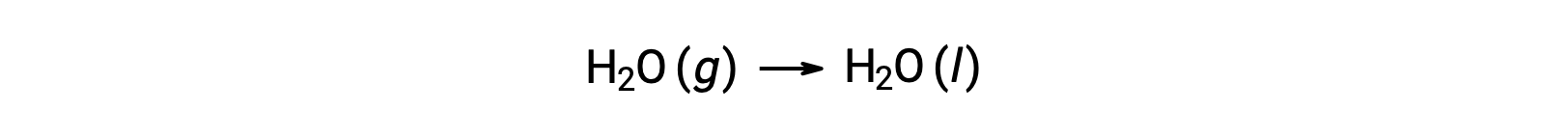
L’entropia standard cambia per la reazione, ΔS°rxn è calcolato usando le entropie molare standard e i coefficienti stechiometrici.
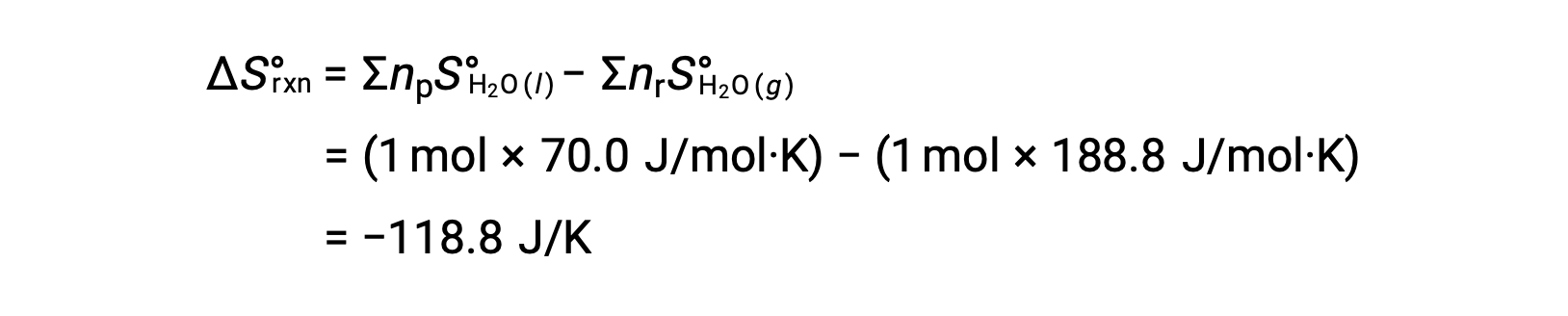
Il valore di ΔS°rxn è negativo, come previsto per questa transizione di fase (condensa).
Come secondo esempio, si consideri la combustione del metanolo, CH3OH:
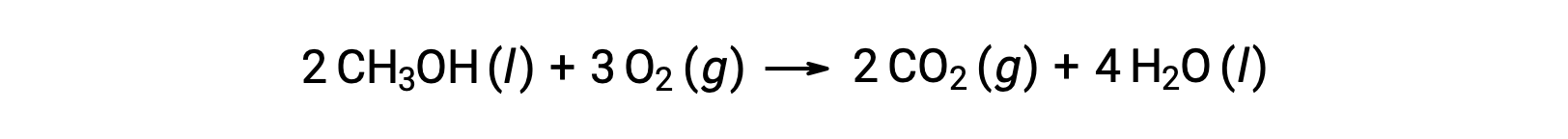
La stessa procedura viene seguita per calcolare il cambiamento di entropia standard della reazione:
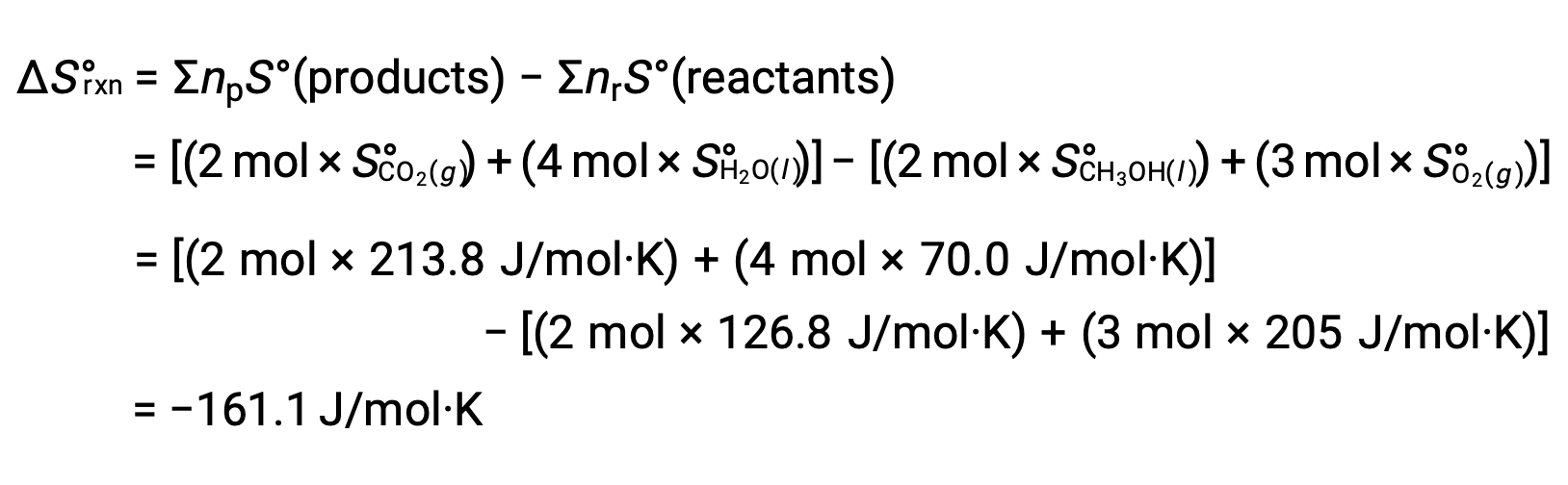
Questo testo è adattato da Openstax, Chimica 2e, Capitolo 16.2: La seconda e terza legge della termodinamica.
