17.6:
طاقة جيبس الحرّة
17.6:
طاقة جيبس الحرّة
إن أحد تحديات استخدام القانون الثاني للديناميكا الحرارية لتحديد ما إذا كانت العملية تلقائية هو أنها تتطلب قياسات تغير الانتروبيا للنظام و تغير الكون المحيط. تم تقديم نهج بديل يتضمن خاصية ديناميكية حرارية جديدة محددة من حيث خصائص النظام فقط في أواخر القرن التاسع عشر بواسطة عالم الرياضيات الأمريكي جوشيا ويلارد جيبس. هذه الخاصية الجديدة تسمى طاقة جيبس الحرة (G) (أو ببساطة الطاقة الحرة) ، ويتم تعريفها من حيث المحتوى الحراري والإنتروبيا للنظام على النحو التالي:
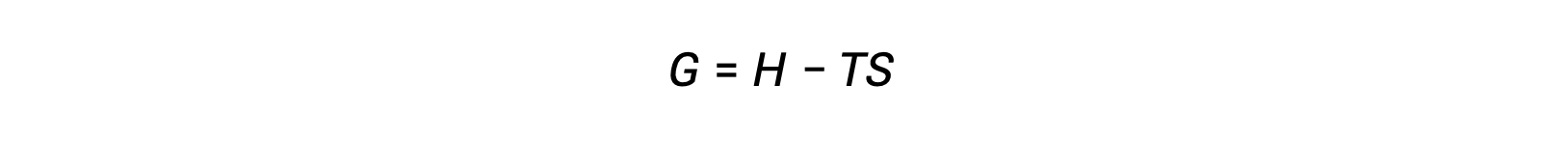
الطاقة الحرة هي إحدى وظائف الحالة، وعند درجة حرارة وضغط ثابتين، يمكن التعبير عن تغير الطاقة الحرة (ΔG) على النحو التالي:

يمكن فهم العلاقة بين خاصية النظام هذه وعفوية العملية من خلال التذكير بتعبير القانون الثاني المشتق سابقًا:
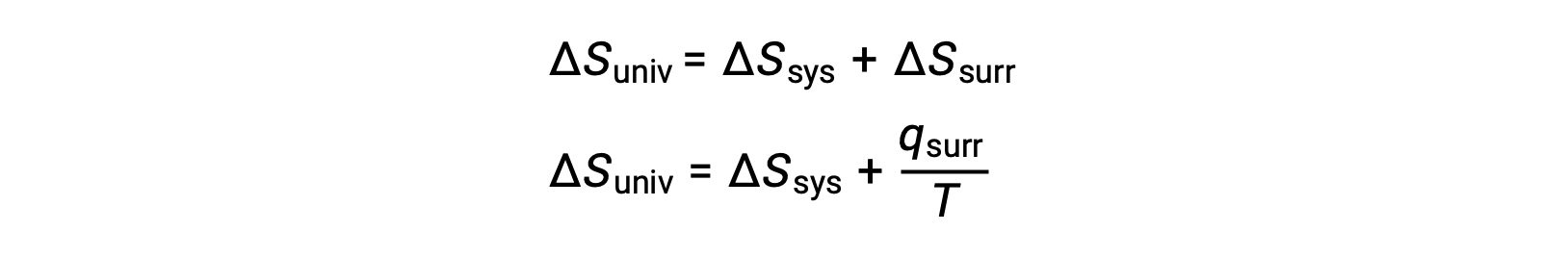
يتطلب القانون الأول أن qمحيط = −qنظام، وعند ضغط ثابت qمحيط = ΔH، لذلك يمكن إعادة كتابة هذا التعبير على النحو التالي:
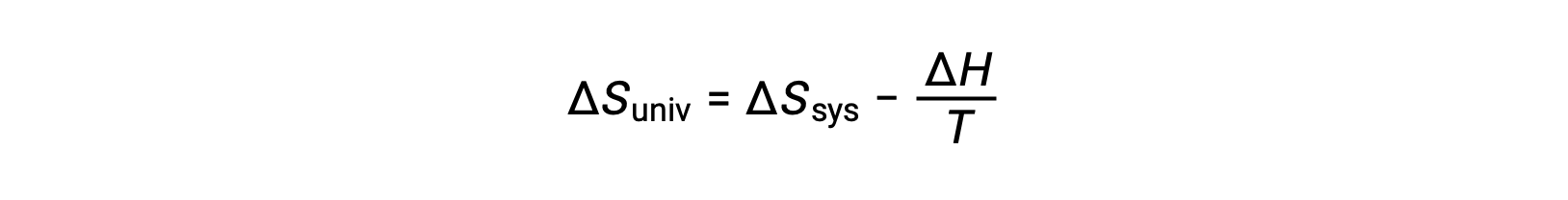
يؤدي ضرب طرفي هذه المعادلة في −T وإعادة الترتيب إلى النتائج التالية:
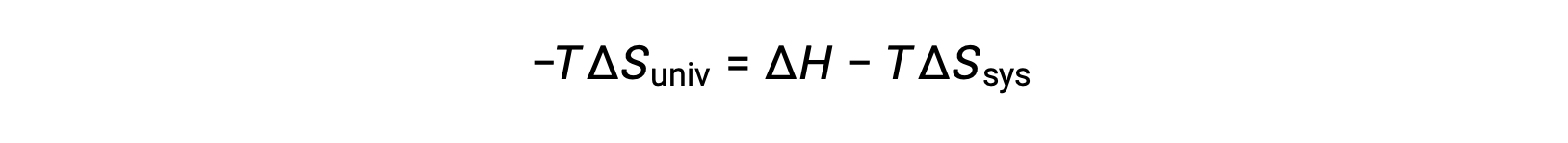
من أجل البساطة، فإن الرمز السفلي “نظام” يمكن حذفه، ويصبح التعبير
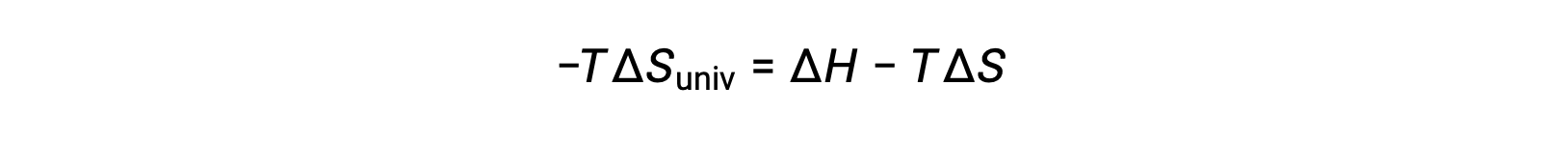
توضح مقارنة هذه المعادلة بالمعادلة السابقة لتغيير الطاقة الحرة العلاقة التالية:
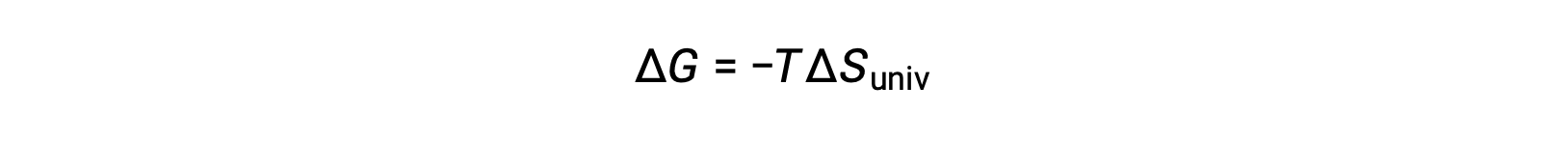
يعد تغيير الطاقة الحرة، بالتالي، مؤشرًا موثوقًا به لعفوية العملية، حيث إنه مرتبط مباشرة بمؤشر العفوية المحدد مسبقًا، ΔSكون.
If ΔSكون > 0, ΔG < 0 فالتفاعل تلقائي.
إذا ΔSكون < 0, ΔG > 0 فالتفاعل غير تلقائي.
إذا ΔSكون = 0, ΔG = 0 فالتفاعل في حالة توازن.
هذا النص مقتبس من Openstax, Chemistry 2e, Chapter 16.4: Free Energy.
