17.7:
تأثيرات درجة الحرارة على الطاقة الحرة
17.7:
تأثيرات درجة الحرارة على الطاقة الحرة
تعتمد عفوية العملية على درجة حرارة النظام. على سبيل المثال ، سوف تستمر انتقالات الطور تلقائيًا في اتجاه أو آخر اعتمادًا على درجة حرارة المادة المعنية. وبالمثل ، يمكن أن تظهر بعض التفاعلات الكيميائية أيضًا العفوية المعتمدة على درجة الحرارة. لتوضيح هذا المفهوم ، يتم النظر في المعادلة المتعلقة بتغيير الطاقة الحرة إلى تغيرات المحتوى الحراري والنتروبيا للعملية:
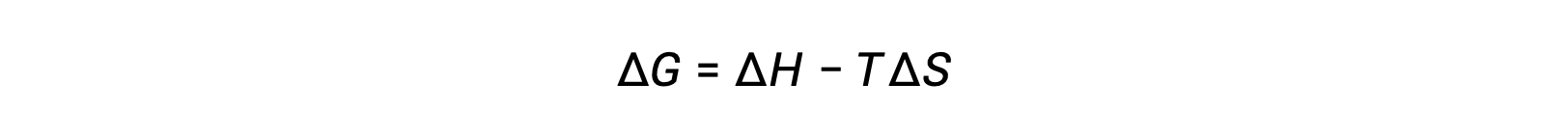
يتم بعد ذلك تحديد عفوية العملية ، كما تنعكس في العلامة الحسابية لتغير طاقتها الحرة ، من خلال علامات تغيرات المحتوى الحراري والإنتروبيا ، وفي بعض الحالات درجة الحرارة المطلقة. نظرًا لأن T هي درجة الحرارة المطلقة (كلفن) ، فلا يمكن أن يكون لها سوى قيم موجبة. لذلك ، توجد أربعة احتمالات فيما يتعلق بعلامات تغيرات المحتوى الحراري والانتروبيا:
- كل من ΔH و ΔS هما موجبان. تصف هذه الحالة عملية ماصة للحرارة تتضمن زيادة في نظام إنتروبيا. في هذه الحالة ، ستكون ΔG سالبة إذا كان حجم المصطلح TΔS أكبر من ΔH. إذا كان المصطلح TΔS أقل من ΔH، فسيكون تغيير الطاقة الحرة موجبًا. هذه العملية تلقائية في درجات حرارة عالية وغير تلقائية في درجات حرارة منخفضة.
- كل من ΔH و ΔS سلبيان. يصف هذا الشرط عملية طاردة للحرارة تتضمن تقليلًا في نظام إنتروبيا. في هذه الحالة ، ستكونΔG سالبة إذا كان حجم المصطلح TΔS أقل من ΔH. إذا كان حجم المصطلح’ TΔS أكبر من ΔH، فسيكون تغيير الطاقة الحرة إيجابي. هذه العملية تلقائية في درجات حرارة منخفضة وغير تلقائية في درجات حرارة عالية.
- إذا كان ΔH موجب و ΔS سالب. يصف هذا الشرط عملية ماصة للحرارة تتضمن انخفاض في إنتروبيا النظام. في هذه الحالة، ستكون قيمة ΔG موجبة بغض النظر عن درجة الحرارة. هذه العملية غير تلقائية في جميع درجات الحرارة.
- إذا كان ΔH سلبي و ΔS إيجابي. يصف هذا الشرط عملية طاردة للحرارة تتضمن زيادة في إنتروبيا النظام. في هذه الحالة، ΔG ستكون سالبة بغض النظر عن درجة الحرارة. هذه العملية تلقائية في جميع درجات الحرارة.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 16.4: Free Energy.
