20.10:
الألوان والمغناطيسية
20.10:
الألوان والمغناطيسية
اللون في مركبات التنسيق
عندما تمتص الذرات أو الجزيئات الضوء بالتردد المناسب، تُثار إلكتروناتها في مدارات ذات طاقة أعلى. بالنسبة للعديد من الذرات والجزيئات الرئيسية، تكون الفوتونات الممتصة في نطاق الأشعة فوق البنفسجية من الطيف الكهرومغناطيسي، والذي لا يمكن اكتشافه بالعين البشرية. بالنسبة لمركبات التنسيق، فإن فرق الطاقة بين المدارات d غالباً ما يسمح بامتصاص وانبعاث الفوتونات في النطاق المرئي، والذي تراه العين البشرية على أنه ألوان.
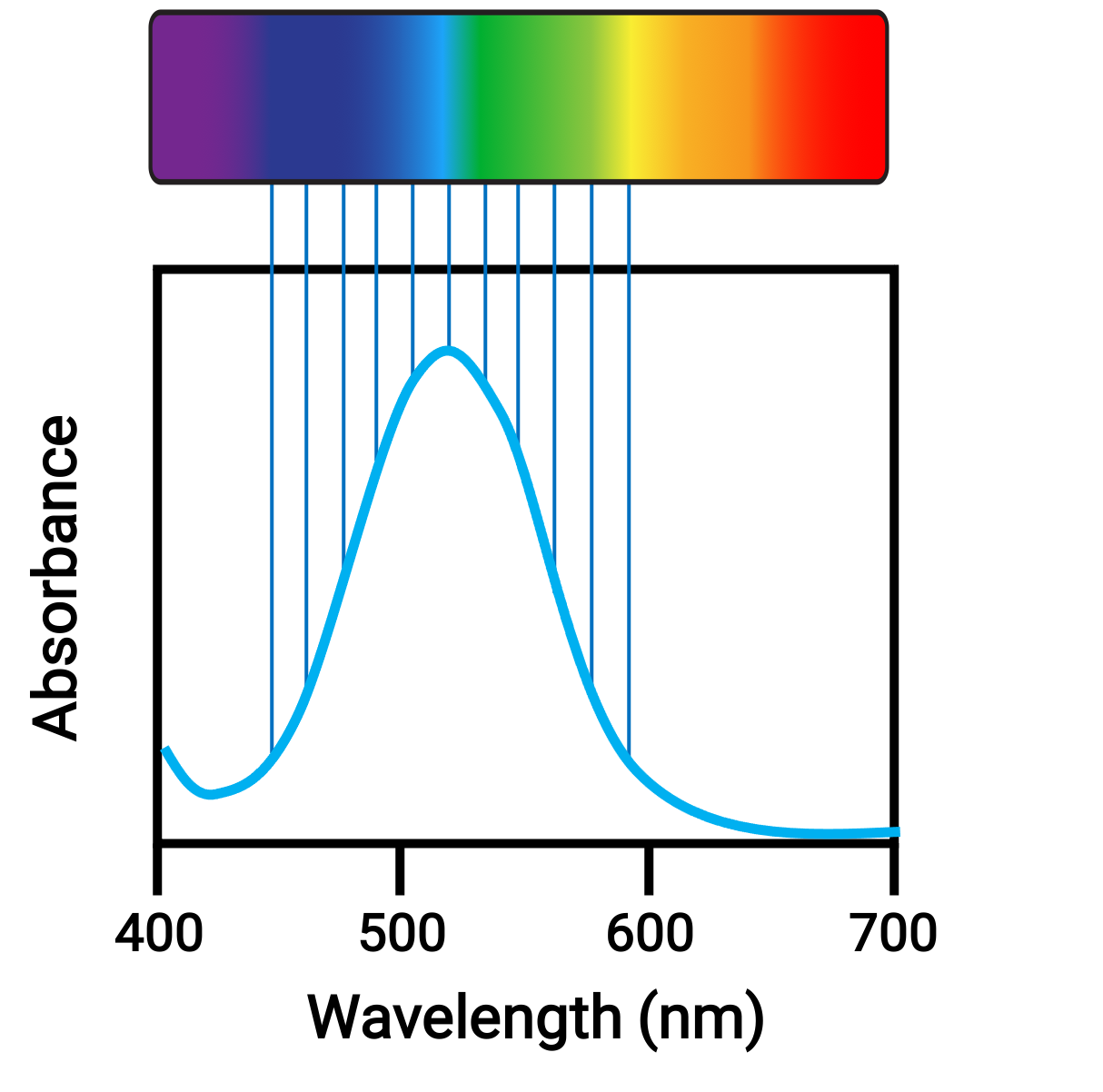
الشكل 1. الطيف الكهرومغناطيسي للضوء المرئي والامتصاص.
يمكن أن تؤدي التغييرات الصغيرة في الطاقات النسبية للمدارات التي تنتقل الإلكترونات بينها إلى تحولات جذرية في لون الضوء الممتص. لذلك فإن ألوان مركبات التنسيق تعتمد على العديد من العوامل مثل:
• يمكن أن يكون للأيونات المعدنية المائية المختلفة ألوان مختلفة.
• حالات الأكسدة المختلفة لمعدن واحد يمكن أن تنتج ألواناً مختلفة.
• تؤثر ربيطات تنسيقية محدّدة مع المركز المعدني على لون مركبات التنسيق. على سبيل المثال، يظهر مركب الحديد (II) [Fe(H2O)6]SO4 باللون الأزرق المخضر لأن الدوران العالي للمركب يمتص الفوتونات في الأطوال الموجية الحمراء. في المقابل، يظهر مركب الحديد (II) منخفض الدوران K4[Fe(CN)6] لوناً أصفر شاحب لأنه يمتص فوتونات بنفسجية عالية الطاقة.
بشكل عام، تسبب ربيطات المجال القوي انقساماً كبيراً في مدارات d لذرة المعدن المركزية (كبير Δ). تكون مركبات تنسيق المعادن الانتقالية مع هذه الروابط صفراء أو برتقالية أو حمراء لأنها تمتص طاقة أعلى من الضوء البنفسجي أو الأزرق.
من ناحية أخرى، غالباً ما تكون مركبات التنسيق للمعادن الانتقالية ذات ربيطات المجال الضعيف هي الأزرق والأخضر أو الأزرق أو النيلي لأنها تمتص الضوء الأصفر أو البرتقالي أو الأحمر ذي الطاقة المنخفضة. يتم وضع قوة الربيطات لتقسيم مدارات d في السلسلة الطيفية. هنا تتم كتابة الربيطات في القيمة المتزايدة لطاقة تقسيم المجال البلوري (Δ).

الشكل 2. سلسلة الطيف الكيميائي.
على سبيل المثال، يحتوي مركب التنسيق لأيون Cu+ ion على تكوين d10 وجميع مدارات eg تكون مملوءة. لإثارة إلكترون إلى مستوى أعلى، مثل المدار 4p، يلزم وجود فوتونات ذات طاقة عالية جداً. تتوافق هذه الطاقة مع أطوال موجية قصيرة جداً في منطقة الأشعة فوق البنفسجية من الطيف. لا يتم امتصاص الضوء المرئي، لذلك لا ترى العين أي تغيير، ويظهر المركب أبيض أو عديم اللون. المحلول الذي يحتوي على [Cu(CN)2]−، على سبيل المثال، يكون عديم اللون. من ناحية أخرى، فإن مجمعات ثماني السطوح Cu2+ بها مكان شاغر في مدارات eg، ويمكن أن تثار الإلكترونات هذا المستوى. يتوافق الطول الموجي (الطاقة) للضوء الممتص مع الجزء المرئي من الطيف، وتكون مجمعات Cu2+ دائماً ملونة تقريباً— بالأزرق، البنفسجي، الأزرق المخضر أو الأصفر.
المغناطيسية في مجمعات التنسيق
يدعم الدليل التجريبي للقياسات المغناطيسية نظرية المجمعات عالية ومنخفضة الدوران. الجزيئات مثل O2 التي تحتوي على إلكترونات غير مقترنة هي جزيئات مغناطيسية. المواد البارامغنطيسية تنجذب إلى المجالات المغناطيسية. تحتوي العديد من المجمعات المعدنية الانتقالية على إلكترونات غير متزاوجة، وبالتالي فهي ذات مغناطيسية متوازية. جزيئات مثل N2 وأيونات مثل Na+ و [Fe(CN)6]4− التي لا تحتوي على إلكترونات غير متزاوجة تكون مغناطيسية. المواد ذات النفاذية المغناطيسية تميل بشكل طفيف إلى أن تصدها المجالات المغناطيسية.
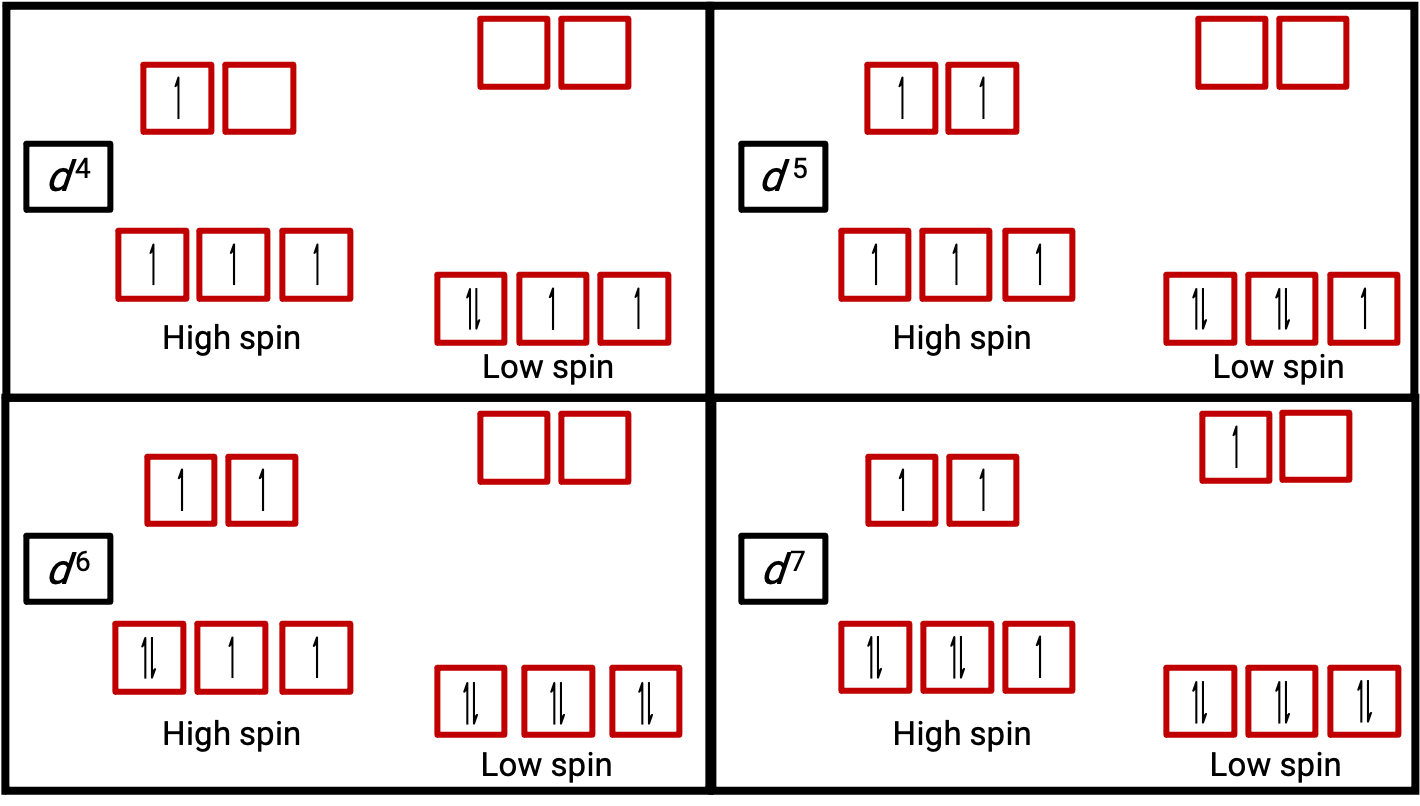
الشكل 3. المخططات المدارية للمجمعات ثمانية السطوح في حالة الدوران العالية والمنخفضة لأنظمةـ d4, d5, d6, و d7. لا يمكن إجراء هذا التمييز لأنظمة d1, d2, d3, d5, d8,d9 و d10 .
عند عدم ازدواج إلكترون في ذرة أو أيون، فإن العزم المغناطيسي الناتج عن دورانه يجعل الذرة أو الأيون كلها متوازنة. حجم العزم المغناطيسي لنظام يحتوي على إلكترونات غير مقترنة يرتبط ارتباطاً مباشراً بعدد هذه الإلكترونات: كلما زاد عدد الإلكترونات غير المزدوجة، زاد العزم المغناطيسي. لذلك، يتم استخدام العزم المغناطيسي الملحوظ لتحديد عدد الإلكترونات غير المزدوجة الموجودة. يؤكد العزم المغناطيسي المقاس للدوران المنخفض لـ d6 [Fe(CN)6]4− بأن الحديد ثنائي مغناطيسي، في حين أن الدوران العالي لـ d6 [Fe(H2O)6]2+ لأربعة إلكترونات غير مقترنة بعزم مغناطيسي يؤكد هذا الترتيب (الشكل 2).
هذا النص مقتبس من Openstax, Chemistry 2e, Section19.3: Spectroscopic and Magnetic Properties of Coordination Compounds.
